химия. Решение Согласно условию задания нам дано v 400 мл., mв 160 г., r 1,33 гмл
 Скачать 193.51 Kb. Скачать 193.51 Kb.
|
|
1.Вычислить процентную, молярную, нормальную, моляльную концентрацию и титр водного раствора вещества, если известно содержание чистого вещества в указанном объеме воды и плотность раствора.
Решение: Согласно условию задания нам дано: V = 400 мл., mв = 160 г., r = 1,33 г/мл Молярная концентрация (молярность) вещества в растворе См– это отношение количества вещества 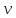 к объему раствора Vp(л). к объему раствора Vp(л).Вычислим молярную концентрацию: M = 56+3*35,5 = 162,5 г/моль 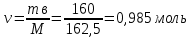 См = 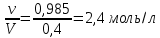 Молярная концентрация эквивалентов (нормальность) вещества в растворе Сэк – это отношение количества вещества моль эквивалентов 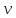 эк к объему раствора Vp(л) эк к объему раствора Vp(л)Вычислим нормальность: 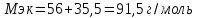 Сэк = 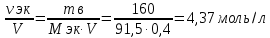 Титр Т – это отношение массы вещества (г) к объёму раствора (мл) 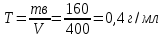 Процентная концентрация - это массовая доля вещества в растворе или отношение массы растворенного вещества mв к массе раствора mp: 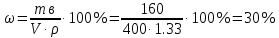 5) Моляльная концентрация (моляльность) вещества в растворе, Сm – это отношение количества о вещества 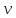 к массе растворителя ms (кг) к массе растворителя ms (кг)Сm = 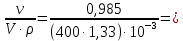 1,85 моль/кг 1,85 моль/кгОтвет: См 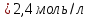 ; Сэк ; Сэк 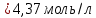 ; ; 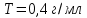 ; ; 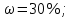 Сm =1,85 моль/кг Сm =1,85 моль/кг2.Как приготовить следующие растворы, исходя из указанных веществ (растворов).
Решение: Исходя из условия задачи, нам необходимо получить водный 2М раствор NaOH в количестве 2,5 л. 2М – обозначает, что необходимо приготовить 2-молярный раствор, то есть на 1 литр воды потребуется 2 моль NaOH. Это составит по массе значение: m = 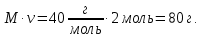 Для приготовления 2,5 л раствора потребуется: m=2,5·80г = 200 г кристаллического NaOH Ответ: Для приготовления 2,5 л 2М раствора NaOH требуется растворить 200 гр. Сухого кристаллического NaOH в 2,5 литрах воды. 3. Рассчитать объемы (мл) воды и раствора вещества данной концентрации, которые необходимы для приготовления нужного количества раствора указанной концентрации.
Решение: Исходя из формулы для процентной концентрации вещества: 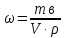 где mв – масса NaOH; V – объем раствора; 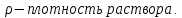 Поскольку мы готовим новый раствор только за счет изменения объема воды, то ясно, что масса вещества не изменится. Тогда: 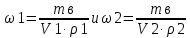 Откуда находим: 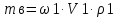 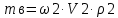 Составим равенство: 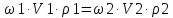 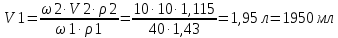 V1 – это объем раствора вещества. Следовательно, объем воды, который необходимо добавить: Vн2о = 10 л – 1.95 л = 8,05 л = 8050 мл Ответ: Объем раствора вещества равен 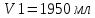 ; объем воды равен: Vн2о = 8050 мл. ; объем воды равен: Vн2о = 8050 мл.4. Определите константу равновесия реакции получения метанола из оксида углерода и водорода при 298 к СО+2Н2=СН3OH (ж) Решение: Константа равновесия может быть определена через энергию Гиббса. Kp=exp(-∆G0/RT) При образовании жидкого метанола при T=298 К значение энергии Гиббса равно: Δ Go = -166,27 кДж/моль R = 8,31 – универсальная газовая постоянная Kp=exp(166,27 /8.31*298) = 1,07 Ответ: Кр = 1,07 5.При растворении карбоната натрия в воде среда становится основной. что обусловлено реакцией гидролиза. Первая ступень гидролиза в молекулярной форме может быть представлена уравнением: Na2CO3 (p)+H2O=NaOH+NaHCO3 Если система находится в равновесии, то какие внешние воздействия вызовут увеличение концентрации щелочи? Решение: Рассмотрим решение задачи исходя из принципа Ле Шателье. Влияние концентрации. При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции. Следовательно, если увеличить концентрацию Na2CO3 в нашем случае, то можно увеличить концентрацию NaOH. Влияние давления. Поскольку исходные вещества и продукты реакции не являются газами, то изменение давления не сможет значительно повлиять на изменение концентрации. Влияние температуры. С увеличением температуры равновесие смещаются в сторону эндотермических реакции, т.е. реакций протекание которых обеспечивает поглощение теплоты. Реакция гидролиза протекает с поглощением теплоты. По принципу Ле Шателье, повышение температуры приведет к смещению равновесия в сторону продуктов реакции. Следовательно, при повышении температуры так же можно увеличить концентрацию щелочи. 6.Во сколько раз изменится скорость реакции с данным значением температурного коэффициента и при увеличении температуры на t°C.
Решение: Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые 10 0С скорость химической реакции возрастает в два - четыре раза. 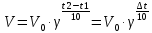 где V1 – скорость реакции при начальной температуре системы t1, V2 – скорость реакции при конечной температуре системы t2, γ – температурный коэффициент реакции, равный 2÷4. В нашем случае γ =2 и 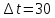 Изменение скорости реакции при увеличении температуры от Т1 до Т2 равно: 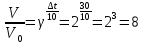 Ответ: При изменении температуры на 30 градусов скорость реакции увеличивается в 8 раз. 7.Напишите выражение константы равновесия для систем: СО +Н2О Решение: Обратимая химическая реакция протекает в прямом или обратном направлении до состояния химического равновесия. Закон действующих масс применяется и для обратимых химических реакций в виде выражения для константы химического равновесия К. Для обратимой гомогенной химической реакции аА + вВ  dD + qQ dD + qQК = Сd(D) ∙C q(Q)/ Са(A) ∙ Св(B), C – равновесная концентрация каждого вещества Следовательно: 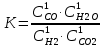 8.Как будет влиять изменение давления на равновесие в системах
Решение: Согласно принципу Ле Шателье: Смещение равновесия при изменении давления зависит от числа молекул газообразных исходных веществ и газообразных продуктов реакции. При повышении давления равновесие смещается в направлении реакции, протекающей с уменьшением числа молекул газов (давление в системе будет уменьшаться). Давление не влияет на состояние равновесия, если при протекании реакции число молекул газа не изменяется. В нашем случае в исходных продуктах содержится 2 молекулы хлора, а в продуктах реакции одна молекула кислорода, следовательно число молекул газообразных веществ уменьшается, а это значит, что при увеличении давления в системе будет происходить смещение равновесия в сторону прямой реакции. 9.Как будет влиять изменение температуры на равновесие следующих системах:
Решение: Согласно принципу Ле Шателье: Смещение равновесия при изменении температуры определяется знаком теплового эффекта химической реакции Hr . При повышении температуры равновесие смещается в сторону эндотермической реакции Hr > 0, реакции с поглощением теплоты (температура в системе будет понижаться). При понижении температуры равновесие смещается в сторону экзотермической реакции Hr < 0, реакции с выделением теплоты (температура в системе будет повышаться). По условию задачи для прямой реакции Hr > 0, она является эндотермической, следовательно равновесие смещается в сторону прямой реакции. 10.Определить , во сколько раз изменится скорость реакции при увеличении давления в два раза:
Решение: Скорость реакции первого порядка характеризуется кинетическим уравнением v=kc Первый порядок, например, имеют реакции диссоциации или разложения молекул. При увеличении давления в системе в 2 раза во столько же раз уменьшится объём (PV = const) и, соответственно, увеличится концентрация каждого из реагирующих газообразных веществ. Кинетическое уравнение реакции будет иметь вид: 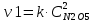 и и 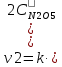 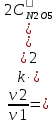 Ответ: скорость реакции увеличится в 4 раза. 11.Рассчитайте стандартную теплоту образования вещества при 298 К, если известен стандартный тепловой эффект реакции
В результате реакции из 1 моля перекиси водорода образовалось 1 моль воды и 0.5 моль кислорода. Энтальпия образования простых веществ полагается равной нулю. Следовательно, энтальпия образования кислорода равна 0. Составим выражение нахождения теплового эффекта для данной реакции: ΔН = ΔН0(H2O) - ΔН0(H2O2) = -98,8 кДж/моль Стандартная теплота образования H2O2 = -187 кДж/моль -98,8 кДж/моль = ΔН0(H2O) – (-187 кДж/моль) ΔН0(H2O) = -98,8 кДж/моль + (-187 кДж/моль) = -285,8 кДж/моль Ответ: Стандартная теплота образования жидкой воды равна -285,8 кДж/моль 12.Рассчитайте, сколько тепла выделится (поглотится) при проведении химической реакции, если взято определенное количество данного вещества.
Решение: Определим количество вещества: М(С2Н2) = 12*2+2 = 26 г/моль ν = 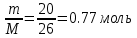 ΔН = ΔН0(С2Н4) - ΔН0(С2Н2) = -168,5 кДж/моль ΔН0(С2Н2) = ΔН0(С2Н4) +168,5 кДж/моль = 52,3+168,5 = 220,8 кДж/моль Количество тепла: Q = ν· ΔН0(С2Н2) = 0.77·220,8 = 170 кДж. Ответ: поглощается 170 кДж тепла. 13.Рассчитайте изменение стандартной энтропии системы при протекании химических реакций. 4НСl(г) + О2(г) = 2Н2О(Г) + 2С12(г) Решение: ΔS = 2·ΔS0(H2O)+ 2·ΔS0(Сl2) - 4·ΔS0(HCl) - ΔS0(O2) = = 2·234,4 + 2·222,9 - 4·186,7 - 205 = -37,2 Ответ: ΔS = -37,2. 14.Вычислить тепловой эффект реакций СО(г) + 0.5 О2(г) = СО2(г) Решение: Вычислим тепловой эффект реакции при температуре 298 К ΔН = ΔН0(СO2) - ΔН0(СO) = -393,5 - (-110,5) = -283 кДж/моль Ответ: ΔН = - 283 кДж/моль. 15.Определите степень окисления и координационное число комплексообразователя в указанных комплексных соединениях. Привести названия соединений. K2[Cd(CN)4] Решение: K2[Cd(CN)4] – тетрацианокадмат калия. Комплексообразователь – кадмий Cd. Координационное число равно 4, поскольку комплексообразователь в данном соединении координирует количество лигандов равное 4. В данном случае лиганды – это ионы CN. Поскольку внешняя сфера в данном случае образована двумя ионами К+ то степень окисления комплекса равна -2: [Cd(CN)4]2- 16.Определить тип гибридизации комплексообразователя. Использовать метод валентных связей. K2[PtCl6] Решение: Комплексообразователь – платина Pt имеет координационное число 6 и заряд центрального атома +4. Электронная формула платины: 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 Согласно методу ВС: Свободные (вакантные) орбитали центрального атома, участвующие в образовании координационных связей, гибридизированы и гибридные орбитали имеют вполне определенное направление в пространстве, то есть тип гибридизации вакантных орбиталей центрального атома определяет как число координированных лигандов, так и пространственную конфигурацию комплекса. Соответствующее число орбиталей и тип гибридизации для платины: d2sp3 . 17.Составить уравнения электролитической диссоциации комплексных соединений. Указать заряд катиона и аниона. K2[PdBr4] Решение: K2[PdBr4] ↔ 2K+ + PdBr42- 18.Написать координационные формулы следующих комплексных соединений и привести их названия. 3NaF AlF3 Решение: 3NaF AlF3 - Гексафтороалюминат натрия (Криолит). Координационная формула: Na3[AlF6] 19.Определить величину и знак заряда комплексного иона и составить выражение его константы нестойкости. [Co3+( NH3)5Cl] Решение: Заряд комплексного иона: +3+5*0+1*(-1) = +2 Получаем ион [Co3+(NH3)5Cl]2+, который диссоциирует на: [Co(NH3)5Cl]2+ ↔ Со3+ + 5NH3 + Cl- Константа нестойкости:  20.Пользуясь методом МО, определить, возможно ли образование молекулы: Ne2 Решение: В двухатомной молекуле неона 2 × 8 = 16 электронов попарно заполняют все восемь МО. Поскольку среди последних равное количество связывающих и разрыхляющих орбиталей, порядок связи равен нулю и в стационарном состоянии молекула неона неустойчива. Следовательно, образование молекулы Ne2 невозможно. 21.Показать строение молекулы по методу МО, определить порядок связи, предсказать её магнитные свойства: Li2 Два валентных электрона двух атомов Li (2s1) в стационарном состоянии занимают наинизшую по энергии МО и электронная формула молекулы имеет вид:(σ2s)2. Поскольку на связывающей МО находятся два электрона, а на разрыхляющей МО электронов нет, то порядок связи в молекуле равен 1. Наличие внутренних 1s-электронов обуславливает и существенное понижение энергии связи в молекуле Li2 по сравнению с молекулой водорода. 22.Показать строение молекулы по методу ВС. Определить тип гибридизации валентных орбиталей: MgO Решение: Согласно методу валентных связей, связь между атомами А и В образуется с помощью общей пары электронов. Изобразим электронные схемы атомов магния и кислорода. Электронная формула магния: 1s 22s 22p 63s 2 Электронная формула кислорода: 1s 22s 22p 4   Поскольку в молекуле кислорода на 2p орбитали присутствует 2 неспаренных электрона, то образование молекулы MgO происходит при смешивании одной 3s-орбитали магния и одной 2p-орбитали кислорода, следовательно, тип гибридизации sp. 23.По методу ВС определить количество Решение: Согласно методу ВС кратность связи определяется количеством электронных пар, связывающих два атома. При образовании молекулы MgO образуется одна двойная связь, следовательно образуется одна сигма-связь и одна 24.Сколько электронов находится на разрыхляющих МО в молекуле: B2 Решение: Электронная формула двухатомной молекулы бора: (σ2s)2 (σ*2s)2 (π2рy)1(π2рz)1. В соответствии с правилом Хунда две верхние вырожденные МО π2р заполняются по одному электрону с одинаковым направлением спинов. Количество электронов на разрыхляющих МО равно 2. Порядок связи равен: ½(4 – 2) = 1. 25.Составить электронные формулы и электронные схемы следующих атомов. Определить к какому типу (s, р, d, f) элементов относится каждый из них: Sr Решение: Электронная формула стронция: 1s22s22p63s23p64s23d104p65s2 Электронная схема атома стронция:  26.Составить электронные формулы и электронные схемы ионов: Fe+2 Электронная формула железа Fe: 1s22s22p63s23p64s23d6 Следовательно, электронная формула иона железа Fe+2: 1s 22s 22p 63s 23p64s 13d5 Поскольку на d уровне не может быть 4 электрона, то один электрон «проваливается» с уровня s1. Электронная схема иона железа:  27.Определить число неспаренных электронов для атомов элементов: Ва Барий — элемент главной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 56. Электронная формула: 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 Электронная схема атома бария:  Как видно из его электронной конфигурации, барий не имеет неспаренных электронов в невозбужденном состоянии. 28.Определить, какому элементу соответствует окончание электронной формулы: 4d15s2 Решение: Этот элемент Иттрий Y. Его электронная формула: 1s 22s 22p 63s 23p64s 23d104p65s24d1 29.Определить, с атомов каких элементов начинают формироваться указанные ниже подуровни: 4f Решение: 4f-электрон появляется в атоме церия Ce. Его электронная формула: 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 30.Составить молекулярные формулы следующих солей. Написать реакции диссоциации солей, указав названия ионов: 1) гидрокарбонат кадмия (III) 2) силикат гидроксомагния. Решение: гидрокарбонат кадмия (III) – Cd(НCO3)3 . Диссоциирует на катион кадмия Cd3+ и три аниона гидрокарбоната НCO3- Cd(НCO3)3 ↔ Cd3+ + 3НCO3- Силикат гидроксомагния (MgOH)2Si03. Диссоциирует на 2 катиона гидроксомагния 2MgOH- и анион (силикат-ион) Si032- (MgOH)2Si03 ↔ 2MgOH- + Si032- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
