Сцинтилляция. Сцинтилляция Сцинтилляция от лат scintillatio, мерцание
 Скачать 137.83 Kb. Скачать 137.83 Kb.
|
|
Сцинтилляция Сцинтилля́ция (от лат. scintillatio, «мерцание») — люминесценция малой продолжительности (длительностью от наносекунд до микросекунд) возникающая в результате взаимодействия сплошной среды-сцинтиллятора с ионизирующим излучением (альфа-частицами, гамма-квантами, быстрыми электронами, протонами и другими заряженными частицами). Явление сцинтилляции применяется для обнаружения частиц и излучения, например, сцинтилляционные детекторы регистрируют отдельные частицы[ ИсторияЯвление было открыто У. Круксом, наблюдавшим свечение сульфида цинка при облучении его альфа-частицами от радиоактивного материала. Механизм возникновенияКонкретный механизм и параметры (спектр, длительность) сцинтилляции зависит от сцинтиллятора, общий принцип состоит в том, что электронная система атомов или молекул сплошной среды переходит в возбуждённое состояние после взаимодействия с заряженной частицей или гамма-частицей, а при возврате в основное невозбуждённое состояние или промежуточные возбуждённые состояния испускаются один или несколько оптических фотонов. Передаваемая энергия в оптическое излучение и яркость вспышки сильно зависит от ионизирующей способности поглощённой частицы, например, свечение, вызываемое альфа-частицами и быстрыми протонами, значительно выше, чем свечение вызванное взаимодействием с электронами. Кроме того, интенсивность сцинтилляции зависит от энергии частицы, что позволяет определять энергетический спектр излучения. Сцинтилляция наблюдается в органических веществах, а также во многих неорганических материалах — кристаллах, газах и жидкостях. Спектр излучения большинства практически используемых сцинтилляторов лежит в синей и ультрафиолетовой частях спектра. Некоторые сцинтилляторыНеорганические сцинтилляторыНеорганические сцинтилляторы в основном применяются для регистрации гамма-излучения, так как гамма-излучение плохо поглощается органическими материалами, причём чем более тяжёлые элементы (химические элементы с бо́льшим зарядом ядра) применены, тем выше поглощение. Поэтому в качестве сцинтилляторов в сцинтилляционных детекторах гамма-частиц применяются монокристаллы иодида натрия, активированные таллием NaI(Tl). Для увеличения быстродействия (уменьшения длительности высвечивания) используют монокристаллы фторида цезия CsF, но по световому выходу этот материал менее эффективен (5 % от светового выхода NaI)[3]. Органические сцинтилляторыВ органических молекулах сцинтилляция вызывается электронными переходами в �  -орбиталях атомов углерода. Большинство органических веществ в твёрдом состоянии образуют молекулярные кристаллы, в которых молекулы слабо связаны силами Ван-дер-Ваальса. -орбиталях атомов углерода. Большинство органических веществ в твёрдом состоянии образуют молекулярные кристаллы, в которых молекулы слабо связаны силами Ван-дер-Ваальса.Основное состояние атома углерода — 1�22�22�2  . По теории валентных связей, в соединениях один из 2� . По теории валентных связей, в соединениях один из 2� -электронов углерода переходит в состояние 2� -электронов углерода переходит в состояние 2� , что переводит атом углерода в состояние 1�22�12�3. , что переводит атом углерода в состояние 1�22�12�3. Для описания различных валентных связей углерода четыре орбитали валентных электронов, одна 2� Для описания различных валентных связей углерода четыре орбитали валентных электронов, одна 2� и три 2� и три 2� полагаются смешанными или гибридизированными в нескольких различных конфигурациях. Например, в тетраэдрической валентной конфигурации электронные орбитали � полагаются смешанными или гибридизированными в нескольких различных конфигурациях. Например, в тетраэдрической валентной конфигурации электронные орбитали � и �3 и �3 объединяются, образуя четыре смешанных орбитали. В другой электронной конфигурации — тригональной конфигурации, одна из � объединяются, образуя четыре смешанных орбитали. В другой электронной конфигурации — тригональной конфигурации, одна из � -орбиталей (например, �� -орбиталей (например, �� ) остается неизменной, и три гибридные орбитали создаются путем смешивания �, �� ) остается неизменной, и три гибридные орбитали создаются путем смешивания �, �� и �� и �� орбиталей. Орбитали, симметричные относительно осей связи и плоскости молекулы (��2 орбиталей. Орбитали, симметричные относительно осей связи и плоскости молекулы (��2 ) называют � ) называют � -электронами, и эти связи называются � -электронами, и эти связи называются � -связями. Орбиталь �� -связями. Орбиталь �� называется � называется � -орбиталью. � -орбиталью. � -связь возникает при взаимодействии двух � -связь возникает при взаимодействии двух � -орбиталей. Это происходит, когда их узловые плоскости находятся в одной плоскости. -орбиталей. Это происходит, когда их узловые плоскости находятся в одной плоскости.В некоторых органических молекулах �  -орбитали взаимодействуют, образуя общую узловую плоскость. Они образуют делокализованные � -орбитали взаимодействуют, образуя общую узловую плоскость. Они образуют делокализованные � -электроны, которые могут быть возбуждены излучением. Переход в основное состояние делокализованных � -электроны, которые могут быть возбуждены излучением. Переход в основное состояние делокализованных � -электронов вызывает люминесценцию. -электронов вызывает люминесценцию.Возбужденные состояния �  -электронных систем можно объяснить с помощью модели внешних свободных электронов, предложенную Платтом (Platt) в 1949 году. Эта модель применяется для описания электронной структуры поликонденсированных углеводородов, состоящих из нескольких связанных бензольных колец, в которых ни один атом углерода не принадлежит более чем двум кольцам, а каждый другой атом углерода находится на периферии кольца. -электронных систем можно объяснить с помощью модели внешних свободных электронов, предложенную Платтом (Platt) в 1949 году. Эта модель применяется для описания электронной структуры поликонденсированных углеводородов, состоящих из нескольких связанных бензольных колец, в которых ни один атом углерода не принадлежит более чем двум кольцам, а каждый другой атом углерода находится на периферии кольца.Ароматическое кольцо можно представить как окружностью длиной �  . Волновая функция электронной орбитали должна удовлетворять условию плоского ротатора: . Волновая функция электронной орбитали должна удовлетворять условию плоского ротатора:�(�)=�(�+�),  где �  — координата вдоль окружности. — координата вдоль окружности.Соответствующие этому случаю решения волнового уравнения Шредингера: �0=(1�)12,��1=(2�)12cos(2� ���),��2=(2�)12sin(2� ���),��=�2ℏ22�0�2,  где �  — орбитальное квантовое число электронов в молекуле или число узлов волновой функции; — орбитальное квантовое число электронов в молекуле или число узлов волновой функции;�0  — масса электрона; — масса электрона;ℏ  — редуцированная постоянная Планка. — редуцированная постоянная Планка.Поскольку у электрона спин может иметь два разных направления и он может вращаться по окружности в обеих направлениях, все уровни энергии, кроме самого нижнего, основного уровня, дважды вырождены. На рисунке 1 показаны �  -электронные уровни энергии органической молекулы. Поглощение излучения сопровождается молекулярной колебаниями и переходом в состояние �1 -электронные уровни энергии органической молекулы. Поглощение излучения сопровождается молекулярной колебаниями и переходом в состояние �1 Из этого состояния происходит переход в состояние �0 Из этого состояния происходит переход в состояние �0 , сопровождаемый флуоресценцией, при этом происходит часть переходов в триплетные состояния. Возбуждение триплетных состояний возможно и другими способами. , сопровождаемый флуоресценцией, при этом происходит часть переходов в триплетные состояния. Возбуждение триплетных состояний возможно и другими способами.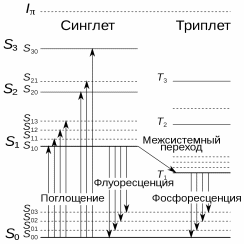 Рисунок 1. Электронные уровни энергии органической молекулы. �0 −  основное состояние, основное состояние,�1, �2, �3 −  возбуждённые синглетные состояния, возбуждённые синглетные состояния,�1, �2, �3 −  возбуждённые триплетные состояния, возбуждённые триплетные состояния,�00, �01, �10, �11  и другие — колебательные подуровни. и другие — колебательные подуровни.Поскольку у электрона спин может иметь два разных направления и он может вращаться по окружности в обеих направлениях, все уровни энергии, кроме самого нижнего, основного уровня, дважды вырождены. На рисунке 1 показаны �  -электронные уровни энергии органической молекулы. Поглощение излучения сопровождается молекулярной колебаниями и переходом в состояние �1 -электронные уровни энергии органической молекулы. Поглощение излучения сопровождается молекулярной колебаниями и переходом в состояние �1 Из этого состояния происходит переход в состояние �0 Из этого состояния происходит переход в состояние �0 , сопровождаемый флуоресценцией, при этом происходит часть переходов в триплетные состояния. Возбуждение триплетных состояний возможно и другими способами. , сопровождаемый флуоресценцией, при этом происходит часть переходов в триплетные состояния. Возбуждение триплетных состояний возможно и другими способами. Рисунок 2. Типовая временна́я зависимость кривой высвечивания сцинтиллятора от единичного возбуждения ионизирующей частицей. Триплетные состояния характерны тем, распадаются с гораздо более длительным временем, чем синглетные состояния, что приводит к так называемым медленным переходом в основное состояние, а процесс флуоресценции происходит быстро и называется быстрой составляющей сцинтилляции. В зависимости от конкретного случая, потери энергии на единицу длины пробега определённой частицы (��/��  ) разделяются на «быстрое» и «медленное» высвечивание и происходят с разной вероятностью. Таким образом, относительные интенсивности светового выхода распада этих состояний различаются для разных ��/��. ) разделяются на «быстрое» и «медленное» высвечивание и происходят с разной вероятностью. Таким образом, относительные интенсивности светового выхода распада этих состояний различаются для разных ��/��. Эта особенность сцинтилляторов по длительностям свечения и послесвечения позволяет определить, какая частица была поглощена. Эта разница в форме светового импульса видна на его спадающей стороне, так как она связана с распадом возбужденных триплетных состояний (рисунок 2). Эта особенность сцинтилляторов по длительностям свечения и послесвечения позволяет определить, какая частица была поглощена. Эта разница в форме светового импульса видна на его спадающей стороне, так как она связана с распадом возбужденных триплетных состояний (рисунок 2). |
