алканы. Строение алканов
 Скачать 258.6 Kb. Скачать 258.6 Kb.
|
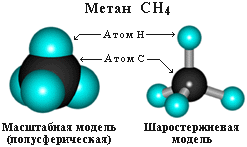
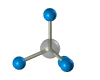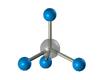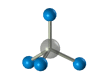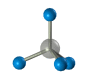
 Строение алканов Строение алкановХимическое строение (порядок соединения атомов в молекулах) простейших алканов – метана, этана и пропана – показывают их структурные формулы, приведенные в разделе 2. Из этих формул видно, что в алканах имеются два типа химических связей: С–С и С–Н. Связь С–С является ковалентной неполярной. Связь С–Н - ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности (2.5 - для углерода и 2.1 - для водорода). Образование ковалентных связей в алканах за счет общих электронных пар атомов углерода и водорода можно показать с помощью электронных формул: 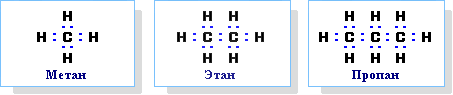 Электронные и структурные формулы отражают химическое строение, но не дают представления о пространственном строении молекул, которое существенно влияет на свойства вещества. Пространственное строение, т.е. взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности. Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации (часть I, раздел 4.3). Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp3-гибридизации (часть I, раздел 4.3.1). В этом случае каждая из четырех sp3-гибридных АО углерода участвует в осевом (σ-) перекрывании с s-АО водорода или с sp3-АО другого атома углерода, образуя σ-связи С-Н или С-С. 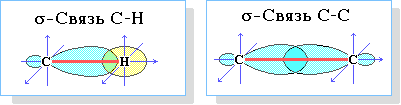 Четыре σ-связи углерода направлены в пространстве под углом 109о28', что соответствует наименьшему отталкиванию электронов. Поэтому молекула простейшего представителя алканов – метана СН4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода: 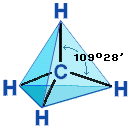 Валентный угол Н-С-Н равен 109о28'. Пространственное строение метана можно показать с помощью объемных (масштабных) и шаростержневых моделей.
Для записи удобно использовать пространственную (стереохимическую) формулу. 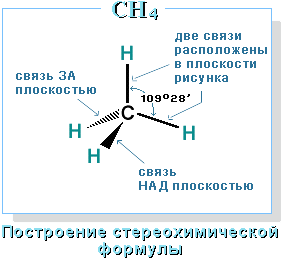 В молекуле следующего гомолога – этана С2Н6 – два тетраэдрических sp3-атома углерода образуют более сложную пространственную конструкцию: 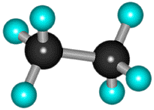 Для молекул алканов, содержащих свыше 2-х атомов углерода, характерны изогнутые формы.Это можно показать на примере н-бутана (VRML-модель) или н-пентана: 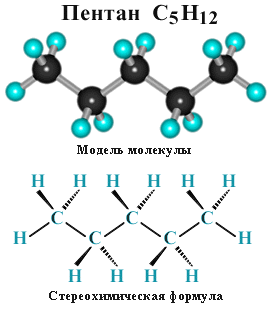 Изомерия алканов Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами. Различия в порядке соединения атомов в молекулах (т.е. в химическом строении) приводят кструктурной изомерии. Строение структурных изомеров отражается структурными формулами. В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т.е. начиная с бутана С4Н10. Если в молекулах одинакового состава и одинакового химического строения возможно различное взаимное расположение атомов в пространстве, то наблюдается пространственная изомерия (стереоизомерия). В этом случае использование структурных формул недостаточно и следует применять модели молекул или специальные формулы - стереохимические (пространственные) или проекционные. Алканы, начиная с этана H3C–СН3, существуют в различных пространственных формах (конформациях), обусловленных внутримолекулярным вращением по σ-связям С–С, и проявляют так называемую поворотную (конформационную) изомерию. Кроме того, при наличии в молекуле атома углерода, связанного с 4-мя различными заместителями, возможен еще один вид пространственной изомерии, когда два стереоизомера относятся друг к другу как предмет и его зеркальное изображение (подобно тому, как левая рука относится к правой). Такие различия в строении молекул называют оптической изомерией. . Структурная изомерия алканов Структурные изомеры - соединения одинакового состава, отличающиеся порядком связывания атомов, т.е. химическим строением молекул. Причиной проявления структурной изомерии в ряду алканов являетсяспособность атомов углерода образовывать цепи различного строения.Этот вид структурной изомерии называется изомерией углеродного скелета. Например, алкан состава C4H10 может существовать в виде двух структурных изомеров: 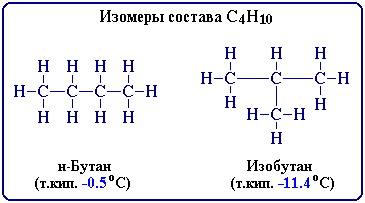 а алкан С5Н12 – в виде трех структурных изомеров,отличающихся строением углеродной цепи: 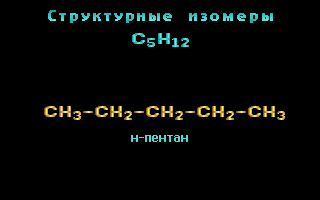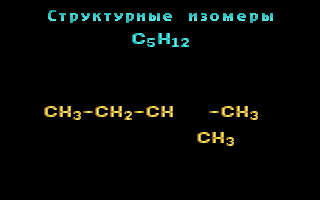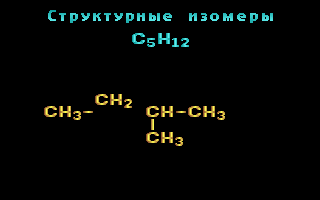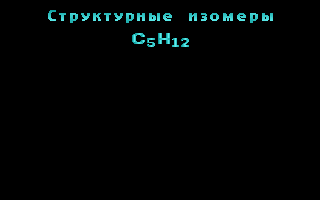 С увеличением числа атомов углерода в составе молекул увеличиваютсявозможности дляразветвления цепи, т.е. количество изомеров растет сростом числа углеродных атомов.  Структурные изомеры отличаются физическими свойствами. Алканы с разветвленным строением из-за менее плотной упаковки молекул и,соответственно, меньших межмолекулярных взаимодействий, кипят при болеенизкой температуре, чем их неразветвленные изомеры. Приемы построения структурных формул изомеров Рассмотрим на примере алкана С6Н14. 1. Сначала изображаем молекулу линейного изомера (ее углеродный скелет) 2. Затем цепь сокращаем на 1 атом углерода и этот атом присоединяем к какому-либо атому углерода цепи как ответвление от нее, исключая крайние положения: Если присоединить углеродный атом к одному из крайних положений, то химическое строение цепи не изменится: Кроме того, нужно следить, чтобы не было повторов. Так, структура 3. Когда все положения основной цепи исчерпаны, сокращаем цепь еще на 1 атом углерода: Теперь в боковых ответвлениях разместятся 2 атома углерода. Здесь возможны следующие сочетания атомов: 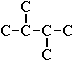 (4) и (4) и  (5) (5)Боковой заместитель может состоять из 2-х или более последовательно соединенных атомов углерода, но для гексана изомеров с такими боковыми ответвлениями не существует, и структура Боковой заместитель СС можно размещать только в цепи, содержащей не меньше 5-ти углеродных атомов и присоединять его можно только к 3-му и далее атому от конца цепи. 4. После построения углеродного скелета изомера необходимо дополнить все углеродные атомы в молекуле связями с водородом, учитывая, что углерод четырехвалентен. Итак, составу С6Н14 соответствует 5 изомеров: 1) 2) 3) 4) 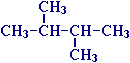 5) 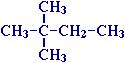 Номенклатура Номенклатура органических соединений – система правил, позволяющих дать однозначное название каждому индивидуальному веществу. Это язык химии, который используется для передачи в названиях соединений информации о их строении. Соединению определенного строения соответствует одно систематическое название, и по этому названию можно представить строение соединения (его структурную формулу). В настоящее время общепринятой является систематическая номенклатура ИЮПАК (IUPAC – International Union of the Pure and Applied Chemistry – Международный союз теоретической и прикладной химии). Наряду с систематическими названиями используются также тривиальные (обыденные) названия, которые связаны с характерным свойством вещества, способом его получения, природным источником, областью применения и т.д., но не отражают его строения. Для применения номенклатуры ИЮПАК необходимо знать названия и строение определенных фрагментов молекул – органических радикалов. Термин "органический радикал" является структурным понятием и его не следует путать с термином "свободный радикал", который характеризует атом или группу атомов с неспаренным электроном. Радикалы в ряду алканов Если от молекулы алкана "отнять" один атом водоpода, то обpазуется одновалентный "остаток" – углеводоpодный pадикал (R–). Общее название одновалентных радикалов алканов – алкилы – обpазовано заменой суффикса -ан на -ил: метан – метил, этан – этил, пpопан – пpопил и т.д. Одновалентные pадикалы выpажаются общей фоpмулой СnН2n+1. Двухвалентный радикал получается, если удалить из молекулы 2 атома водорода. Например, из метана можно образовать двухвалентный радикал –СН2– метилен. В названиях таких радикалов используется суффикс -илен. Названия радикалов, особенно одновалентных, используются при образовании названий разветвленных алканов и других соединений. Такие радикалы можно рассматривать как составные части молекул, их конструкционные детали. Чтобы дать название соединению необходимо представить, из каких "деталей"-радикалов составлена его молекула. Метану СН4 соответствует один одновалентный радикал метил СН3.  От этана С2Н6 можно произвести также только один радикал - этил CH2 CH3(или C2H5). Пропану СН3–СН2–СН3 соответствуют два изомерных радикала С3Н7: 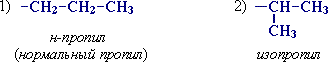 Радикалы подразделяются на первичные, вторичные и третичные в зависимости от того, укакого атома углерода (первичного, вторичного или третичного) находится свободная валентность. По этому признаку н-пропил относится к первичным радикалам, а изопропил – к вторичным. Двум алканам С4Н10 (н-бутан и изобутан) соответствует 4 одновалентных радикала –С4Н9: 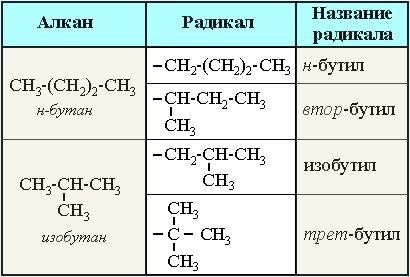 - от н-бутана производятся н-бутил (первичный радикал) и втор-бутил (вторичный радикал), - от изобутана – изобутил (первичный радикал) и трет-бутил (третичный радикал). Таким образом, в ряду радикалов также наблюдается явление изомерии, но при этом число изомеров больше, чем у соответствующих алканов. Конструирование молекул алканов из радикалов Например, молекулу можно "собрать" тремя способами из различных пар одновалентных радикалов: 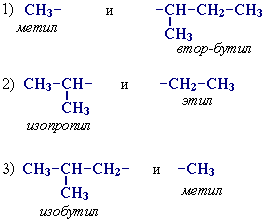 Такой подход используется в некоторых синтезах органических соединений, например: где R – одновалентный углеводородный радикал (реакция Вюрца). Правила построения названий алканов по систематической международной номенклатуре ИЮПАК Для простейших алканов (С1-С4) приняты тpивиальные названия: метан, этан, пpопан, бутан, изобутан. Начиная с пятого гомолога, названия нормальных (неpазветвленных) алканов стpоят в соответствии с числом атомов углеpода, используя гpеческие числительные и суффикс -ан: пентан, гексан, гептан, октан, нонан, декан и далее... В основе названия разветвленного алкана лежит название входящего в его конструкцию нормального алкана с наиболее длинной углеродной цепью. При этом углеводоpод с pазветвленной цепью pассматpивают как пpодукт замещения атомов водоpода в ноpмальном алкане углеводоpодными pадикалами. Например, алкан рассматривается как замещенный пентан, в котором два атома водорода замещены на радикалы –СН3(метил). Порядок построения названия разветвленного алкана Выбрать в молекуле главную углеродную цепь. Во-первых, она должна быть самой длинной. Во-вторых, если имеются две или более одинаковые по длине цепи, то из них выбирается наиболее разветвленная. Например, в молекуле есть 2 цепи с одинаковым числом (7) атомов С (выделены цветом):  В случае (а) цепь имеет 1 заместитель, а в (б) – 2. Поэтому следует выбрать вариант (б). Пронумеровать атомы углерода в главной цепи так, чтобы атомы С, связанные с заместителями, получили возможно меньшие номера. Поэтому нумерацию начинают с ближайшего к ответвлению конца цепи. Например: 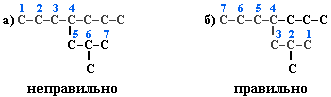 Назвать все радикалы (заместители), указав впереди цифры, обозначающие их местоположение в главной цепи. Если есть несколько одинаковых заместителей, то для каждого из них через запятую записывается цифра (местоположение), а их количество указывается приставками ди-, три-, тетра-, пента- и т.д. (например, 2,2-диметил или2,3,3,5-тетраметил). Названия всех заместителей расположить в алфавитном порядке (так установлено последними правилами ИЮПАК). Назвать главную цепь углеродных атомов, т.е. соответствующий нормальный алкан. Таким образом, в названии разветвленного алкана корень+суффикс – название нормального алкана (греч. числительное+суффикс "ан"), приставки – цифры и названия углеводородных радикалов. Пример построения названия: 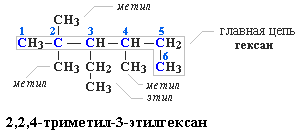 Химические свойства алканов Химические свойства любого соединения определяются его строением, т.е. природой входящих в его состав атомов и характером связей между ними. Исходя из этого положения и справочных данных о связях С–С и С–Н, попробуем предсказать, какие реакции характерны для алканов.  Во-первых, предельная насыщенность алканов не допускает реакций присоединения, но не препятствует реакциям разложения, изомеризации и замещения (см. часть I, раздел 6.4 "Типы реакций"). Во-вторых, симметричность неполярных С–С и слабополярных С–Н ковалентных связей (см. в таблице значения дипольных моментов) предполагает их гомолитический (симметричный) разрыв на свободные радикалы (часть I, раздел 6.4.3). Следовательно, для реакций алканов характерен радикальный механизм. Поскольку гетеролитический разрыв связей С–С и С–Н в обычных условиях не происходит, то в ионные реакции алканы практически не вступают. Это проявляется в их устойчивости к действию полярных реагентов (кислот, щелочей, окислителей ионного типа: КMnO4, К2Сr2O7 и т.п.). Такая инертность алканов в ионных реакциях и послужила ранее основанием считать их неактивными веществами и назвать парафинами. Итак, алканы проявляют свою реакционную способность в основном в радикальных реакциях. Условия проведения таких реакций: повышенная температура (часто реакцию проводят в газовой фазе), действие света или радиоактивного излучения, присутствие соединений – источников свободных радикалов (инициаторов), неполярные растворители. В зависимости от того, какая связь в молекуле разрывается в первую очередь, реакции алканов подразделяются на следующие типы. С разрывом связей С–С происходят реакции разложения (крекинг алканов) и изомеризацииуглеродного скелета. По связям С–Н возможны реакции замещения атома водорода или его отщепления(дегидрирование алканов). Кроме того, атомы углерода в алканах находятся в наиболее восстановленной форме (степень окисления углерода, например, в метане равна –4, в этане –3 и т.д.) и в присутствии окислителей в определенных условиях будут происходить реакции окисления алканов с участием связей С–С и С–Н.
Крекинг алканов Крекинг – процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью. Крекинг алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел и т.п., а также сырья для химической и нефтехимической промышленности. Для осуществления этого процесса используются два способа: термический крекинг (при нагревании без доступа воздуха) и каталитический крекинг (более умеренное нагревание в присутствии катализатора). Термический крекинг. При температуре 450–700 oС алканы распадаются за счет разрыва связей С–С (более прочные связи С–Н при такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов. Например: C6H14 Распад связей происходит гомолитически с образованием свободных радикалов: Свободные радикалы очень активны. Один из них (например, этил) отщепляет атомарный водород Н от другого (н-бутила) и превращается в алкан (этан). Другой радикал, став двухвалентным, превращается в алкен (бутен-1) за счет образования π–связи при спаривании двух электронов у соседних атомов: 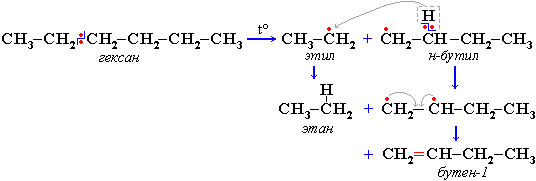 Анимация (работа Литвишко Алексея, ученика 9 кл. школы №124 г. Самары) Разрыв С–С-связи возможен в любом случайном месте молекулы. Поэтому образуется смесь алканов и алкенов с меньшей, чем у исходного алкана, молекулярной массой. 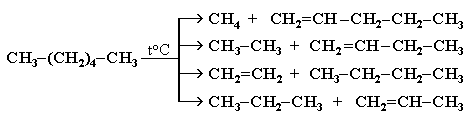 В общем виде этот процесс можно выразить схемой: CnH2n+2 При более высокой температуре (свыше 1000С) происходит разрыв не только связей С–С,но и более прочных связей С–Н. Например, термический крекинг метана используется для получения сажи (чистыйуглерод) и водорода: СН4 Термический крекинг был открыт русским инженером В.Г. Шуховым в 1891 г. Каталитический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 500С и атмосферном давлении. При этом наряду с разрывом молекул происходят реакции изомеризации и дегидрирования. Пример: крекинг октана (работа Литвишко Алексея, ученика 9 кл. школы №124 г. Самары). При дегидрировании алканов образуются циклические углеводороды (реакциядегидроциклизации, раздел 2.5.3). Наличие в составе бензина разветвлённых и циклических углеводородов повышает его качество (детонационную устойчивость, выражаемую октановым числом). При крекинг-процессах образуется большое количество газов, которые содержат главным образом предельные и непредельные углеводороды. Эти газы используются в качестве сырья для химической промышленности. Основополагающие работы по каталитическому крекингу в присутствии хлорида алюминия проведены Н.Д. Зелинским. Изомеризация алканов Алканы нормального строения под влиянием катализаторов и при нагревании способны превращаться в разветвленные алканы без изменения состава молекул, т.е. вступать в реакции изомеpизации. В этих pеакциях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов. Например, изомеризация н-пентана в изопентан (2-метилбутан) происходит при 100С в присутствии катализатора хлорида алюминия: 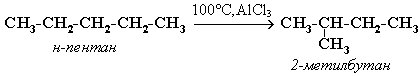 Исходное вещество и продукт реакции изомеризации имеют одинаковые молекулярные формулы и являются структурными изомерами (изомерия углеродного скелета). Дегидрирование алканов При нагревании алканов в присутствии катализаторов (Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO) происходит их каталитическое дегидрирование – отщепления атомов водорода за счет разрыва связей С—Н. Строение продуктов дегидрирования зависит от условий реакции и длины основной цепи в молекуле исходного алкана. 1. Низшие алканы, содержащие в цепи от 2-х до 4-х атомов углерода, при нагревании над Ni-катализатором отщепляют водород от соседних углеродных атомов и превращаются в алкены: 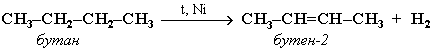 Наряду с бутеном-2 в этой реакции образуется бутен-1 CH2=CH-CH2-CH3. В присутствии катализатора Cr2O3/Al2O3 при 450-650 С из н-бутана получают также бутадиен-1,3CH2=CH-CH=CH2. 2. Алканы, содержащие в основной цепи больше 4-х атомов углерода, используются для получения циклических соединений. При этом происходит дегидроциклизация – реакция дегидрирования, которая приводит к замыканию цепи в устойчивый цикл. Если основная цепь молекулы алкана содержит 5 (но не более) атомов углерода (н-пентан и его алкильные производные), то при нагревании над Pt-катализатором атомы водорода отщепляются от концевых атомов углеродной цепи, и образуется пятичленный цикл (циклопентан или его производные): 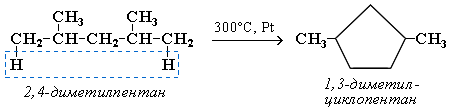 Алканы с основной цепью в 6 и более атомов углерода также вступают в реакцию дегидроциклизации, но всегда образуют 6-членный цикл (циклогексан и его производные). В условиях реакции этот цикл подвергается дальнейшему дегидрированию и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода (арена). Например: 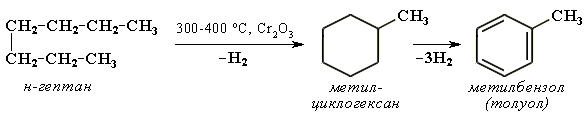 Эти реакции лежат в основе процесса риформинга – переработки нефтепродуктов с целью получения аренов (ароматизация предельных углеводородов) и водорода. Превращение н-алканов в арены ведет к улучшению детонационной стойкости бензина. 3. При 1500 С происходит межмолекулярное дегидрирование метана по схеме: Данная реакция (пиролиз метана) используется для промышленного получения ацетилена. Реакции окисления алканов В органической химии реакции окисления и восстановления рассматриваются как реакции, связанные с потерей и приобретением органическим соединением атомов водорода и кислорода. Эти процессы, естественно, сопровождаются изменением степеней окисления атомов (часть I, раздел 6.4.1.6). Окисление органического вещества - введение в его состав кислорода и (или) отщепление водорода. Восстановление - обратный процесс (введение водорода и отщепление кислорода). Учитывая состав алканов (СnH2n+2), можно сделать вывод о их неспособности вступать в реакции восстановления, но возможности участвовать в реакциях окисления. Алканы - соединения с низкими степенями окисления углерода, и в зависимости от условий реакции они могут окисляться с образованием различных соединений. 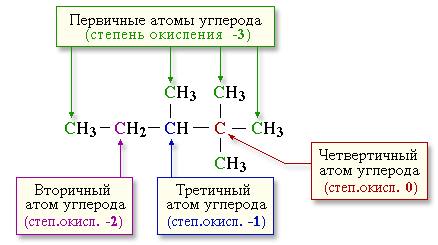 При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н2Cr2O7, KMnO4 и т.п.). При внесении в открытое пламя алканы горят. При этом в избытке кислорода происходит их полное окисление до СО2, где углерод имеет высшую степень окисления +4, и воды. Горение углеводородов приводит к разрыву всех связей С-С и С-Н и сопровождается выделением большого количества тепла (экзотермическая реакция). Примеры: Низшие (газообразные) гомологи – метан, этан, пропан, бутан – легко воспламеняются и образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. С увеличением молекулярной массы алканы загораются труднее. Процесс горения углеводородов широко используется для получения энергии (в двигателях внутреннего сгорания, в тепловых электростанциях и т.п.). Уравнение реакции горения алканов в общем виде: Из этого уравнения следует, что с увеличением числа углеродных атомов (n) в алкане увеличивается количество кислорода, необходимого для его полного окисления. При горении высших алканов (n >>1) кислорода, содержащегося в воздухе, может оказаться недостаточно для их полного окисления до СО2. Тогда образуются продукты частичного окисления: угарный газ СО (степень окисления углерода +2), сажа (мелкодисперсный углерод, нулевая степень окисления). Поэтому высшие алканы горят на воздухе коптящим пламенем, а выделяющийся попутно токсичный угарный газ (без запаха и цвета) представляет опасность для человека. Горение метана при недостатке кислорода происходит по уравнениям: 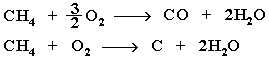 Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана. Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С-С и С-Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов. Например, при неполном окислении бутана (разрыв связи С2-С3) получают уксусную кислоту: Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12-С18, которые используются для получения моющих средств и поверхностно-активных веществ. Важное значение имеет реакция взаимодействия метана с водяным паром, в результате которой образуется смесь оксида углерода (II) с водородом - "синтез-газ": Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов. Реакции замещения В молекулах алканов связи C-Н пространственно более доступны для атаки другими частицами, чем менее прочные связи C-C. В определенных условиях происходит разрыв именно С-Н-связей и осуществляется замена атомов водорода на другие атомы или группы атомов. 1. Галогенирование Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов. Реакция алканов с хлором и бромом идет на свету или при нагревании. Хлорирование метана: При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода: Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц. В разработке теории цепных реакций большую роль сыграли труды академика, лауреата Нобелевской премии Н.Н. Семенова. Механизм радикального замещения (символ SR) на примере монохлорирования метана - анимация I (34 Кб) - анимация II со звуковым комментарием (472 Кб) Стадия 1 – зарождение цепи - появление в зоне реакции свободных радикалов. Под действием световой энергии гомолитически разрушается связь в молекуле Cl:Cl на два атома хлора с неспаренными электронами (свободные радикалы) Cl: Стадия 2 – рост (развитие) цепи. Свободные радикалы, взаимодействуя с молекулами, порождают новые радикалы и развивают цепь превращений: (Реакция Cl + CH4 водорода H значительно выше, чем метильного радикала СН3). Стадия 3 – обрыв цепи. Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений: При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными вследствие делокализации неспаренного электрона. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан: 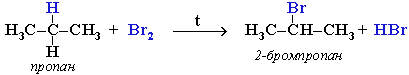 Алканы обесцвечивают раствор брома при нагревании, вступая в реакцию радикального замещения. 2. Нитрование алканов (реакция Коновалова) На алканы действует pазбавленная азотная кислота пpи нагpевании и давлении. В pезультате пpоисходит замещение атома водоpода на остаток азотной кислоты – нитpогpуппу NO2. Эту pеакцию называют pеакцией нитpования, а пpодукты pеакции – нитpосоединениями. Схема реакции: 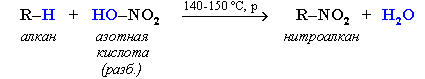 При нитровании алканов также соблюдается порядок реакционной способности С-Н-связей, характерный для реакций радикального замещения: Стрет.– Н > Свтор.– Н > Cперв.– Н Например: 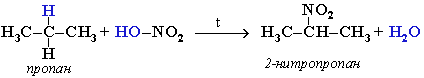 Получение алканов Алканы выделяют из природных источников (природный и попутный газы, нефть, каменный уголь). Используются также синтетические методы. Крекинг нефти (промышленный способ) При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Этот способ важен тем, что при разрыве молекул высших алканов получается очень ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан и др. Гидpиpование непpедельных углеводоpодов: 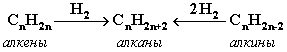 Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni): Из синтез-газа (СО + Н2) получают смесь алканов: Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода: (реакция Вюpца) Из солей карбоновых кислот: а) сплавление со щелочью (реакция Дюма) б) электролиз по Кольбе Разложение карбидов металлов (метанидов) водой: Применение алканов Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека. Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива. Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей. Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) - пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике. Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине. Паpафин (смесь твеpдых алканов С19-С35) - белая твеpдая масса без запаха и вкуса(т.пл. 50-70 °C) - пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине. Служит сырьём при получении органических кислот и спиртов, моющих средств и поверхностно-активных веществ. Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти. Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладоагенты и сырье для дальнейших синтезов. В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ. |