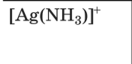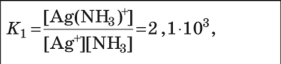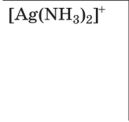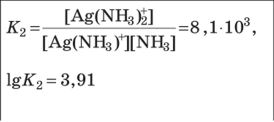компл. Свойства комплексных (координационных) соединений (устойчивость, ин
 Скачать 111.45 Kb. Скачать 111.45 Kb.
|
|
Свойства комплексных (координационных) соединений (устойчивость, ин- тенсивность окраски, растворимость, летучесть и др.) широко используют для получения информации о качественном и количественном составе пробы. Эти свойства лежат в основе многих химических и физических методов ана- лиза. Комплексное (координационное) соединение (комплекс) — это сложная час- тица, состоящая из частей (ионов и молекул), способных, в принципе, существо- вать самостоятельно. Основные признаки, позволяющие выделить комплексные соединения в осо- бый класс химических соединений, следующие: сложность состава; способность отдельных составных частей к самостоятельному существованию (в растворе); частичная диссоциация на составные части в растворе; наличие положительно заряженной центральной частицы — комплексообра-зователя (обычно иона металла), связанной с окружающими ее частицами — лигандами; наличие определенной пространственной геометрии расположения (коор-динации) лигандов вокруг комплексообразователя. Рассмотрим пример: Комплекс Составныечасти  6 Ni(NH3 )2 Ni2, NH3 [Co(NH3)6]SO4 На примере соединения [Co(NH3)6]SO4 показано, что составные части комп- лекса в свою очередь также могут состоять из нескольких частей. В качестве комплексообразователя может выступать практически любой эле- мент, играющий роль акцептора электронов (кислоты Льюиса). Лиганды, связан- ные с центральным атомом непосредственно, образуют внутреннюю сферу ком- плекса, непосредственно не связанные — внешнюю сферу. Атомы лиганда, по- средством которых осуществляется связь с комплексообразователем, называют донорными. В аналитической химии наиболее часто используют лиганды с донор- ными атомами О, N, S и существенно реже — P, Se, Te, As, Sb, Te. Комплексы ионов металлов чаще всего имеют октаэдрическую, тетраэдрическую или плос- коквадратную геометрию, реже — линейную или какую-либо иную. В общем случае геометрия комплексного иона определяется типом гибридизации свобод- ных орбиталей центрального атома. Число связей, которые могут быть образованы комплексообразователем с ли- гандами в координационно насыщенном комплексе, называют координационнымчислом. Если лиганд образует связь посредством только одного донорного атома, то координационное число равно числу присоединенных лигандов. Различают характеристическое и максимальное координационное число. Характеристическоекоординационноечисло— это число связей, образуемых лигандами определенного типа; оно зависит от природы лиганда. Например, для иона Fe3 в хлоридных комплексах характеристическое координационное число равно 4, а в тиоцианатных — 6. Максимальное координационное число — это максимально возможное для данного центрального атома число связей, не зави- сящее от природы лиганда; оно определяется только электронным строением и размером центрального атома и может достигать 4, 6, 8, а иногда и болееЧисло донорных атомов лиганда, образующих координационные связи с цен- тральным атомом, называют дентатностьюлиганда. Лиганды, образующие только одну координационную связь (H2O, NH3, Сl, I, OH, CN и др.), назы вают монодентатными; лиганды, образующие несколько связей, — полиден-татными; например Глицерин Полидентатным может быть лиганд, имеющий несколько донорных атомов, взаимное пространственное расположение которых благоприятствует образова- нию нескольких связей с одним центральным атомом и замыканию одного или нескольких циклов. Дентатность лиганда зависит от координационных и структурных особенно- стей и комплексообразователя, и лиганда. Так, диэтилентриаминпентауксусная кислота имеет восемь донорных атомов, потенциально доступных для координа- ции ионом металла. Однако в комплексе с ионами Ca2 она координируется толь- ко шестью атомами, поскольку для иона Ca2 максимальное координационное число равно 6. В то же время в комплексе с ионами Ce3, максимальное коорди- национное число которого равно 12, этот лиганд семидентатен. Типы комплексов Существует несколько классификаций комплексов. В зависимости от харак- тера связи между составными частями комплекса выделяют внутрисферные и внешнесферные комплексы. Внутрисферные комплексы. Отличительный признак внутрисферных ком- плексов — наличие непосредственной (как правило, координационной) связи центрального атома с лигандами.  4 Внутрисферные комплексы подразделяют на однороднолигандные и смеша- нолигандные в зависимости от того, какие лиганды входят в их состав: одного типа или разных типов. Однороднолигандными называют комплексы, в которых все лиганды одинаковые (например, HgI2). Комплексы, содержащие лиганды разной природы (например, PtCl2(NH3)2), называют смешанолигандными(раз- нолигандными). Учитывая, что одним из лигандов могут быть молекулы раство- рителя, комплексы типа CdNH2, Cd(NH ) 2, … , Cd(NH ) 2 фактически тоже 3 3 2 3 5  5 являются смешанолигандными (реально их состав отвечает следующим форму- лам: Cd(NH3)(H2O)2+, …, Cd(NH3)5(H2O)2+). В смешанолигандных комплексах проявляются разнообразные эффекты вза- имного влияния лигандов. Вследствие этого такие комплексы часто обладают особыми свойствами, не сводимыми к свойствам соответствующих однородно- лигандных комплексов. Например, образование смешанолигандного комплекса Сo(II) с диметилглиоксимом и иодид-ионами приводит к образованию интенсив- ной красной окраски, что используют для определения кобальта. Скорость обра- зования смешанолигандных комплексов также может отличаться от скорости образования однороднолигандных комплексов. Дитизон долго считали непригод- ным для определения Ni(II) из-за малой скорости образования комплексаным для определения Ni(II) из-за малой скорости образования комплекса. Од- нако в присутствии пиридина или какого-либо другого азотсодержащего основа- ния смешанолигандный комплекс образуется практически мгновенно. В целом при образовании смешанолигандных комплексов специфические свойства ионовметаллов обычно проявляются более ярко, что открывает большие перспективы применения таких комплексов в анализе.  Исходя из особенностей структуры среди внутрисферных комплексов выделя- ют класс хелатов (греч. chele — клешня) — комплексов, образованных с учас- тием полидентатных лигандов, в структуре которых имеются циклы, состоящие из атомов лиганда и комплексообразователя Исходя из особенностей структуры среди внутрисферных комплексов выделя- ют класс хелатов (греч. chele — клешня) — комплексов, образованных с учас- тием полидентатных лигандов, в структуре которых имеются циклы, состоящие из атомов лиганда и комплексообразователя Согласно правилу циклов Чугаева: наиболее устойчивые хелатные циклы об- разуются в том случае, если в состав цикла входит пять или шесть атомов. Напри- мер, диамины состава NH2—(CH2)n— NH2 образуют наиболее устойчивые комп- лексы при n 2 (пятичленный цикл) и n 3 (шестичленный цикл). Согласно правилу циклов Чугаева: наиболее устойчивые хелатные циклы об- разуются в том случае, если в состав цикла входит пять или шесть атомов. Напри- мер, диамины состава NH2—(CH2)n— NH2 образуют наиболее устойчивые комп- лексы при n 2 (пятичленный цикл) и n 3 (шестичленный цикл).Полидентатные лиганды с кислотными функциональными группами могут образовывать хелаты особого типа — внутрикомплексные соединения; это хела- ты, в которых замыкание цикла сопровождается вытеснением ионом металла одного или нескольких протонов кислотных функциональных групп:  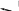  ФГАОУВО "Национальный исследовательский Томский политехнический университет" Следует выделить комплексы с макроциклическими лигандами. Макроцикли-ческие лиганды — это гетероциклические соединения, содержащие несколько донорных атомов, связанных мостиками (например, — CH2— CH2—) таким обра- зом, что образуется полость определенного размера. Такие лиганды образуют еще более устойчивые комплексы, чем аналогичные полидентатные лиганды нецик- лического строения. В частности, это практически единственный тип лигандов, способный образовывать устойчивые комплексы с ионами щелочных металлов. Наиболее устойчивые комплексы образуются, если размер полости макроцикла соответствует размеру центрального иона. Например, дициклогексан-18-краун-6 (диаметр полости 0,26 — 0,32 нм) образует с ионом K (0,266 нм) более устойчи- вый комплекс (lg 8,3), чем с ионом Na (0,19 нм; lg 6,4): Комплексы подразделяют также на моноядерные и полиядерные в зависимо- сти от числа присутствующих в них центральных атомов. Моноядерными назы- вают комплексы, состоящие из одного центрального атома и соединенных с ним лигандов. Все упоминавшиеся до сих пор комплексы были моноядерными. В со- став полиядерныхкомплексоввходят два (или более) связанных определенным  2 способом центральных атома. Связь между ними может осуществляться либо через мостиковые группы, либо непосредственно (Hg2). Полиядерные комплексы с одинаковыми центральными атомами называют гомополиядерными, с разны- ми центральными атомами — гетерополиядерными(разнометалльными).  Образование полиядерных комплексов может существенно осложнить ход ана- лиза, поскольку реакционная способность полиядерных комплексов, как прави- ло, ниже, чем моноядерных — главным образом в силу кинетических причин (см. подразд. 5.2.4). Например, реакцию ионов Fe3 с этилендиаминтетрауксусной кислотой (ЭДТК), широко используемую для титриметрического определения железа, лучше проводить при рН 1,5 — 2, а не при рН 3, несмотря на то что с тер- модинамической точки зрения значение рН 3 более благоприятно для образова- ния комплекса Fe(III) с ЭДТК. Причина состоит в том, что при увеличении рН резко возрастает содержание полиядерных гидроксокомплексов Fe(III), которые реагируют с ЭДТК довольно медленно. Особенно неблагоприятным может быть образование гетерополиядерных комплексов, приводящее к взаимному влиянию элементов и затрудняющее их разделение и определение В то же время известны многочисленные примеры использования полиядер- ных комплексов в химическом анализе. Образование гетерополиядерных комп- лексов Mg(II) и Fe(III) с тартрат-ионами можно использовать для маскирования магния в реакциях с некоторыми органическими реагентами, например с тита- новым желтым. В других случаях образование полиядерных комплексов способ- ствует протеканию аналитической реакции или изменяет ее направление и ана- литические характеристики продуктов реакции. Внешнесферные комплексы. Многие комплексные частицы могут присое- динять дополнительные ионы или молекулы, не связанные непосредственно с центральным атомом; такие комплексы называют внешнесферными. Лиганды, находящиеся во внешней сфере, удерживаются главным образом электростати- ческими силами. Внешнесферные комплексы представляют собой частный слу- чай ионныхассоциатов— сложных частиц, состоящих из разноименно заряжен- ных ионов, удерживаемых электростатическими силами. Равновесия реакций комплексообразованияПри описании равновесий комплексообразования следует помнить, что ионы в растворе всегда сольватированы. Поэтому образование комплексов можно пред- ставить как последовательное замещение молекул растворителя S на молекулы или ионы лиганда L: Как уже отмечалось выше, комплексное соединение обычно состоит из внутренней и внешней сфер. Внутренняя сфера связана с внешней посредством ионной связи, поэтому в растворе соединение, содержащее комплексный ион, ведет себя как сильный электролит и диссоциирует необратимо, например: Между центральным ионом и лигандами образуются ковалентные связи по донорно-акцепторному механизму, поэтому образование и диссоциация комплексного иона происходит ступенчато и обратимо. Равновесия в растворах комплексных соединений можно охарактеризовать с помощью констант образования (устойчивости) и констант диссоциации (нестойкости). Для комплекса ML, образованного ионом металла М и лигандом L (для того чтобы не загромождать математические формулы, заряды частиц мы в дальнейшем указывать не будем), константа образования характеризует равновесие (9.1), а константа диссоциации — равновесие (9.2). Выражение для концентрационной константы образования данного комплекса имеет вид (9.3), а для константы диссоциации (т.е. нестойкости) — (9.4):  чевидно, что константы образования и диссоциации комплекса являются взаимно обратными величинами: Константы образования используются в современной аналитической химии гораздо чаще, чем константы диссоциации. В большинстве случаев в состав комплексного соединения входят несколько лигандов, поэтому и процессы комплексооб- разования (или, наоборот, диссоциации комплекса) протекают ступенчато. Как уже было показано в главе 6, константы равновесия, характеризующие отдельную ступень, называются ступенчатыми. Произведение ступенчатых констант представляет собой общую константу. Ступенчатые константы обозначают К, а общие — (3. Например, для аммиачных комплексов серебра ступенчатые и общие константы образования определяются так, как указано в табл. 9.1. Общие константы обычно используются чаще, поскольку они более удобны при расчетах. константы образования аммиачных комплексов серебра
Чем больше величина константы образования (для однотипных комплексов), тем выше устойчивость комплекса. Например, комплекс [Cu(NH3)4]2+ ((34 = 4 • 1012) является более устойчивым, чем [Zn(NH3)4]2+ ((34 = 1,2 109). В случае констант диссоциации, напротив, более устойчивому комплексу соответствует меньшая константа диссоциации. Константы, используемые для описания равновесий в растворах комплексных соединений, как и любые константы равновесия, могут быть термодинамическими (К0, (3°) и концентрационными (К, (3). Например, термодинамическая общая константа образования комплекса ML„ описывается выражением (9.6), а концентрационная — (9.7) 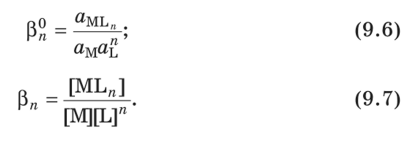 Концентрационная константа образования комплекса MLrt связана с соответствующей термодинамической константой таким уравнением:  Часто для описания равновесий комплексообразования используют условные концентрационные константы, в выражения которых входят общие концентрации металла и (или) лиганда. Такие константы применяют в тех случаях, если в растворе наряду с комплексообразованием протекают и другие процессы: образование осадка, протонирование лиганда и т.д. Условная общая константа образования комплекса MLn связана с его реальной концентрационной константой образования таким уравнением: Константы равновесия характеризуют термодинамическую стабильность комплекса, т.е. меру возможности образования или диссоциации данного комплекса в равновесных условиях. Существует также понятие «кинетическая устойчивость», характеризующее скорость образования (диссоциации) комплексной частицы. Например, комплексный ион [Cu(NH3)4]2+ можно легко получить при взаимодействии Cu2+ с NH3, однако в кислой среде он легко разрушается. С другой стороны, ион [Cr(NH3)6]3+ получить достаточно трудно, но — в отличие от катиона тетрааммин- меди (II) — он устойчив даже при кипячении в концентрированной серной кислоте. Это объясняется тем, что обмен лигандами (Н20 на NH3, и наоборот) в случае комплекса меди происходит быстро, а в случае комплекса хрома — медленно. В зависимости от скорости замещения лигандов внутренней сферы на другие лиганды комплексы разделяют на лабильные и инертные. Если химическая реакция с участием комплекса протекает за время меньшее, чем приблизительно одна минута (время смешивания реагентов), то такой комплекс относят к числу лабильных. Если же период полупревращения комплекса превышает две минуты, то этот комплекс считается инертным. Таким образом, катион [Cu(NH3)4]2+ является лабильным комплексом, а [Cr(NH3)6]3+ — инертным. |