Тепловое равновесие
 Скачать 165.47 Kb. Скачать 165.47 Kb.
|
|
13. Динамические законы характеризуют поведение отдельного объекта или системы, включающей небольшое число элементов, и раскрывают необходимую связь между состояниями этого объекта или системы. Они дают возможность предсказать будущее состояние объекта, если известно его настоящее состояние. Статистические (вероятностные) законы – это законы, выражающие некоторую тенденцию, сложившуюся в совокупности явлений во взаимодействии множества случайных факторов. Они позволяют с высокой точностью делать прогностические выводы о поведении больших совокупностей объектов, но не достигающие такой точности при прогнозе поведения отдельных ее элементов. Теорию, изучающую свойства макроскопических тел, состоящих из большого числа одинаковых частиц, называют статистической физикой. Термодинамика изучает свойства макроскопических тел и протекающие в них процессы, не рассматривая их внутреннее строение. Макроскопическое состояние - определяется значениями ее термодинамических параметров: давления, температура, удельного объема, внутренней энергии и т.п. Для определения макроскопического состояния однокомпонентной системы достаточно знать значения любых 2 независимых параметров. Макроскопические параметры- параметры значения которых можно определить с помощью приборов, ничего не зная об атомно-молекулярном строении вещества. Основное уравнение МКТ 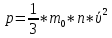 Температура это внутренний параметр системы, который имеет одно и то же значение в любой части системы при тепловом равновесии. Тепловое равновесие – это такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными. 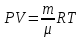 -уравнение Менделеева-Клапейрона -уравнение Менделеева-Клапейрона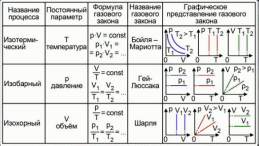 14. Барометрическая формула- зависимость давления или плотности газа от высоты в поле силы тяжести в стационарных условиях. 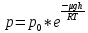 Используя формулу p=nkT получим закон изменения с высотой числа молекул в единице объема: 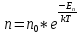 е- число Эйлера е- число ЭйлераР 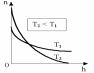 аспределение Больцмана устанавливается в результате совместного действия потенциального поля и теплового движения. Распределение справедливо в любом потенциальном поле сил для совокупности любых частиц, в состоянии хаотического теплового движения. аспределение Больцмана устанавливается в результате совместного действия потенциального поля и теплового движения. Распределение справедливо в любом потенциальном поле сил для совокупности любых частиц, в состоянии хаотического теплового движения.15.Микроскопические параметры- это индивидуальные характеристики молекул: масса молекулы, ее скорость, импульс и кинетическая энергия поступательного движения. Термодинамическая вероятность - это число способов, которыми может быть реализовано данное состояние макроскопической физической системы. Каждое состояние физической системы с определенным распределением ее частиц по возможным классическим или квантовым состояниям называют микросостоянием. Термодинамическая вероятность W равна числу микросостояний, реализованных в данном макро состоянии. Вероятность дает наиболее правдоподобную оценку доли случайных событий с данным исходом при большом числе их повторений. Наличие случайных отклонений от наиболее правдоподобного значения является причиной возникновения флуктуаций. Флуктуации физической системы, находящейся в состоянии термодинамического равновесия, всегда малы и имеют статистическую природу. Флуктуации в изучаемых системах влияют на чувствительность измерительных приборов. По молекулярно-кинетической теории, как бы не изменялись скорости молекул при столкновениях, средняя квадратичная скорость молекул массой m0 в газе, находящемся в состоянии теплового равновесия при Т=cоnst, остается постоянной и  . Это объясняется тем, что в газе, находящемся в состоянии теплового равновесия, установлено некоторое стационарное распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Этот закон теоретически выведен Максвеллом. . Это объясняется тем, что в газе, находящемся в состоянии теплового равновесия, установлено некоторое стационарное распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Этот закон теоретически выведен Максвеллом.   Функция распределения Максвелла показывает вероятность того, что скорость данной молекулы имеет значение, заключенное в единичном интервале скоростей, включающем данную скорость . Или - относительное число молекул, скорости которых лежат в этом интервале.  - Средняя кинетическая энергия частицы. - Средняя кинетическая энергия частицы.16. Расстояние, которое проходит молекула между двумя последовательными столкновениями, называется длинной свободного пробега молекулы. Из молекулярно-кинетической теории вытекает формула, связывающая вязкость со средней длинной свободного пробега молекулы   -средняя длинна свободного пробега; -средняя длинна свободного пробега; 17. Явления переноса- это все необратимые процессы статистической природы, возникающие в результате случайного непрерывного движения молекул, чаще всего наблюдаемого в жидкостях. Диффузия – это физический процесс, который относится к чистому перемещению молекул из области высокой концентрации в область с более низкой концентрацией. Теплопроводность – это явление, при котором энергия передается от одной части тела к другой посредством столкновения частиц или при непосредственном контакте двух тел. Внутреннее трение — способность тела преобразовывать механическую энергию, сообщенную телу во время его деформации в теплоту. Стокс установил, что при движении тел малых размеров в вязкой среде сила внутреннего трения пропорциональна скорости, коэффициенту вязкости и характеристическому размеру тела. Формула Стокса Fтр=6  n- коэффициент вязкости, r –радиус n- коэффициент вязкости, r –радиусСоотношение между коэффициентами переноса. Для коэффициентов диффузии и вязкости такое соотношением:  , ,  -называют кинематической вязкостью. -называют кинематической вязкостью.Для коэффициента теплопроводности и коэффициента диффузии, получим такое соотношение:  , где c –удельная теплоемкость. , где c –удельная теплоемкость.Изменение температуры газа определяется соотношением между количеством теплоты и теплоемкостью газа  . .Для коэффициентов теплопроводности и вязкости существует простое соотношение:  18. Полная энергия системы есть сумма кинетической энергии движущейся системы, потенциальной энергии ее положения и внутренней энергии  Внутренней энергий (U) какого-либо тела называется энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. 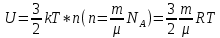 –внутренняя энергия одноатомного газа. –внутренняя энергия одноатомного газа.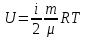 - внутренняя энергия многоатомного газа - внутренняя энергия многоатомного газа19. Работа в термодинамике= работа сил, приложенных к внешним телам со стороны системы при ее деформации Работа газа численно равна площади фигуры под графиком зависимости давления от объема в координатах p,V 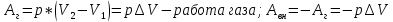 - работа внешних сил - работа внешних сил20. Теплота - это не заключенная в теле энергия, а то количество энергии, которое передается от горячего тела холодному. Существуют три вида теплообмена: конвекция, излучение, теплопроводность. Излучение - процесс передачи энергии путем теплообмена без совершения механической работы. Для передачи теплоты путем излучения не требуется вещество, как средство передачи теплоты от одного тела другому. Конвекция -процесс передачи теплоты за счет перемещения молекул из одной части объема в другую. Газы и жидкости могут обеспечить довольно быструю передачу теплоты на значительные расстояния благодаря существованию конвекции. Различают конвекцию естественную и вынужденную. Например, нагретый атмосферный воздух поднимается вверх, а холодный опускается вниз. Ветер - один из примеров явления конвекции, вызывающий изменение погодных условий. Теплопроводность — способность материальных тел проводить энергию (теплоту) от более нагретых частей тела к менее нагретым частям тела путём хаотического движения частиц. Такой теплообмен может происходить в любых телах с неоднородным распределением температур, но механизм переноса теплоты будет зависеть от агрегатного состояния вещества. 21. Теплоемкостью тела (полной теплоемкостью) называется физическая величина, численно равная количеству тепла, которое надо сообщить телу, чтобы нагреть его на один Кельвин: 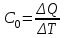  Удельной теплоемкостью вещества называется физическая величина, численно равная количеству тепла, которое надо сообщить 1 кг вещества, чтобы нагреть его на один Кельвин :   Молярной теплоемкостью вещества называется физическая величина, численно равная количеству тепла, которое надо сообщить 1 молю вещества, чтобы нагреть его на один Кельвин :   Закон равномерного распределения энергии по степеням свободы – На каждую поступательную и вращательную степень свободы приходится в среднем энергия kT/2, а на каждую колебательную степень свободы – энергии kT.  Одноатомного i=3; двух атомного i=5; трех атомного i=6 22. Первое начало термодинамики говорит о сохранении полной энергии во всех процессах, имеющих молекулярно-статистическую основу и утверждает возможность взаимных превращений различных видов энергии. Количество тепла, сообщенное системе, расходуется на приращение внутренней энергии системы и на совершение системой работы: Q = U + A Рассмотрим применение первого начала термодинамики к изопроцессам в газах: Изобарический процесс:  Изохорический процесс:  Q = Q =  U (A = 0, т.к. V = const) U (A = 0, т.к. V = const) Изотермический процесс:  Q = A ( Q = A ( U = 0, т.к. T = const) U = 0, т.к. T = const) ф  изический смысл универсальной газовой постоянной R. Универсальная газовая постоянная R равна работе, которую совершает 1 моль идеального газа при изобарическом расширении, если газ нагреть на один градус. изический смысл универсальной газовой постоянной R. Универсальная газовая постоянная R равна работе, которую совершает 1 моль идеального газа при изобарическом расширении, если газ нагреть на один градус.Уравнение Майера: 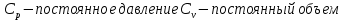 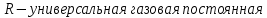 23. Всякий двигатель представляет собой систему, совершающую многократно круговой процесс. Периодически действующий двигатель, совершающий работу за счет полученного извне тепла, называется тепловой машиной. Круговым процессом или циклом называется такой процесс, при котором система после ряда изменений возвращается в исходное состояние. Обратимый термодинамический процесс - это такой равновесный процесс, который допускает возможность возвращения системы в первоначальное состояние через ту же последовательность промежуточных состояний, что и в прямом процессе, причем, после этого в окружающих систему телах не остается никаких изменений. Важнейшим признаком обратимого процесса является его равновесность. Необратимый термодинамический процесс - это такой неравновесный процесс, по завершении которого систему нельзя вернуть в начальное состояние так, чтобы в окружающих систему телах не осталось никаких изменений. Такой процесс в обратном направлении самопроизвольно протекать не может. Все процессы в природе - необратимые. 24. Цикл Карно — это идеальный круговой процесс, состоящий из двух адиабатных и двух изотермических процессов. В процессе Карно термодинамическая система выполняет механическую работу за счёт обмена теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником. КПД цикла Карно для идеального газа зависит только от температур нагревателя и холодильника.   |
