Навигация по странице:Вопрос № 10 Внутренние структуры прокариот: цитоплазматическая мембрана, цитоплазма, нуклеоид, плазмиды, эписомы, рибосомы, эндоспоры и др. Их состав, организация и функции.Вопрос № 26 Отношение микробов к физическим факторам среды: влажности, температуре, давлению, кислороду, свету, радиации, кавитации, СВЧ-энергии. Солнечный свет Ионизирующая радиация( Микроволновое излучение-облигатные анаэробы-облигатные аэробыВопрос № 54 В чем сходство и различие понятий «Нитратное дыхание» и «денитрификация» Нитратное дыханиеМикробные землеудобрительные препараты (нитрагин, ризоторфин, азотобактерин, фосфоробактерин, препарат АМБ). Получение, применение, действие на растение, влияние на урожай. ФосфобактеринЭффективность примененияМетоды исследования физико-химических свойств клеткиВопрос № 100 Представьте рисунки эукариот. Грибы. Представители классов зигомицет, аскомицет, базидиальных, дейтеромицет.
|
Контрольная. Микробиология. Вопрос 5 Открытие микроорганизмов Антони ван Левенгуком. Описательный период развития учения о микробах. Работы Д. С. Самойловича, М. Т. Тереховского
Вопрос №5
Открытие микроорганизмов Антони ван Левенгуком. «Описательный период развития учения о микробах. Работы Д. С. Самойловича, М. Т. Тереховского.
Наибольшую известность в этот период развития микробиологии получили исследования голландского естествоиспытателя Антони ван Левенгука. Будучи продавцом сукна, он в свободное от работы время увлекался модной тогда в Голландии шлифовкой стекол и конструированием линз. В 1673 г. он изобрел микроскоп, дающий увеличение в 150-300 раз. Микроскоп Левенгука представлял собой двояковыпуклую линзу с очень коротким фокусным расстоянием, поэтому при работе микроскоп необходимо было подносить очень близко к глазам.
Рассматривая с помощью изобретенного им микроскопа воду, налет с зубов,
испражнения, кровь и другие объекты, А. Левенгук описал инфузории, лямблии, эритроциты, а также неизвестные образования шарообразной, палочковидной и другой формы.
Обнаруженных живых “зверушек” Левенгук назвал “анималькулюсами”. Свои зарисовки и описания “анималькулюсов” он направлял в Лондонское королевское научное общество. Эти описания сначала печатались в
научных журналах, а в 1695 г. были изданы на латинском языке отдельной книгой под названием “Тайны природы, открытые Антони ван Левенгуком при помощи микроскопов”.
Самойлович (Сушковский) Данила Самойлович - это был талантливый врач, один из первых представителей русской науки, прославившийся в Европе своими работами по эпидемиологии чумы. В Париже опубликовал научные работы "О растираниях льдом в качестве лечебного средства при заболеваниях чумой", "О прививках при чуме с описанием трех курительных противочумных порошков", "О чуме в Москве, свирепствовавшей в 1771 году", "Краткое описание микроскопических исследований в существе яду уязвленного" и "Способ самый удобный повсеместного врачевания смертельной язвы, заражающей чумы, ко благу всеобщественному предлагает Д. Самойлович", в которых выдвинул ряд новых предложений в сфере профилактики, диагностики и лечения чумы. Самойлович отверг миазматическую теорию происхождения чумы и настаивал на том, что она распространяется контагиозным путем посредством живого возбудителя.
Тереховский Мартын Матвеевич - русский врач и натуралист. Изучал микроорганизмы («анималькули») в связи с проблемой самопроизвольного зарождения организмов. Диссертация "О наливочном хаосе Линнея", 1775г. посвящена изучению вопроса о природе и происхождении "наливочных анималькулей", т. е. микроскопич. организмов (гл. обр. простейших), появляющихся в различного рода настоях. Экспериментально установил живую природу "анималькулей". Напечатал: "Краткое описание болезней, часто приключающихся в армиях, с правилами как оные врачевать". «Польза, которую растения смертным приносят». Выполнил первые работы по стерилизации.
Вопрос № 10
Внутренние структуры прокариот: цитоплазматическая мембрана, цитоплазма, нуклеоид, плазмиды, эписомы, рибосомы, эндоспоры и др. Их состав, организация и функции.
Цитоплазматическая мембрана состоит из трех слоев: белковые слои по краям (от 50 до75% состава), бимолекулярный слой липидов в центре(15—45%). Роль барьера для молекул и ионов, поступающих из средыв клетку, выполняет в основном центральный слой. Каждый слой имеет толщину примерно по 25 А. В состав крайних слоев входят разнообразные белки. Строение ЦМ соответствует жидкостно-мозаичной модели, разработанной для мембраны эукарий. Степень текучести мембраны определяется липидным бислоем и температурой окружающей среды. Жидкостное состояние ЦМ обусловливает способность фосфолипидных молекул липидного бислоя к вращению и латеральному перемещению в соответствующем участке мембраны. Липиды со встроенными в них белками образуют подвижную мозаику. В зависимости от ориентации в мембране и характера связи с липидным бислоем белки ЦМ делят на периферические и интегральные. Периферические белки, в свою очередь, разделяют на собственно периферические, связанные с липидами в основном электростатически, часто погруженные в гидрофобную область липидного бислоя, и поверхностные, находящиеся вне бислоя и связанные с ним исключительно электростатически. Интегральные белки плавают в липидном бислое и пронизывают его целиком, насквозь. С липидами они связаны с помощью входящих в состав белка гидрофобных аминокислот прочными взаимодействиями.
ЦМ выполняет ряд функций: защищает протопласт, обеспечивая сохранение разности концентраций метаболитов и неорганических ионов между внутриклеточной и внешней средой; синтезируетклеточную стенку, капсулу; участвует в делении, спорообразованииклетки; обладает избирательностью при проникновении питательныхвеществ в клетку; контролирует связи с аппаратом генерации АТФ ирегуляции движения жгутиков.
Производными ЦМ являются мезосомы — инвагинации (впячива-ния) мембраны, растущей внутрь клетки. Мезосомы бывают тубулярные (трубчатые), везикулярные и ламеллярные. У большинства прокариот мезосомы всегда связаны с ЦМ. Исключением служат цианобактерии, у которых тилакоиды большей частью отделены от ЦМ и автономны. В мезосомах ЦМ (аналогах митохондрий эукарий) локализованы окислительно-восстановительные ферменты и происходят наиболее важные реакции энергетического обмена, например окислительное фосфорилирование.
ЦМ окружает цитоплазму, химической основой которой являются белки, аминокислоты, углеводы, жиры, минеральные соли и их конъюгаты; в зависимости от возраста клетки и условий среды 70—80% цитоплазмы занимает вода. Свободная вода в цитоплазме удерживается капиллярными силами, связанная - за счет Н-связей фракция цитоплазмы, имеющая гомогенную консистенцию, представляет собой цитозоль.
Структурная основа цитоплазмы - рибосомы. Диаметр рибосом -20-40 или 10-20 нм. Они состоят на 60% из РНК и на 40% из белка. Общая масса их составляет 1/4 клеточной массы, а количество рибосомальной РНК - до 80-85% всей РНК клетки. От 5 до 90 тыс. рибосом рассеяны в цитоплазме клетки. Иногда вклетке образуются целые ансамбли рибосом, включающие также молекулы информационных и транспортных РНК, их называют полирибосомами или полисомами. Полисомы могут быть связаны с мембранными структурами клетки, что отличает рибосомы прокариот от рибосом эукарий.
Функция рибосом — синтез белка. Рибосомы имеют константу седиментации 70S, характеризующую скорость, с которой этичастицы осаждаются в центрифуге при обычных условиях: их называют рибосомы прокариот 70S типа. Они состоят из двух субъединиц: 50S и 30S, каждая из которых содержит еще две. Так, 50S субъединица состоит из 23S и 5S более мелких субъединиц, a 30S - из 16S и 21S.
В цитоплазме прокариот имеются включения без мембранной оболочки, выполняющие роль запасных веществ. Это полисахариды: гликоген (животный крахмал), гранулеза (вещество, близкое крахмалу); гранулезу накапливают перед началом спорообразования маслянокислые бактерии рода Clostridium, что служит для них диагностическим признаком. К резервным включениям относятся полифосфаты: волютин. При старении клеток и при избыточном питании накапливаются липиды. У серных бактерий, окисляющих сероводород, в цитоплазме могут откладываться капельки серы. Сера как резервныйисточник энергии тратится по мере расходования сероводорода.
Нуклеоид. Нити ДНК не соединены каким-либо регулярным способом с белком в отличие от ядра эукарий, у которых ДНК соединена с гистонами. Возможно, роль белка у прокариот выполняют протамины с неполным набором аминокислот и низкой молекулярной массой. У кишечной палочки Escherichia coli длина ДНК в 500—1000 разпревышает длину клетки, в ней содержится 4 *106 нуклеотидных пар, она плотно замкнута в кольцо. В клетке может быть несколько копий ДНК. У генома прокариот нет мембраны, ядрышка, состоящего из РНК, но сосредоточенные вокруг него плотным кольцом полисомы создают впечатление ядерной мембраны. Считается, что они играют роль ядрышек.
Кроме нуклеоида, в клетке могут находиться плазмиды, более короткие наследственные детерминанты, нити нехромосомной ДНК, замкнутые в кольцо. Они автономны, самореплицируются и передаются от клетки к клетке. Все плазмиды могут существовать в клетке и в интегрированном с бактериальной хромосомой состоянии, сохраняя при этом способность переходить к автономии. Наиболее крупные плазмиды содержат сотни генов. Плазмиды, несущие фертилъный F-фактор, определяют способность клетки к конъюгации. F-фактор представляет собой фрагмент ДНК, составляющий всего 1% от ДНК бактериальной хромосомы. Он отвечает за перенос части ДНК клетки-донора в реципиентную клетку, которая превращается в мерозиготу, т. е. неполную зиготу, содержащую часть генома донора и полный геномклетки-реципиента. F-фактор отвечает также за образование F-пилей.
К-ллазмиды придают бактериям устойчивость к лекарственным веществам, в частности к антибиотикам, а также тяжелым металлам.
R-плазмиды переносят также способность бактерий разрушать такие соединения, как нафталин, октан, салицилат.
Hly–плазмиды — определяют синтез гемолизинов;
Ent–плазмиды — определяют синтез энтеротоксинов;
Tox–плазмиды — определяют токсинообразование.
Cпора бактерий — это уникальная структура по степени устойчивости к неблагоприятным условиям среды, поскольку обеспечивает выживаемость клетки в состоянии анабиоза в течение десятков лет в отсутствие питательных веществ или при неблагоприятных температуре, влажности, рН. Зрелая спора обладает терморезистентностью. Это связано, прежде всего, с отсутствием в споре свободной воды (15—18%), так как свободная вода при формировании споры переходит в связанное состояние. Вода, которая образуется при дыхании спор аэробных бактерий, поглощается кортексом. Устойчивость споры связана также с образованием дипиколиновой кислоты из диаминопимелиновой, входящей всостав муреина вегетативной клетки. Дипиколиновая кислота находится в споре в виде дипиколината кальция, ее содержание в зрелых спорах достигает 15%. Помимо кальция, в споре повышено содержание катионов магния, марганца, железа, с которыми также связываютее термостойкость и механическую прочность. Химическая устойчивость эндоспор обусловлена непроницаемостью их оболочек для многих веществ. В споре повышено содержание липидов, белка, серосодержащих аминокислот, особенно цистеина (наличие последнего связывают с ее устойчивостью к радиации).
Вопрос № 26
Отношение микробов к физическим факторам среды: влажности, температуре, давлению, кислороду, свету, радиации, кавитации, СВЧ-энергии.
Один из главных факторов , определяющих жизнедеятельность микроорганизмов это температура. Микроорганизмы могут развиваться лишь при определенной для них температуре. Для всех микроорганизмов существует свой максимум, минимум, оптимум.
Их разделяют на три группы:
психрофилы - микроорганизмы, хорошо растущие при низких температурах с минимумом при -10-0 °С, оптимумом при 10-15 °С;
мезофилы - микроорганизмы, для которых оптимум роста наблюдается при 25-35 °С, минимум — при 5-10 °С, максимум — при 50-60 °С;
термофилы - микроорганизмы, хорошо растущие при относительно высоких температурах с оптимумом роста при 50-65 °С, максимумом — при температуре более 70 °С.
Группу термофилов делят на 4 подгруппы:
1. Термотолерантные виды растут в пределах от 10 до 55-60 градусов по С, оптимальная область лежит при 35-40 градусов по С.
2. Факультативные термофилы имеют максимальную температуру роста между 50 и 65 градусами по С, но способны также к размножению при комнатной температуре (20 градусов по С); оптимум приходится на область температур, близких к верхней границе роста. Особенность этой группы прокариот - способность к росту в области от 20 до 40 градусов по С.
3. К облигатным термофилам относят виды, обнаруживающие способность расти при температурах около 70 градусов по С и не растущие ниже 40 градусов по С
4. Наконец, обнаружены прокариоты, выделенные в подгруппу экстремальных термофилов. Для них характерны следующие температурные параметры: оптимум в области 80-105 градусов по С, минимальная граница роста 60 градусов по С и выше, максимальная - до 110 градусов по С.
По отношению к влажности микроорганизмы делятся на гидрофилы ( влаголюбивые) и ксерофилы ( сухолюбивые).
Солнечный свет губительно действует на микроорганизмы, исключением являются фототрофные виды. Наибольший микробицидный эффект оказывает коротковолновые УФ-лучи. Энергию излучения используют для дезинфекции, а также для стерилизации термолабильных материалов.
УФ-лучи (в первую очередь коротковолновые, т.е. с длиной волны 250-270 нм) действуют на нуклеиновые кислоты. Микробицидное действие основано на разрыве водородных связей и образовании в молекуле ДНК димеров тимидина, приводящем к появлению нежизнеспособных мутантов. Применение УФ-излучения для стерилизации ограничено его низкой проницаемостью и высокой поглотительной активностью воды и стекла.
Ионизирующая радиация( рентгеновское и γ-излучение) в больших дозах также вызывает гибель микробов. Облучение вызывает образование свободных радикалов, разрушающих нуклеиновые кислоты и белки с последующей гибелью микробных клеток. Применяют для стерилизации бактериологических препаратов, изделий из пластмасс.
Микроволновое излучение применяют для быстрой повторной стерилизации длительно хранящихся сред. Стерилизующий эффект достигается быстрым подъемом температуры.
Классификация физиологическая по отношению к кислороду делит все прокариоты на:
анаэробные – микроорганизмы, дыхание которых не требует наличия свободного кислорода:
-факультативно-анаэробные – способные существовать как в среде, содержащей кислород, так и при его отсутствии;
-облигатные анаэробы – погибающие при наличии в среде свободного кислорода.
аэробные – микроорганизмы, нуждающиеся в кислороде для своей жизнедеятельности:
-облигатные аэробы
-микроаэрофилы – микроорганизмы, в том числе бактерии, растущие при содержании молекулярного кислорода(O2)до 10 %, то есть намного ниже, чем в атмосфере (21%).
Аэротолернатные- способны расти в присутствии кислорода, но не используют его для получния энергии.
Классификация микроорганизмов по отношению к давлению:
Пьезочувствительные ( барочувствительные)
Пьезотолерантные
Пьезофильные:
Вопрос № 54
В чем сходство и различие понятий «Нитратное дыхание» и «денитрификация»?
Нитратное дыхание - процесс восстановления нитрата до нитрита. Широко распространен среди эубактерий и обнаружен у представителей более 70 родов.
Денитрификация - процесс восстановления нитратов до нитритов и далее до газообразных оксидов и молекулярного азота(NO, N20, N2.). В результате их азот возвращается в атмосферу и становится недоступным большинству организмов. Осуществляется только прокариотами (причём как бактериям, так и археями) в анаэробных условиях и связана с получением ими энергии.
Вопрос № 82
Микробные землеудобрительные препараты (нитрагин, ризоторфин, азотобактерин, фосфоробактерин, препарат АМБ). Получение, применение, действие на растение, влияние на урожай.
Нитрагин — бактериальный препарат, содержит активные расы клубеньковых бактерий — Bacterium radicicola, которые живут на корнях бобовых культур и усваивают атмосферный азот, используя поступающие к корням углеводы. Бактерии способны фиксировать свободный азот атмосферы, превращая его в легкоусвояемые растениями соединения, поскольку в их организмах есть фермент - нитрогеназа. Нитрогеназа восстанавливает молекулярный азот до аммиака, который вовлекается затем в ряд превращений с образованием глутамина и глутаминовой кислоты. Эти кислоты в дальнейшем идут на синтез растительного белка. Этот процесс возможен только в симбиозе с бобовыми растениями: растение обеспечивает бактерии необходимыми питательными веществами и создает для них оптимальные условия существования, а бактерии, находясь в клубеньках, проросших в корни растения, снабжают его азотистым питанием.
Для производства посевного материала исходную культуру клубеньковых бактерий выращивают сначала на агаризованной среде, содержащей, например, отвар семян бобовых растерий, 2 % агара и 1 % сахарозы. На всех этапах промышленного культивирования применяют питательную среду одного и того же состава, включающую такие компоненты, как мелассу, кукурузный экстракт, минеральные соли в виде сульфатов аммония и магния, мел, хлорид натрия и двухзамещенный фосфат калия.
Основную ферментацию проводят в течение двух-трех суток при температуре 28-30 С и рН 6,5-7,5. Готовую культуральную жидкость направляют на сепарацию, в результате которой отделяется биомасса в виде пасты влажностью 70-80 %. Пасту смешивают с защитной средой, имеющей различный состав, но всегда содержащей мелассу и тиомочевину в соотношении 20:1, и направляют на высушивание. Процесс сушки осуществляют в вакуум-сушильных шкафах при 30-35 С и остаточном давлении 10-13 кПа. Высушенную биомассу размалывают. Нитрагин способствует увеличению урожайности бобовых на 1525 %, а в районах, где бобовые засеваются впервые, - на 100 %. Вносят препараты путем опудривания семян непосредственно перед посевом.
Азотобактерин - бактериальное удобрение, приготовленное на основе культуры свободноживущего почвенного микроорганизма Azotobacter chroococcum, способного фиксировать до 20 мг атмосферного азота на 1 г использованного сахара. Кроме того, эти бактерии выделяют в почву биологически активные вещества: никотиновую кислоту (витамин PP), пантотеновую кислоту, пиридоксин, биотин (витамин H) и некоторые фунгицидные вещества, угнетающие развитие нежелательных микроскопических грибов. Все виды азотобактера - строгие аэробы. Бактерии этого вида очень чувствительны к наличию фосфора и развиваются при высоком содержании его в питательной среде. Технология получения азотобактерина имеет много общего с технологией производства нитрагина.
Культуру микроорганизмов выращивают методом глубинного культивирования на среде, содержащей те же компоненты, что и при культивировании Rhizobium. Дополнительно вводят сульфаты железа и марганца, а также сложную соль молибденовой кислоты. РН среды культивирования 5,7-6,5, аэрация - 1 объем воздуха на 1 объем среды в 1 мин. Процесс ферментации проводят до начала стационарной фазы роста культуры, так как в этой стационарной фазе биологически активные вещества выделяются из клетки и остаются в культуральной жидкости. При этом существует опасность, что с их выходом клетки могут утратить способность фиксировать атмосферный азот после внесения в почву. Биологически активные вещества полностью или частично могут теряться и в процессе высушивания клеток, однако оставшиеся жизнеспособными клетки после выведения азотобактера из анабиоза восстанавливают способность продуцировать биологически активные вещества.
Использовать препараты азотобактерина рекомендуется лишь в плодородных почвах, содержащих фосфор и микроэлементы. Отсутствие последних отрицательно сказывается на жизнедеятельности вносимых бактерий. Азотобактерин применяют для бактеризации семян, рассады, компостов. При этом урожайность увеличивается на 10-15%. Семена зерновых опудривают сухим азотобактерином из расчета 100 млрд. клеток на 1 гектарную порцию семян. Картофель и корневую систему рассады равномерно смачивают водной суспензией бактерий.
Ризоторфин содержит клубеньковые бактерии рода Rhizobium, которые живут на корнях бобовых растений и обеспечивают симбиотическую фиксацию азота воздуха. Применяют только под бобовые культуры. Из накапливаемых этими культурами 100-300 кг азота на 1 га в год, 1/3 потребляется растениями из почвы, 2/3 усваивают клубеньковые бактерии из воздуха.
Для приготовления ризоторфина торф сушат при температуре не выше 100 оС и размалывают в порошок. Наиболее эффективным способом стерилизации является облучение его гамма-лучами. Перед стерилизацией размолотый, нейтрализованный мелом и увлажненный до 30-40% торф расфасовывают в полиэтиленовые пакеты. Затем его облучают и заражают клубеньковыми бактериями, используя шприц, с помощью которого впрыскивается питательная среда, содержащая клубеньковые бактерии.
Прокол после внесения бактерий заклеивается липкой лентой. Каждый грамм ризоторфина должен содержать не менее 2.5 млрд. жизнеспособных клеток с высокой конкурентоспособностью и интенсивной азотфиксацией. Препарат хранят при температуре 5-6 оС и влажности воздуха 40-55%. Пакеты могут быть весом от 0.2 до 1.0 кг. Доза препарата составляет 200 г на га. Заражение семян производят следующим образом: ризоторфин разбавляют водой и процеживают через двойной слой марли. Полученной суспензией обрабатывают семена. Семена высевают в день обработки или на следующий.
Препаратом обрабатывают (инокулируют) семена перед посевом. Ризоторфин повышает урожайность бобовых на 10-15%, в хозяйствах, выращивающих их впервые, — на 50-100%.
Фосфобактерин — препарат, содержащий спороносную бактерию Bacillus megaterium var. phospaticum способную минерализовать фосфор органических соединений.
Культуру Bacillus phosphaticum выращивают глубинным способом. Состав питательной среды следующий (в %): кукурузный экстракт - 1,8; меласса - 1,5; сульфат аммония - 0,1; мел - 1; вода - остальное. Культивирование проводят в строго асептических условиях при постоянном перемешивании и принудительной аэрации до стадии образования спор. Основные параметры проведения процесса: температура - 28-30 С, рН среды - 6,5-7,5; длительность культивирования - 1,5-2 суток. Полученныю в ходе культивирования биомассу клеток отделяют центрифугированием и высушивают в распылительной сушилке при 65-75 С до остаточной влажности 2-3 %. Высушенные споры смешивают с наполнителем (каолином).
Фосфоробактерин наносят на высеваемые семена. Предполагается, что в почве бактерии переходят на развивающуюся корневую систему растений.Здесь их размножение и биохимическая деятельность вызывают разложение органических соединений фосфора, что улучшает питание растений. Опыты, проведенные с этим препаратом, показали, что он оказывает некоторое положительное влияние на рост растений и увеличивает урожай (примерно на 10%). Вместе с тем оказалось, что эффективность фосфоробактерина на почвах, удобренных суперфосфатом, не снижается, как это можно было ожидать, а, наоборот, часто повышается.
Установлено, что фосфоробактерин усиливает рост корневой системы растений. Это можно объяснить тем, что Вас. megaterium вырабатывает биологически активные вещества, среди которых имеются тиамин, пиридоксин, биотин, пантотеновая и никотиновая кислоты, витамин В12 и другие соединения. Эти вещества несколько усиливают рост растений в первые этапы их развития.
Препарат АМБ (Автохтонная микрофлора группы Б) - комплексный препарат, который включает большое количество различных микроорганизмов (аммонифицирующие, целлюлозоразрушающие, автохтонные микроорганизмы и др.), способные разлагать органические вещества, высвобождая газообразный аммиак - то есть вести процесс нитрификации или аммонификации. Препарат АМБ применяется в тех случаях, когда почва обеднена и не имеет достаточного количества нативных микроорганизмов для проведения сельскохозяйственной деятельности. Его применяют для создания грунта в теплицах и парниках при выращивании овощных культур и рассады.
Препарат готовят на месте его использования из измельченного низинного торфа или торфяной почвы. На 1 т торфа прибавляют 1 ц мелко раздробленного известняка, 2 кг фосфоритной муки и 1 кг маточной культуры, которую приготавливают во Всесоюзном НИИ сельскохозяйственной микробиологии. Подготовленный компост увлажняют и выдерживают в теплом помещении (при температуре около 20°С) в течение трех недель, периодически перелопачивая.
Применение удобрения
Удобрение АМБ поверхностно вносят под зерновые культуры в количестве 250--500 кг/га и сразу же заделывают орудиями предпосевной обработки. Под картофель, капусту и некоторые другие пропашные культуры удобрение рекомендуется вносить местно из расчета 500-4000 кг/га.
Эффективность применения
Прежде всего, необходимо учитывать, что данное бактериальное удобрение имеет ограниченный срок использования. Поэтому его применяют с учетом действия в два, три месяца. Эффект от применения довольно значителен. Зерновые культуры дают урожай на 10-15% выше обычного. Клубневые - еще больше - до 35-40%. Обуславливается это тем, что в продолжение своей жизнедеятельности микроорганизмы (бактерии), постоянно вырабатывают полезные для растений питательные вещества и уничтожают вредные грибковые образования.
Вопрос № 91
Ризосферные и почвенные микроорганизмы как стимуляторы роста растений, - продуцирующие различные витамины, ростовые вещества: гибереллины, ауксины, кинины. Ризосферные и почвенные микроорганизмы как ингибиторы роста растений, продуцирующие фитотоксины.
Механизмы положительного влияния ризобактерий на жизнедеятельность растений различны. В основном изучены взаимодействия растений с азотфиксирующими ризобактериями. К важнейшим механизмам взаимодействия в растительно-бактериальных ассоциациях относится продуцирование бактериями фитогормонов (ауксинов, цитокининов и гиббереллинов), витаминов и других биологически активных веществ. Наибольшее внимание уделялось роли бактериальных ауксинов в стимуляции роста и питания растений, поскольку способность синтезировать индолил-3-уксусную кислоту (ИУК) широко распространена среди ризобактерий. Показан положительный эффект бактериальных ауксинов на инициацию и удлинение корней, развитие боковых корней и корневых волосков, что может иметь значение для ускоренного роста, потребления питательных элементов и устойчивости растения к стрессам.
Важную роль в образовании растительно-бактериальных ассоциаций могут играть бактериальные гликопротеины — лектины, которые участвуют в колонизации корней бактериями, а также стимулируют активность растительных ферментов и ростовые процессы.
Фитотоксины продуцируют многие почвенные грибы: Aspergillus fumigatus - гельволевую кислоту, грибы рода Penicillium - патулин, Trichoderma - виридин и т. д. Поскольку каждому растению в почве сопутствует определенный ценоз микроорганизмов, это сказывается на накоплении определенных фитотоксичных соединений. Это так называемое аллелопатическое действие растений. Отмеченное свойство присуще большинству культурных растений. Так, корневая система овса выделяет скополетин (вещество, близкое к кумарину), лен - ряд ароматических соединений (феруловую, гидроксибензойную кислоты и т. д.), люцерна - алкалоиды, сахарная свекла - также ароматические соединения (гидроксибензойную, кумаровую, феруловую, ванилиновую кислоты) и т. д. Известно, что после сахарной свеклы плохо растет кукуруза, после овса резко падает всхожесть семян пшеницы, при вторичном посеве ячменя резко снижается его урожайность.
Вопрос № 98
Современные методы исследования микробной клетки: оптическая, электронная микроскопия, цитохимические, физико-химические методы. Нарисуйте основные формы микробов царства прокариот, разные варианты, расположения спор у бацилл, клостридиумов, плектридиумов, актиномицетов. Выполните схему структуры вирусов.
Оптическая микроскопия
Предел разрешения светового микроскопа задается длиной световой волны, которая для видимого света лежит в пределах от 0,4 мкм (фиолетовый) до 0,7 мкм (темно-красный). Самыми маленькими объектами, которые еще можно наблюдать в световой микроскоп, являются бактерии и митохондрии (их ширина 0,5 мкм). Более мелкие элементы клетки искажаются эффектами, вызванными волновой природой света.
Существует серьезная опасность того, что процедуры фиксации или заключения могут повредить структуру клеток или клеточных макромолекул. Вот почему предложен другой метод приготовления срезов - быстрое замораживание. Замороженную ткань режут на криостате в специальном микротоме, установленном в холодной камере.
В содержимом большинства клеток, состоящих на 70% из воды, отсутствуют компоненты, способные помешать прохождению световых лучей. В естественном состоянии большинство клеток после фиксации и приготовления срезов невидимы в обычном световом микроскопе.
Электронная микроскопия
Общая схема просвечивающего электронного микроскопа (ПЭМ) напоминает схему светового, хотя электронный микроскоп значительно больше и как бы перевернут. Источник излучения - нить катода, испускающая электроны с вершины цилиндрической колонны высотой около двух метров. В электронном микроскопе нельзя наблюдать живые объекты. Поэтому ткани фиксируют, сшивая клетки и клеточные структуры глутаральдегидом, а затем обрабатывают осмиевой кислотой. Образцы обезвоживают, фиксируют смолами и нарезают тонким стеклянным или алмазным ножом.
Тонкие срезы являются двумерными срезами ткани и не позволяют судить о трехмерной структуре клеточных компонентов. Трехмерное изображение можно получить после реконструкции сотен серийных срезов. В настоящее время разработаны более прямые методы получения трехмерного изображения. Один из них состоит в изучении образца под сканирующим электронным микроскопом. Для получения изображения в просвечивающем электронном микроскопе используют электроны, проходящие через образец, а в сканирующем электронном микроскопе используются электроны, рассеиваемые или излучаемые поверхностью образца. В данном случае образец должен быть зафиксирован, высушен и покрыт тонкой пленкой тяжелого металла. Затем образец сканируется очень узким пучком электронов. Таким образом, происходит формирование единого, цельного и значительно увеличенного изображения.
Просвечивающий электронный микроскоп можно использовать для изучения поверхности образца с очень большим увеличением, наблюдая отдельные макромолекулы. Как и при сканирующей электронной микроскопии, на высушенный образец напыляется тонкая пленка тяжелого металла. Металл напыляется под определенным углом, так что отложения напыленной пленки в некоторых местах толще, чем в других. Этот процесс известен как оттенение - здесь возникает эффект тени, создающий впечатление трехмерности изображения.
В настоящее время можно наблюдать с высоким разрешением даже внутренние детали трехмерных структур, таких, как вирусы. Для этого используют метод криоэлектронной микроскопии, где очень тонкий (100 нм), быстро замороженный слой влажного образца помещают на микроскопическую решетку. С помощью специального приспособления гидратированный образец удерживают при - 160сС в вакууме микроскопа. Таким способом можно наблюдать материал практически непосредственно: без фиксации, окраски и сушки.
Для цитохимических исследований пригодны препараты клеток, фиксированных всеми указанными выше фиксаторами, причем каждый раз фиксатор выбирается в соответствии с тем, какое вещество должно быть выявлено. Пригодны также срезы свежезамороженных тканей, мазки, пленки эпителия, а также материал, подвергнутый лиофилизации.
С помощью цитохимических реакций можно прежде всего выявить все основные неорганические компоненты клетки: К, Na, Fe, Са, Си, Р, Hg, S, N. Выявление неорганических компонентов осуществляется широко известными из неорганической химии, но несколько видоизмененными в применении к биологическим объектам реакциями.
Методы исследования физико-химических свойств клетки:
1.О вязкости клеточного содержимого, которое дает представление об агрегатном состоянии цитоплазмы и ядра, можно судить по скорости падения зерен крахмала в цитоплазме некоторых растительных клеток, по скорости перемещения ядрышка под влиянием силы тяжести, по скорости перемещения капельки масла, введенной в нервное или мышечное волокно, по скорости перемещения металлической частицы, введенной в клетку в магнитном поле, и по броуновскому движению, обычно наблюдаемому во многих растительных и животных клетках.
2. Измерение удельного веса клетки осуществляется путем подбора жидкости, не оказывающей токсического действия и с удельным весом, равным таковому клетки. Для этой цели пригодны, например, растворы гуммиарабика различной концентрации. Клетки помещаются в такую жидкость и центрифугируются. Удельный вес клеток и жидкости совпадает тогда, когда клетки не перемещаются при центрифугировании в этой жидкости. Таким же способом измеряется удельный вес изолированных ядер и органоидов клетки.
3.Определение показателя преломления клеток производится путем погружения клеток в индифферентные жидкости, обладающие разными показателями преломления. Когда показатели преломления клеток и среды совпадают, контуры клетки становятся невидимыми при наблюдении в фазово-контрастный микроскоп. Второй метод измерения показателя преломления основан на наблюдении клеток в интерференционном микроскопе. При этом по специальным формулам вычисляется отставание по фазе световой волны, прошедшей через клетку, по сравнению со световой волной, прошедшей вне клетки.
4.Определение внутриклеточного рН можно произвести путем прижизненного окрашивания клеток красителями, обладающими свойствами индикаторов (нейтральный красный, бромкрезиловый синий). В крупных клетках, например в гигантском нервном волокне, мышечном волокне, в крупных растительных клетках, рН определяется электрометрическим методом с применением микроэлектродов.

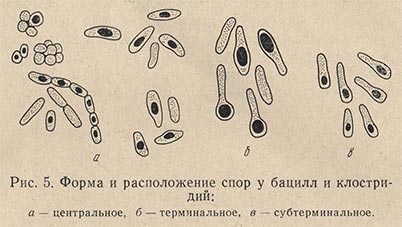

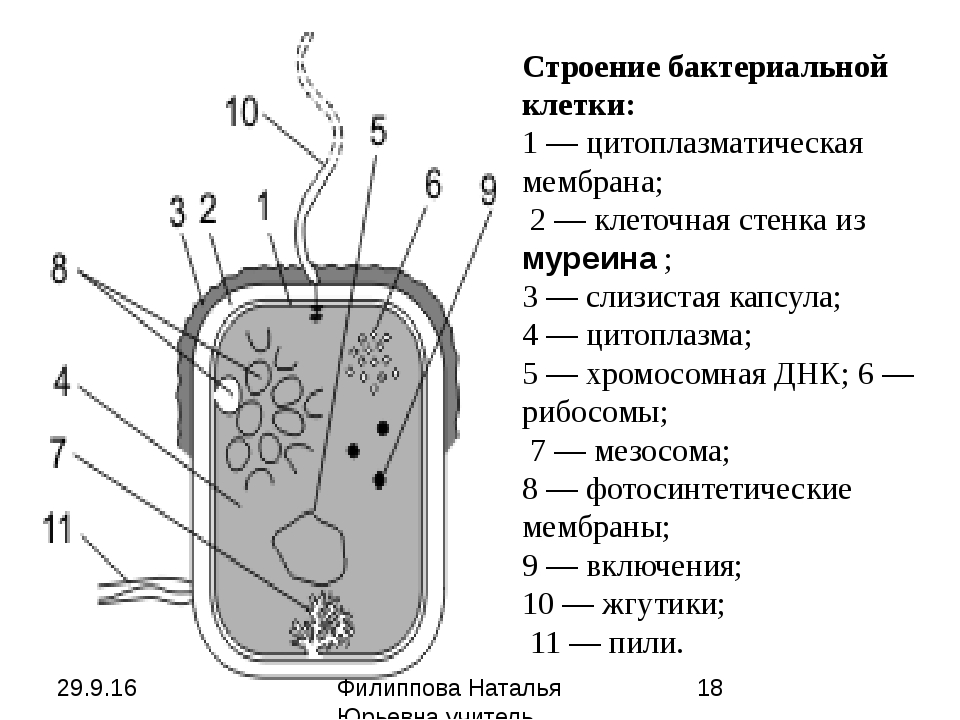
Вопрос № 99
Микроструктура микробов. Представьте рисунок прокариот. Обозначьте поверхностные структуры: жгутики, ворсинки, фимбрии, капсулу, клеточную стенку, и внутренние: цитоплазматическую мембрану, нуклеоид, включения, эписомы, рибосомы, плазмиды.
Вопрос № 100
Представьте рисунки эукариот. Грибы. Представители классов зигомицет, аскомицет, базидиальных, дейтеромицет.
 Строение аскомицет Строение аскомицет


Дейтериомицеты
 |
|
|
 Скачать 0.66 Mb.
Скачать 0.66 Mb.




 Строение аскомицет
Строение аскомицет

