Защита. Ответы для защиты л.р.. Вопросы по теме "Фазовые равновесия"
 Скачать 473.59 Kb. Скачать 473.59 Kb.
|
|
Общие вопросы к работам № 3,4,5,6,7 Вопросы по теме: "Фазовые равновесия" Что называется фазовым равновесием? Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического и химического равновесия. 2. Определение: фаза, компонент (составляющее вещество), независимый компонент (независимое составляющее вещество). Фазой называется гомогенная часть системы, ограниченная поверхностью раздела и характеризующаяся одинаковыми химическими и физическими свойствами во всех своих точках. Составляющие вещества, с помощью наименьшего числа которых можно однозначно выразить состав каждой фазы при любых условиях существования системы, называется компонентами. 3. Правило фаз Гиббса: записать уравнение, дать объяснение символам. В равновесной системе связь между числами фаз, компонентов и термодинамических степеней свободы выражаются законом равновесия фаз – правилом фаз Гиббса: С = К – Ф + 2 По числу компонентов (К) различают системы однокомпонентные, двухкомпонентные, трехкомпонентные и т.д. По числу степеней свободы (С) системы разделяются на инвариантные (С = 0), моновариантные (С = 1), дивариантные (С =2) и т.д. f = K – Ф + φ Это и есть уравнение правила фаз Гиббса, где f – число степеней свободы; К – число компонентов; Ф – количество фаз; φ – число параметров, действующих на систему. 4. Определения: "число степеней свободы". К каким системам применимо правило фаз? Число степеней свободы – число темодинамических параметров, определяющих состояние системы, которые можно произвольно менять без изменения числа фаз в системе. К этим параметрам относятся температура, давление и концентрации веществ. Число независимых компонентов термодинамических параметров состояния фаз равновесной системы, произвольное изменение которых в определенных пределах не вызывает исчезновения одних и образование других фаз, называется числом термодинамических степеней свободы, или вариантностью системы. Правило фаз применимо только для систем, которые находятся в состоянии термодинамического равновесия. В природе такое равновесие обычно отсутствует. Например, весной лёд тает и исчезает, в холодное время года вода замерзает, а совместное присутствие льда и воды — явление временное. Если в рассматриваемой системе не все возможные равновесия реализуются по кинетическим причинам (слишком малы скорости процессов, ведущих к равновесию), то сделанные с помощью правила фаз выводы могут не соответствовать реальным наблюдениям. Требование соблюдения равновесия фаз не допускает исключений (к метастабильному равновесию правило фаз неприменимо), тогда как отказ от любого другого из перечисленных допущений ведёт к модификации формул правила фаз. 5. Классификация систем на основе "Правила фаз". Правило фаз позволяет классифицировать все системы, или по числу фаз или по числу компонентов, или по числу степеней свободы. По числу фаз системы делятся на однофазные (Ф = 1), двухфазные (Ф = 2), трехфазные (Ф = 3) и т. д. По числу компонентов системы делятся на однокомпонентные (К 1), двухкомпонентные {К = 2), трехкомпонентные (/С = 3) и т. д. По числу степеней свободы системы могут быть безвариантными (или инвариантными), когда число степеней свободы равно нулю (С = 0); одновариантными (или моновариантными), когда С = 1; двухвариантными (или бивариант-ными), если С = 2, и т. д. Если учитывается только два внешних фактора — давление и температура, — влияющих на равновесие системы, то, как показывает уравнение (П1,2), однокомпонентная равновесная система не может быть более чем трехфазной, двухкомпонентная — более чем четырехфазной и т. д. Действительно, максимальному числу фаз в равновесной системе отвечает равенство С = О, следовательно, К + 2 = Ф, откуда непосредственно следует, что при /С=1 Ф = 3, при К=2 Ф = 4 и т. д. 6. Физико-химический анализ (определение). Какие задачи решаются с помощью этого метода исследования? Физико-химический анализ — комплекс методов анализа физико-химических систем путём построения и геометрического анализа диаграмм состояния и диаграмм состав-свойство. Этот метод позволяет обнаружить существование соединений (например, медистого золота CuAu), существование которых невозможно подтвердить другими методами анализа. 7. Принцип "непрерывности" и принцип "соответствия" (определения). Объясните их суть. Принцип непрерывности устанавливает, что при непрерывном изменении параметров, определяющих состояние системы, свойства отдельных фаз её изменяются непрерывно. Свойства всей системы изменяются непрерывно до тех пор, пока не изменится число или характер её фаз. При появлении новых или исчезновении имевшихся фаз свойства системы в целом меняются скачком. Принцип соответствия гласит: каждой совокупности фаз, находящихся в равновесии в данной систем, отвечает на диаграмме определенный геометрический образ. Например, каждой твердой фазе на плоской диаграмме соответствует своя кривая температур начала кристаллизации 8. Термический анализ и способы его проведения. Какие задачи решаются этим методом? Термический анализ один из распространенных методов физико-химического анализа, служащий для исследования процессов, происходящих в веществе при непрерывном нагревании или охлаждении. Термический анализ ‑ совокупность методов определения температур, при которых происходят процессы, сопровождающиеся либо выделением тепла (например, кристаллизация из жидкости), либо его поглощением (например, плавление, термическая диссоциация). Методы термического анализа делятся на: · Дилатометрия · Дифференциальная сканирующая калориметрия (ДСК) · Дифференциальный термический анализ (ДТА) · Термомеханический анализ / динамический механический анализ (ДМА) · Термогравиметрический анализ (ТГА) · Совмещенный термический анализ (СТА) · Метод лазерной вспышки · Анализ выделяющихся газов (АВГ) Методы термического анализа используют для: 1. исследования состава и свойств природных минеральных образований и синтетических продуктов разного назначения; 2. качественного и количественного анализа веществ; 3. построения диаграмм состояния; 4. определения физических констант: температур и энтальпий плавления, температуры и энтальпий кристаллических переходов; 5. определения энтальпий фазовых превращений и энтальпий реакций; 6. определения кинетических параметров превращений; 7. определения температур фазовых превращений; 8. определения границ твердых растворов. 9. Нода (определение), "правило рычага". Нода – соединительная линия двух сопряженных точек (изотерма) Правило рычага: точка, отвечающая составу гетерогенной двойной системы, располагается на прямой, соединяющей точки, представляющие сосуществующие фазы. При этом отрезки, отсекаемые на прямой этой точкой, обратно пропорциональны количествам каждой из фаз (графическое выражение правила смешения). 10. Истинные растворы (определение) их отличие от коллоидных растворов и механических смесей. Истинные растворы. Такие растворы характеризуются полной гомогенностью благодаря одинаковым размерам частиц растворенного вещества и растворителя и отсутствию поверхностей раздела между ними. Истинные растворы — это однофазные дисперсные системы. Истинные растворы характеризуются большой прочностью связи между растворенной жидкостью и растворителем. Растворенная жидкость (вещество) в дальнейшем не отделяется от растворителя, остается равномерно распределенной в растворителе. Истинный раствор сохраняет гомогенность неопределенно долгое время, если только в нем не происходит никаких самопроизвольных вторичных процессов (например, гидролиза, окисления, фотосинтеза). Истинные растворы бывают ионно-дисперсными и молекулярно-дисперсными. Размер частиц в первых составляет менее 1 нм, а растворенное вещество находится в виде отдельных гидратированных ионов и молекул в равновесных количествах. Истинные растворы всегда прозрачны, они не должны содержать взвешенных частиц и осадка. Особенностью истинных растворов является то, что они гомогенны даже при рассматривании в электронный микроскоп. Компоненты, входящие в их состав, не могут быть разделены никаким способом. Истинные растворы хорошо диффундируют. К этой группе относятся растворы электролитов и неэлектролитов, таких как глюкоза, натрия хлорид, спирт, магния сульфат и т.д. Истинные растворы высокомолекулярных соединений являются молекулярно-дисперсными системами, которые образованы дифильными макромолекулами. С одной стороны, они являются однофазными гомогенными системами (как и истинные растворы), а с другой — имеют некоторые особенности, сближающие их с коллоидными растворами (движение молекул, подобное броуновскому, малые скорости диффузии, неспособность к диализу, повышенная способность к образованию молекулярных комплексов и некоторые другие). Коллоидные растворы. Коллоидный раствор — это гетерогенная дисперсионная система, в которой частицы растворенного вещества обладают ультрамикроскопической (коллоидной) степенью дробления. Размер частиц дисперсной фазы составляет 1—100 нм. Даже электронные иммерсионные микроскопы не всегда дают возможность визуально обнаружить частицы дисперсионной фазы коллоидных растворов. Истинные растворы характеризуются молекулярной или ионной степенью дисперсности, в растворах высокомолекулярных соединений образуются макромолекулы или их ассоциации, коллоидные растворы отличаются наличием мицелл растворенного вещества. 11. Растворы идеальные, предельно разбавленные, реальные (неидеальные); дать определения. Растворы регулярные и атермальные. Идеальным называется раствор, образование которого из компонентов не сопровождается тепловым эффектом и изменением объема: ΔН=0, ΔV=0. В идеальном растворе энергии взаимодействия всех видов молекул одинаковы.Такие растворы образуют, например, соседние гомологи в ряду органических соединений или смеси изомеров. Предельно разбавленным называется раствор, в котором концентрация растворенного вещества бесконечно мала. Растворитель в таких растворах подчиняется законам идеальных растворов, а растворенные вещества не подчиняются. Неидеальными называются растворы, которые не подчиняются законам идеальных и предельно разбавленных растворов. Для характеристики их равновесных свойств пользуются методом активности. регулярным является раствор, образование которого путем смешения чистых компонентов. Атермальные растворы, рассматриваемые как более общий случай, чем идеальные растворы, являются предельным случаем, к которому близки растворы неполярных компонентов с сильно различающимися молекулярными объемами. Вопросы к работе №6: "Ограниченно смешивающиеся жидкости" №1 Три типа жидких бинарных смесей, образующихся при смешивании жидкостей. Бинарные (двойные) смеси можно разделить на три типа: 1) взаимно нерастворимые смеси, например смесь воды и бензола 2) полностью растворимые смеси, например спирт — вода 3) частично растворимые смеси, т. е. такие, которые взаимно растворяются только в определенной области концентраций и температур. №2. Причины расслоения системы на две несмешивающиеся жидкие фазы. Практическое правило. ?????? Если смешивать две жидкости с ограниченной растворимостью, то в некотором интервале температур они будут неограниченно смешиваться друг с другом с образованием одной гомогенной фазы (раствора). В другом интервале температур система будет распадаться на две гомогенные фазы: раствор первого компонента во втором и второго компонента в первом. Система в целом гетерогенна, при неизменной температуре состав каждого из равновесных слоев остается постоянным и не зависит от количества той или иной жидкости в смеси. Температура, выше или ниже которой имеет место неограниченная взаимная растворимость компонентов, называется критической. Отстаивание, нагрев до высоких температур, осаждение, замораживание №3.Критическая температура растворения. Критическая температура растворения – такая температура, выше или ниже которой жидкости смешиваются между собой в неограниченных количествах. Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается. №4. Начертить диаграммы с верхней, нижней, верхней и нижней критическими температурами растворения и без них. Чем объясняется последнее явление? Примеры. 1) При некоторой температуре, называемой критической температурой растворения, составы обеих равновесных жидких фаз становятся одинаковыми и достигается полная гомогенность системы. Системы, состоящие из двух ограниченно смешивающихся жидкостей, взаимная растворимость которых возрастает с повышением температуры, называются системами с верхней критической температурой растворения. К таким системам относятся системы вода — анилин, вода — фенол, вода — нитробензол. 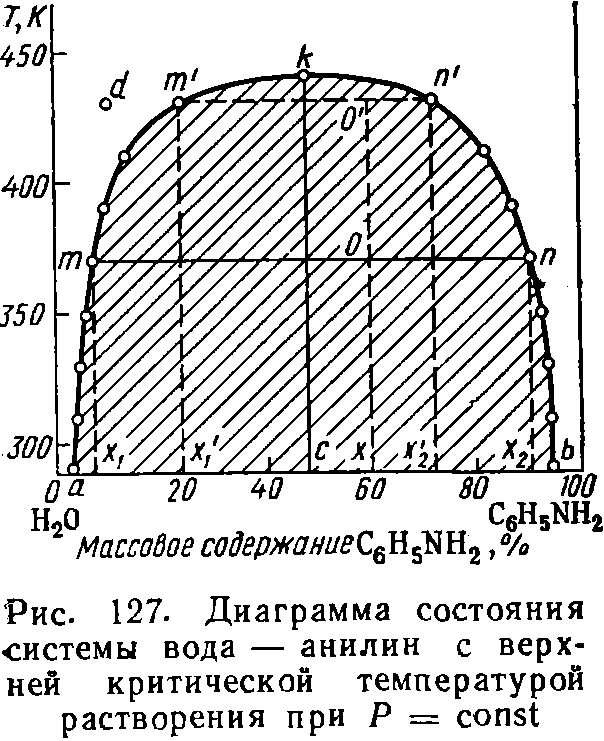 2) Системы, в которых взаимная растворимость двух жидкостей увеличивается с понижением температуры, называются системами с нижней критической температурой растворения. Примерами таких систем являются системы вода — триэтиламин, вода — 2,4,6-триметилпиридин 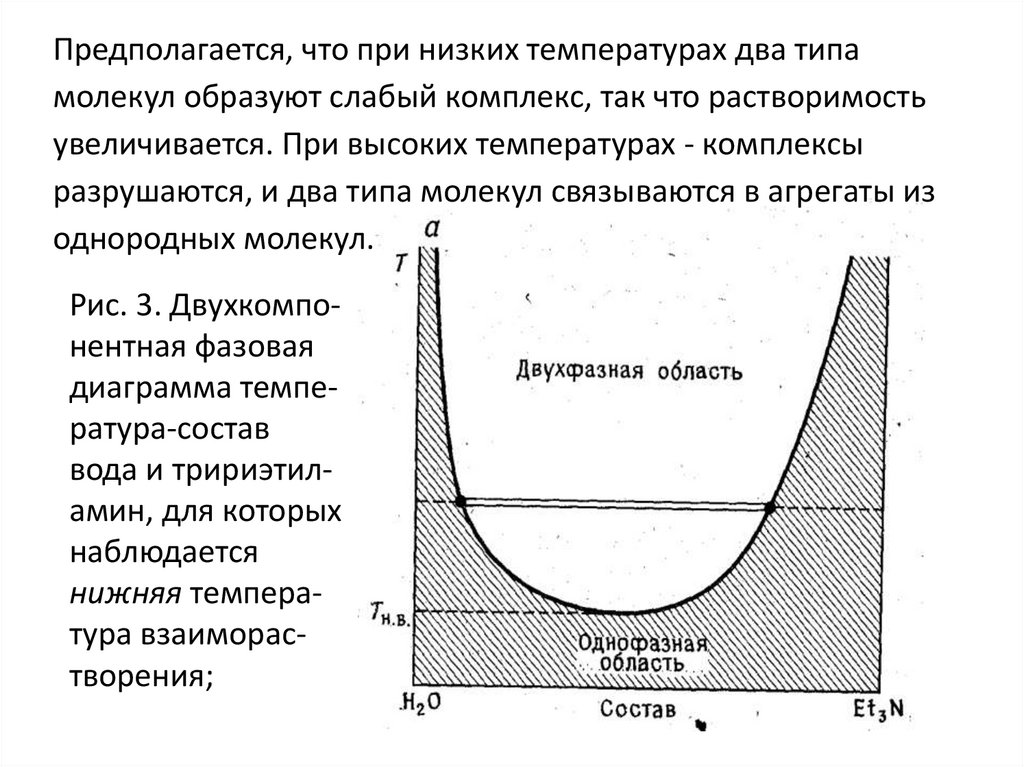 3) Некоторые орагнические жидкости образуют с водой частично растворимые системы, характеризующиеся 2 критическими температурами растворения – верхней и нижней – и кривая растворения представляют собой замкнутое, неправильной формы кольцо 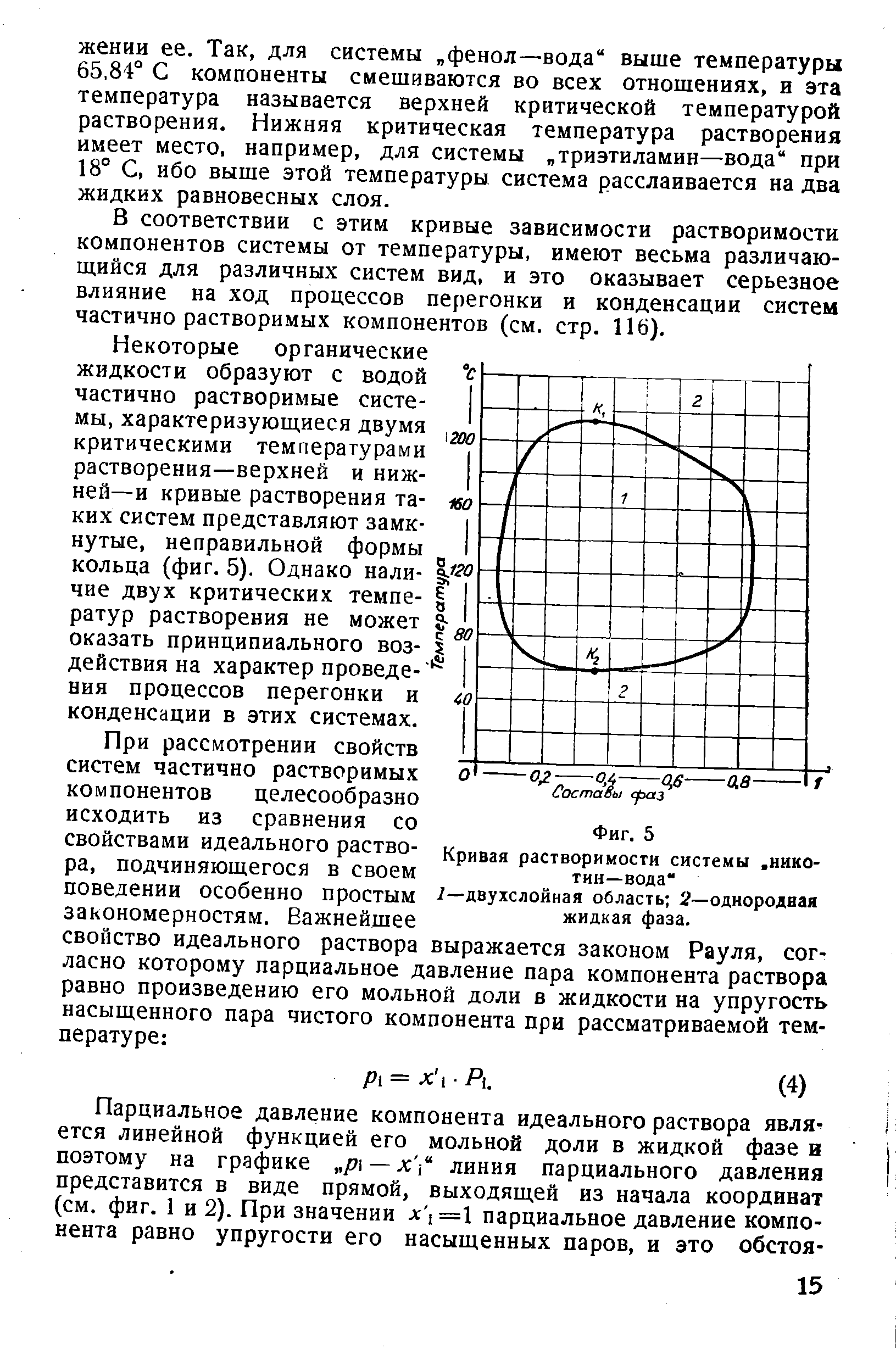 . 4) без критических температур растворения. Примером жидкостей данного типа может быть смесь этилового эфира с водой. При температуре - 3,8°С насыщенный раствор эфира в воде замерзает и ниже этой температуры существует раствор, содержащий 1% воды в эфире. При температуре 20°С эфирный слой содержит 2% воды. Выше этой температуры эфир испаряется и может существовать только водный раствор эфира. Таким образом, критические температуры смешения достичь не удается. 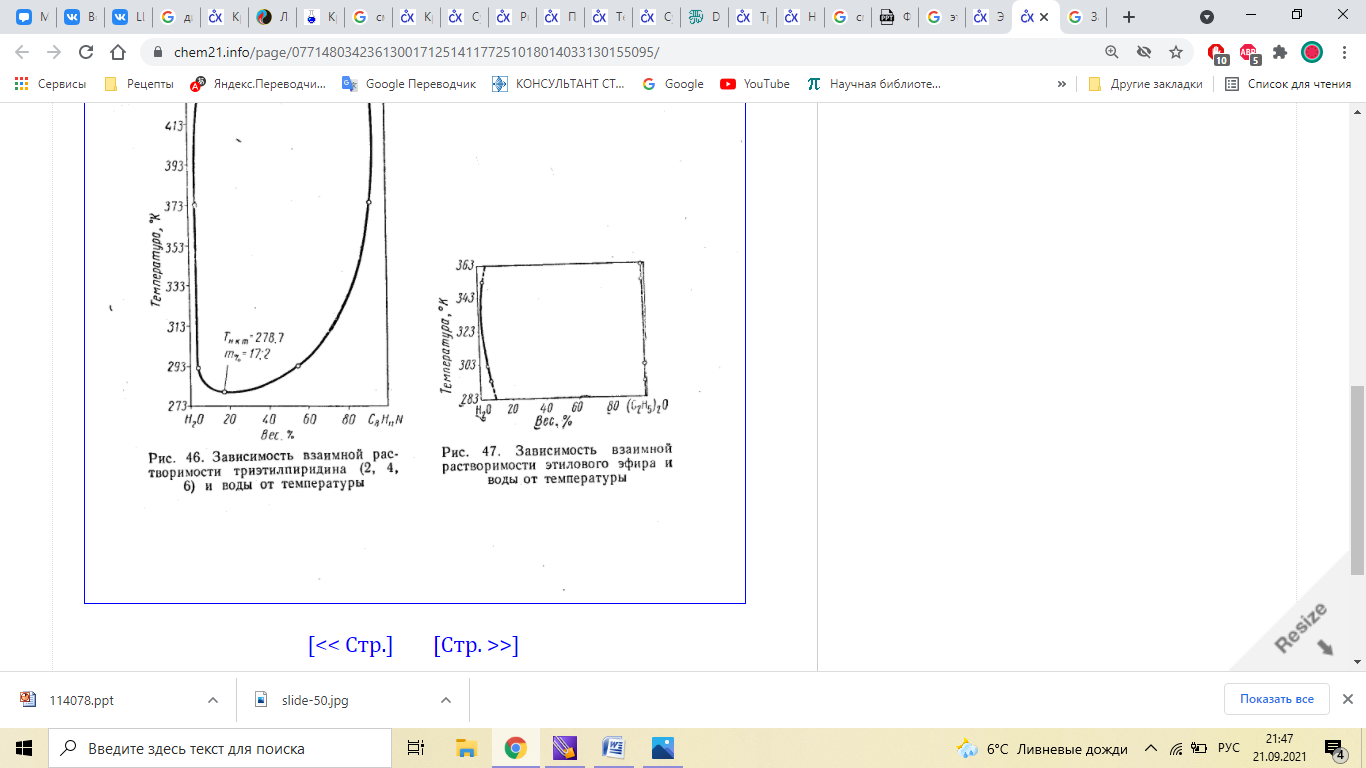 №5. Правило Алексеева для случая, когда состав выражается в процентах по массе. правилу Алексеева: середины конод, соединяющих фигуративные точки сопряженных растворов, лежат на прямой линии, проходящей через верхнюю или нижнюю критическую растворимости (выполняется, если состав в весовых %). №6. Продемонстрировать применение "правила рычага". Правило рычага: точка, отвечающая составу гетерогенной двойной системы, располагается на прямой, соединяющей точки, представляющие сосуществующие фазы. При этом отрезки, отсекаемые на прямой этой точкой, обратно пропорциональны количествам каждой из фаз (графическое выражение правила смешения). №7. Показать, как рассчитывается число степеней свободы для различных областей и кривых, их ограничивающих, на полученной Вами диаграмме. Анализ диаграмм состояния позволяет определить число фаз в системе, границы их существования, характер взаимодействия компонентов. В основе анализа диаграмм состояния лежат два принципа: принцип непрерывности и принцип соответствия. Согласно принципу непрерывности, при непрерывном изменении параметров состояния все свойства отдельных фаз изменяются также непрерывно; свойства системы в целом изменяются непрерывно до тех пор, пока не изменится число или природа фаз в системе, что приводит к скачкообразному изменению свойств системы. Согласно принципу соответствия, на диаграмме состояния системы каждой фазе соответствует часть плоскости – поле фазы. Линии пересечения плоскостей отвечают равновесию между двумя фазами. Всякая точка на диаграмме состояния (т. н. фигуративная точка) отвечает некоторому состоянию системы с определенными значениями параметров состояния. Вопросы к работе № 14 : « Спектры поглощения. Проверка закона Бугера-Беера» 1. Какие приборы используются при фотоколориметрических измерениях и чем они принципиально отличаются от спектрофотометров? Какие современные фотоколориметры используют для измерения светопоглощения? Для спектрофотометрического анализа используются различные приборы. Они состоят из: - источника световой энергии, дающей сплошной спектр (для ультрафиолетовой области – водородная лампа, для видимой области – лампа накаливания) ; - монохроматора, разлагающего сплошной спектр и выделяющего из него свет определенной длины волны (дифракционные решетки, окрашенные светофильтры с узкой областью пропускания); - кювет, в которых помещается исследуемое вещество; -приемника лучистой энергии (фотографические пластинки, фотоэлементы и дт.). 2. Опишите принципиальное устройство Вашего колориметра. КФК-2 (рис. 4.1) является однолучевым прибором и предназначен для измерения коэффициентов пропускания и абсорбционности растворов и твердых тел в отдельных участках диапазона длин волн 315-980 нм, выделяемых светофильтрами, а также для определения концентрации веществ в растворах. Кроме того, колориметр позволяет измерять коэффициенты пропускания взвесей, эмульсий и коллоидных растворов в проходящем свете. КФК-2 применяют на предприятиях водоснабжения, в медицинской, химической, пищевой, металлургической промышленности и в сельском хозяйстве.  Рис. 4.1. Внешний вид прибора КФК-2: 1 — микроамперметр; 2 — крышка кюветного отделения; 3 — ручка «Установк 100 грубо»; 4 — ручка установки чувствительности прибора; 5 — ручка перестановки кювет; 6 — ручка установки светофильтра; 7 — источник света Устройство прибора Колориметр состоит из блока питания и оптического блока. В оптический блок входят осветитель, оправа с оптикой, светофильтры, кюветное отделение с кюветодержателем, фотометрическое устройство с усилителем постоянного тока и элементами регулирования, регистрирующий прибор. Осветитель представляет собой лампу типа КГМ. Конструкция осветителя обеспечивает перемещение лампы в трех взаимно перпендикулярных направлениях для ее правильной установки. В оправу встроены конденсор, диафрагма и объектив. Цветные светофильтры вмонтированы в диск. Светофильтр вводят в световой пучок с помощью ручки. Рабочее положение каждого светофильтра фиксируется. Кюветодержатель расположен под крышкой в кюветном отделении. При работе в кюветном отделении одновременно находятся две кюветы — с растворителем (или нулевым раствором) и окрашенным раствором. Перестановку кювет в световом пучке осуществляют поворотом ручки до упора. В фотометрическое устройство входят фотоэлемент Ф-26, фотодиод ФД-24К, светоделительная пластинка и усилитель. Включение фотоприемников производится с помощью ручки. В качестве регистрирующего прибора используется микроамперметр типа М907-10, шкала которого оцифрована для определения абсорбционности и коэффициентов пропускания. Методика работы с прибором Колориметр необходимо включить в сеть за 15 мин до начала измерений. Во время прогрева кюветное отделение должно быть открыто (при этом шторка перед фотоприемниками перекрывает световой пучок). Ручкой ввести необходимый по роду измерения цветной светофильтр. Затем установить минимальную чувствительность прибора, для чего ручку «Чувствительность» поставить в положение «1», а ручку «Установка 100 грубо» — в крайнее левое положение. Перед измерениями при переключении фотоприемников необходимо проверить установку стрелки микроамперметра на нуль по шкале коэффициентов пропускания при открытом кюветном отделении. В случае смещения стрелки от нулевого положения ее следует подвести к нулю с помощью потенциометра «Нуль». Ввести в световой поток кювету с водой, закрыть крышу кюветного отделения. Ручками «Чувствительность», «Установка 100 грубо» и «Точно» установить нуль по шкале абсорбционности. Ручка «Чувствительность» может находиться в одном из трех положений: «1», «2» или «З». Затем поворотом ручки кювету с водой заменить на кювету с окрашенным раствором. Снять отсчет по шкале значений абсорбционности. Измерения проводятся 3-5 раз, после чего окончательное значение измеренной абсорбционности определяют как среднее арифметическое из всех полученных значений. Технические характеристики прибора: Спектральный диапазон работы (разбит на определенные интервалы с помощью светофильтров) 315-980 нм Приемники излучения: фотоэлемент Ф-26 для работы в диапазоне 315-590 нм фотодиод ФД-24К для работы в диапазоне 590-980 нм Диапазонизмерения абсорбционности 0-1,3 Напряжение питание 220 В, частота 50 Гц 3. В какой области спектра следует проводить измерения для того, чтобы с наибольшей точностью и чувствительностью определить количество вещества в растворе? Как это выполняется на ФЭКе? (КФК-2). 4. При какой оптической плотности раствора (Д) достигается минимальная относительная ошибка измерений и какова ее величина? Показать это расчетом. 5. В каких оптимальных пределах величины оптической плотности следует производить измерения с тем, чтобы ошибка фотометрических измерений не превышала удвоенной минимальной ошибки? Минимальное отклонение от закона Бера при разбавлении даже не очень прочных окрашенных растворов получается в том случае, когда окрашенный раствор разбавляют не чистым растворителем, а раствором реактива, имеющим концентрацию, равную избыточной концентрации реактива в исходном окрашенном растворе. Разбавление окрашенного соединения в этом случае происходит при постоянной избыточной концентрации реактива, поэтому степень диссоциации окрашенного соединения остается неизменной и закон Бера практически не парушается. Недостаточная монохроматичность поглощаемого светового потока обычно вызывает отрицательные отклонения от основного закона светопоглощения. Причем, чем шире интервал длин волн поглощаемого света, тем уже область определяемых концентраций, где соблюдается основной закон светопоглощения. 6. Какие операции следует произвести для достижения требований пункта 5. (выбор кювет и концентрации раствора)? 7. Продемонстрируйте своими графиками выполнение закона Бугера-Ламберта-Беера и выполнение требований пункта 5. 8. Наблюдается ли отклонение от закона Бэра и с чем это может быть связано? |
