|
|
Курсовая работа по неорганической химии: Синтез соединения свинца с L-цистеином. Курсовая Мусс. Введение Литературная часть
 СОДЕРЖАНИЕ СОДЕРЖАНИЕ
Введение………………………………………………………………………….3
1 Литературная часть………………………………………………………........4
Свинец………………………………………………………………………..4
Общие сведения…………………………………………………………..4
Изотопы свинца……………………………………………………….......5
Нахождение в природе…………………………………………………....6
Химические свойства…………………………………………………......6
Применение………………………………………………………………..8
1.2 Оксиды свинца………………………………………………………….........9
1.2.1 Оксид свинца(II)……………………………………………………….......9
1.2.2 Химические свойства……………………………………………………...9
1.2.3 Оксид свинца (IV)…………………………………………………….......10
1.2.4 Химические свойства………………………………………………….....10
1.2.5 Оксид свинца (II) (IV)…………………………………………………....11
1.2.6 Химические свойства…………………………………………………….11
1.3.1 Соединения свинца в степени окисления +2……………………….......11
1.3.2 Соединения свинца в степени окисления +4……………………….......12
1.4 Комплексные соединения свинца с органическими соединениями…….12
1.5.1 Аминокислоты………………………………………………………..…..14
1.5.2 Номенклатура и строение аминокислот………………………………...16
1.5.3 Химические свойства аминокислот……………………………………..17
1.5.4 Получение аминокислот………………………………………………...18
1.5.5 Цистеин……………………………………………………………………18
1.5.6 Физические и химические свойства цистеина…………………...……..20
1.5.7 Применение цистеина…………………………………..……….……….21
2 Экспериментальная часть……………….………………..……………….....22
2.1 Приборы и реактивы…………………………………………………….....22
2.2 Получение 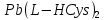 ……..………….…………………………….....22 ……..………….…………………………….....22
2.3 Анализ на содержание аминокислоты………………………………….....23
2.4 Количественное определение содержания свинца(II)……………….......23
Выводы………………………………………………………………………….26
Список литературы…………………………………………………………......27
ВВЕДЕНИЕ
Происхождение слова «свинец» до сих пор точно не выявлено, однако как пигмент вещество было известно ещё до нашей эры. Римляне применяли металл для производства труб для водопроводов. В разные времена из свинца изготавливали покрытия крыш храмов, применяли для повышения способности топлива противостоять самовозгоранию при сжатии. До 50% свинца идёт на изготовление пластин аккумуляторов, азиды свинца используются в качестве детонатора. Однако, ни для кого не секрет, что свинец является весьма токсичным веществом.
Свободный ион свинца относится к тиоловым ядам, а прочный комплексонат свинца с этилендиаминтетрауксусной кислотой малотоксичен. Поэтому детоксикация растений и животных заключается в применении комплексонатов металлов. Синтез комплексных соединений аминокислот с металлами, изучение их строения и свойств являются вкладом в области, связанные с регулированием ионами металлов биопроцессов.
Целью работы является синтез комплексного соединения свинца (II) с аминокислотой L-цистеином.
Глава 1 ЛИТЕРАТУРНАЯ ЧАСТЬ
1.1 Свинец 1.1.1 Общие сведения
Свинец-элемент 4 группы главной подгруппы шестого периода периодической системы Д.И.Менделеева, находится под номером 82. Имеет электронную конфигурацию 6s2 6p2. Атомная масса элемента равна 207,2 а.е.м. Электроотрицательность равна 2,33 по шкале Поллинга. Плотность считают равной 11,3415 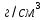 . Температура плавления 327,5 . Температура плавления 327,5 , температура кипения 1740 , температура кипения 1740 . Кристаллическая решётка представлена кубической гранецентрированной решёткой. Проявляет степени окисления -2, 0, +2, +4. Стандартный электродный потенциал считают равным -0,1263В. . Кристаллическая решётка представлена кубической гранецентрированной решёткой. Проявляет степени окисления -2, 0, +2, +4. Стандартный электродный потенциал считают равным -0,1263В.
Как простое вещество представляет собой серебристо-белый металл с синеватым отливом, для которого характерны ковкость, относительная легкоплавкость, малая теплопроводность. Обычно покрыт слоем оксидной плёнки серого цвета. Различные физико-химические свойства свинца зависят от вида и количества входящих примесей. Н.Г.Полянский говорит о том, что щелочные и щелочно-земельные металлы улучшают показатели прочности и твёрдости металла, висмут и цинк увеличивают антикоррозийную стойкость, сурьма и медь помогают повысить устойчивость свинца к серной кислоте различной концентрации. Так же примесями могут служить и собственные оксиды, что тоже влияет на свойства свинца.
В свою очередь, свинец как примесь неблагоприятно влияет на многие показатели других веществ. Они ухудшают механические свойства жаропрочных сплавов, неблагоприятно влияют на структуру чугуна и приводят к ломкости меди и латуни. В тоже время, в небольших количествах они существенно улучшают обрабатываемость стали без изменения такой важной характеристики, как прочность сплава. Свинец может образовывать большое количество сплавов, которые подразделяют на эвтектические смеси, твёрдые растворы и интерметаллические соединения [1].
Свинец и его соединения очень токсичны и оказывают губительное влияние на все живое. Они имеют свойство накапливаться в организме, однако выводятся медленно и не полностью. Наивысшую опасность представляет в состоянии молекулярно- ионной дисперстности. Ионы металла связываются с электродонорными атомами серы сульфгидрильных групп, подавляя действие ферментов. При отравлении нарушается работа нервной системы, терморегуляции, кровообращения.
Концентрации свинца, входящие в рамки ПДК, безвредны и не несут никакого разрушительного эффекта. ПДК Составляют:
В воздухе- 0,01 мг/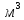
В питьевой воде- 0,03 мг/л
В консервированных овощах и фруктовых соках соках- 0,4 мг/л.
1.1.2 Изотопы свинца
В природе известны 4 стабильных изотопа свинца:204Pb, 206Pb, 207Pb, 208Pb. Распространённость их увеличивается от 204Pb к 208Pb. Изотопы 206Pb, 207Pb, 208Pb - радиогенные изотопы, конечные продукты распада урана, актиноурана и тория. Широкое распространение получили способы определения возраста горны пород, основанные на явлениях радиоактивного распада некоторых элементов. Так, конечным стабильным продуктом распада урана и тория является свинец. Исходя из соотношения содержания в породе урана и свинца или тория и свинца, можно оценить возраст породы. Изотопы с массовыми числами 210, 212 и 214 радиоактивны и встречаются реже, поскольку их периоды полураспада иногда равны 20 часам.
1.1.3 Нахождение в природе
На данный момент в природе известны более 200 минералов свинца, однако в промышленном маштабе наиболее важны: галенит (PbS), англезит (PbSO4) и церуссит PbCO3. Переход от одного минерала к другому происходит под действием природных условий: сначала содержащиеся в водах соединения превращают галенит в англезит, затем под влиянием природных карбонатов образуется церуссит. Сопутствующими свинцу элементами являются Ag, As, Bi, Cd, Cu, Fe, In, Sb, Se, Sn, Te, Tl, V, Zn. По размеру промышленного производства он находится на 4 месте. Для получения из руды наиболее значимы полиметаллические сульфидные и смешанные руды. Первой стадией является флотация, в результате которой получаются концентраты, в составе которых до 60% чистого свинца. За флотацией следует обжиг сульфидов для перевода их в оксиды. Завершается процесс восстановлением чернового свинца в присутствии кокса и флюсов. Отчистка осуществляется пирометаллургическим методом, в результате которого на выходе помимо свинца образуются как побочные продукты различные металлы и сплавы.
1.1.4 Химические свойства
Для свинца невозможны реакции с углеродом, кремнием, фосфором, мышьяком, бором. При увеличении температуры выше 400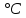 реагирует с молекулярными азотом и водородом, образуя соответствующие нитрид и гидрид. Нитрид свинца является крайне неустойчивым веществом. реагирует с молекулярными азотом и водородом, образуя соответствующие нитрид и гидрид. Нитрид свинца является крайне неустойчивым веществом.
3Pb + N2 → Pb3N2 (1)
Плюмбан, он же гидрид свинца, так же крайне неустойчив и разлагается уже при комнатной температуре. Взаимодействует с галогенами и кислородом, при этом самовоспламеняясь на воздухе.
Pb + 2H2 → PbH4 (2)
2PbH4 + 3O2 →2PbO + 4H2O (3)
Металлический свинец на воздухе под действием кислорода покрывается плотной оксидной плёнкой. Переход от одного оксида свинца к другому осуществляется за счёт изменения температуры. Так, при 430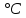 PbO переходит в Pb3O4, который в свою очередь при 550 PbO переходит в Pb3O4, который в свою очередь при 550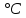 разлагается с выделением PbO и O2. разлагается с выделением PbO и O2.
С халькогенами свинец реагирует при повышении температуры с образованием соответствующих сульфидов, селенидов и теллуридов.
Pb+S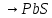 (4) (4)
По отношению к галогенам свинец ведёт себя так же крайне пассивно. С фтором реакция возможна, но уже при 100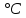 фторидная плёнка проявляет сильное ингибирующее свойство. Ещё более устойчив металл к действию на него брома и хлора, иодид же образуется только при взаимодействии паров и растворов йода. фторидная плёнка проявляет сильное ингибирующее свойство. Ещё более устойчив металл к действию на него брома и хлора, иодид же образуется только при взаимодействии паров и растворов йода.
Pb + F2 → PbF2 (5)
Pb + I2 → PbI2 (6)
Дигалогениды свинца представляют собой кристаллы, устойчивые на воздухе, во влажном воздухе при нагревании подвергаются гидролизу. При нагревании на воздухе окисляются до оксигалогенидов типа Рb2ОХ2, Рb5О4Х2, способность к окислению увеличивается в ряду F < Сl < Вr < I. Растворимость в воде при добавлении одноимённых Х- в связи с образованием комплексных анионов [PbX3]- и [PbX4]2-.Легко дают смешанные галогениды, например PbXF.
Свинец реагирует с водой, при чём кислород воздуха увеличивает скорость коррозии.
Pb + 2H2O → Pb(OH)2↓ + H2↑ (7)
Если сравнивать стандартные электродные потенциалы водорода и свинца, то последний окажется чуть более сильным восстановителем. В следствии этого свинец должен растворяться в кислотах, однако часто этого не происходит из-за образования труднорастворимых соединений . Легче всего протекает реакция с участием разбавленной азотной кислоты, потому как в этом случае происходит связывание водорода в воду и трудности при перенапряжении водорода устраняются.
Pb + 4HNO3 → Pb(NO3)2 + 2NO2↑ + 2H2O(8)
Говоря о взаимодействии с серной кислотой, стоит отметить тот факт, что в растворах с малой концентрацией свинец проявляет себя устойчиво, покрываясь плёнкой PbSO4. Именно на этом свойстве основано применение свинца в свинцовых аккумуляторах, а так же при производстве серной кислоты камерным способом.
Pb + H2SO4 → PbSO4 + SO2↑ + 2H2O (9)
Металл устойчив к действию хлороводородной и фтороводородной кислот из-за образования труднорастворимых галогенидов. Свинец проявляет амфотерные свойства, поэтому может реагировать с горячими щелочами, при условии, что их концентрация превысит 10-15%.
Pb + 2NaOH + 2H2O → Na2[Pb(OH)4] + H2↑ (10)
1.1.5 Применение
Прежде всего свинец используют для изготовления пластин в свинцовых аккумуляторах, оболочек электрических кабелей , в качестве полупроводника. Он способен экранировать излучение, поэтому находит применение в рентгеновских кабинетах, лабораториях, а так же на предприятиях, где существует угроза облучения радиацией. В виде труб и листов находит применение для отделки трубопроводов и другой аппаратуры. Часто является материалом для изготовления анодов, для электролиза меди, цинка и т.д. Известно большое количество сплавов на основе свинца, отличающихся высокой прочностью и устойчивостью к коррозии. На рынке представлен широкий спектр красителей и химикатов [2].
1.2 Оксиды свинца 1.2.1 Оксид свинца(II)
Оксид свинца(II) существует в виде красного α-PbO(глёт) и жёлтого β-PbO (массикот). Устойчивый при обычных условиях Глёт состоит из слоёв, где каждый атом Pb связан с четырьмя атомами О на одинаковом расстоянии. Массикот имеет то же строение, разница заключается лишь в различном межатомном расстоянии. β-PbO устойчив при обычных условиях лишь при наличии добавок. Переход из глёта в массикот осуществляется при температуре выше 488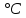 . α-PbO более хуже растворима в воде, нежели β-PbO. . α-PbO более хуже растворима в воде, нежели β-PbO.
Получают PbO окислением расплавленного свинца кислородом либо термическим разложением высших оксидов.
Pb3O4 → 3PbO + 0.5O2 (11)
3PbO2 → Pb3O4 + O2 (12)
PbO → Pb + 0.5O2 (13)
1.2.2 Химические свойства
PbO проявляет амфотерные свойства. Реагирует с кислотами, образуя соответствующие соли.
PbO + 2HCl → PbCl2 + H2O (14)
При взаимодействии с концентрированными растворами щелочей образуются гидроксоплюмбиты.
PbO + 2NaOH → Na2PbO2 + H2O (15)
Окисляется кислородом
6PbO + O2 → 2Pb3O4 . (16)
При действии восстановителем восстанавливается до металлического свинца
PbO + H2 → Pb + H2O . (17)
Применяется в производстве сурика и других соединений свинца, как компонент свинцовых аккумуляторов, для изготовления свинцовых стёкол и глазурей, при производстве олиф.
1.2.3 Оксид свинца (IV)
Оксид свинца (IV) имеет чёрно-коричневую окраску. Так же имеет α и β модификации. Первая 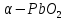 имеет ромбическую структуру, имеет ромбическую структуру, 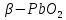 пред-ставлена в виде тетрагональной решётки. Обе модификации в составе всегда имеют воду, так как при высушивании происходит отщипление кислорода и образование низшего и высшего оксидов. пред-ставлена в виде тетрагональной решётки. Обе модификации в составе всегда имеют воду, так как при высушивании происходит отщипление кислорода и образование низшего и высшего оксидов.
Промышленный способ получения диоксида свинца заключается в обработке свинцового сурикa азотной кислотой и последующей промывке и сушке в вакууме. {\displaystyle {\mathsf {Pb_{3}O_{4}+4HNO_{3}\rightarrow PbO_{2}+2Pb(NO_{3})_{2}+2H_{2}O}}}
Pb3O4 + 4HNO3 → PbO2 + 2Pb(NO3)2 + 2H2O (18)
1.2.4 Химические свойства
Диоксид свинца обладает сильными окислительными свойствами. Окисляет хлорид-анион до хлора из концентрированной соляной кислоты при нагревании
PbO2 + 4HCl → PbCl2 + Cl2↑ + 2H2O(19)
В кислой среде окисляет соли марганца(II) до перманганата
5PbO2 + 2MnSO4 + 3H2SO4 → 5PbSO4 + 2HMnO4 + 2H2O (20)
При растирании с серой и фосфором происходит воспламенение. Не растворяется в воде.
Применяется как катализатор и окислитель в химических процессах. Также широко применяется в свинцовых аккумуляторах и гальванических элементах в качестве положительного электрода.
1.2.5 Оксид свинца (II) (IV)
Оксид свинца (II)(IV) носит название свинцовый сурик. По физическим свойствам представляет собой красно- оранжевый порошок, устойчивый при нормальных условиях, нерастворимый в воде. Имеет тетрагональное строение. Существует в виде α и β формы. Переход из более устойчивой β-формы происходит при -90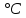 . β-Фаза является полупроводником. Ширина запрещённой зоны 2,1 эВ. Получают прокаливанием мелкодисперстного монооксида свинца(II) . β-Фаза является полупроводником. Ширина запрещённой зоны 2,1 эВ. Получают прокаливанием мелкодисперстного монооксида свинца(II)
6PbO + O2 → 2Pb3O4 . (21)
1.2.6 Химические свойства
При увеличении температуры разлагается с образованием монооксида свинца:
Pb3O4 → 3PbO + 0.5O2 .(22)
Растворяется в азотной кислоте
Pb3O4 + 4HNO3 → PbO2 + 2Pb(NO3)2 + 2H2O . (23)
Применяется как краситель для антикоррозийных красок и в качестве замазки в свинцовых аккумуляторах, используется как наполнитель резиновых изделий и пластиков.
1.3.1 Соединения свинца в степени окисления +2
Для свинца наиболее характерна степень окисления +2. Гидроксид свинца(II) представляет собой белый аморфный порошок, получаемый обменными реакциями в растворах. Заметно явное преобладание основных свойств, легко дегидратируется, образуя при различных условиях либо α-, либо β-PbO. Установлено, что соединение находится в виде гидрата PbO*H2O. Его растворением получают тригидроксоплюмбиты, существование которых в данный момент оспаривается. Гидроксоплюмбаты устойчивы только в растворах при избытке щелочи.
Соли свинца(II) бесцветны за исключением желтых иодида PbI2 и хромата PbCrO4. Все соли токсичны. Хорошо растворимы нитрат Pb(NO3)2, ацетат Pb(CH3COO)2·3Н2О, хлорат Pb(ClO3)2·Н2О и перхлорат свинца Pb(ClO4)2·3Н2О. В растворах соли заметно гидролизуются. Большинство солей малорастворимы. Практическое применение находят хромат и основной карбонат в качестве неорганических пигментов при производстве красок.
1.3.2 Соединения свинца в степени окисления +4
Все соединения свинца(IV) сильные окислители. Гидроксид свинца(IV) находится в виде гидрата PbO2*2H2O. Хлорид свинца(IV) является кислотой Льюиса:
PbCl4 + 2HCl = H2[PbCl6] . (24)
Cоли свинца(IV) – сульфат Pb(SO4)2 и ацетат Pb(CH3COO)4 - разлагаются водой и являются сильными окислителями. Сульфат представляет собой светло-желтый порошок, который получают при продолжительном нагревании фторида свинца(IV) с серной кислотой. Из галогенидов свинца(IV) известны только фторид и хлорид. PbF4 имеет кристаллическую слоистую решетку и, в отличие от хлорида, устойчив. PbCl4 представляет собой маслянистую жидкость желтого цвета, крайне неустойчив.
1.4 Комплексные соединения свинца с органическими соединениями
С органическими соединениями свинец способен образовывать комплексные соединения. С органическими лигандами в большинстве случаев образуются более устойчивые комплексы. В качестве реагентов на свинец чаще применяют азот- и серосодержащие реагенты.
Одним из частоиспользуемых является дитизон, или 1,5 дифенилтиокарбазон, представляющий собой чёрно-фиолетовый порошок, практически нерастворимый в воде. С щёлочью образует растворимые дитиозонаты. Растворим в тетрахлорметане и хлороформе. Неустойчив к действию света и многих реагентов. Со свинцом образует более устойчивый дитиозонат свинца.
Вторым, не менее важным реагентом, является диэтилдитиокарбаминовая кислота и её соли, дитиокарбаматы. Образуются комплексы в соотношении 1:2. Применяется для отделения Pb от мещающих его определению элементов. Питьевая вода в смеси с тетраметилендитиокарбамата аммония в метилизобутилкетоне даёт экстракт, вводимый в электротермический анализатор. Раствор вне контакта с водой устойчив около 30 дней, однако, при добавлении воды он даже при медленном помешивании разрушается через 105 часов, а с ацетатным буфером быстрее. При действии на хелаты Pb света и окислителей они разлагаются.
Реагент 8-оксихинолин представляет собой светло-жёлтые кристаллы, которые под действием света так же разлагаются и требуют ранения в темноте. Они хорошо растворимые в хлороформе и других органических соединениях , но очень плохо в воде. 8-Оксихинолин образует хелаты с 37 элементами, в том числе труднорастворимый со свинцом состава 1:2, который осаждается уже при рН 8,4-12,3 и экстрагируется хлороформом.
Купферон (или N-нитрозофенилгидроксиламин) предствлен в виде белых кристаллов, хорошо растворимых в воде и этаноле, но плохо в спирте. В присут-ствии минеральных кислот происходит их разложение. Образует хелаты с 58 элементами. Купферонат свинца мало растворим в хлороформе, именно это используют в методах экстракционного отделения свинца, регулируя уровень рН.
Более устойчивые комплексы получаются при взаимодействии свинца с аминополикарбоновыми кислотами. ЭДТА является наиболее важным реагентом в титриметрическом анализе веществ, содержащих свинец, с индикацией КТТ различными методами. Данная реакция сопровождается образованием H+ , поэтому титруют обычно в присутствии буферной смеси. В щелочной области роль комплексообразователя играют тартрат-ионы, которые вводятся в раствор .
Аминокислоты можно рассматривать в качестве модельных лигандов при оценке и прогнозировании взаимодействий «металл-белок» [3].
1.5.1 Аминокислоты
Аминокислотами называют органические соединения, в молекулах которых одновременно присутствуют основные аминогруппы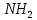 — и кислотные карбоксильные групп —СООН. Аминокислоты входят в состав природных полимеров- белков. На сегодняшний день известно более 70 аминокислот, которые в зависимости от выполняемой ими роли в организме живых существ подразделяют на заменимые и незаменимые. Незаменимыми называют те, которые организм не в состоянии синтезировать в необходимых для нормального функционирования количествах из пищи, употребляемой человеком. К заменимым относят аминокислоты, присутствие которых в пище не обязательно для нормального развития организма, так как они могут синтезироваться из других аминокислот или небелковых. Такие аминокислоты, как валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин является незаменимыми почти для всех видов живых организмов, поэтому широко используются в медицине. — и кислотные карбоксильные групп —СООН. Аминокислоты входят в состав природных полимеров- белков. На сегодняшний день известно более 70 аминокислот, которые в зависимости от выполняемой ими роли в организме живых существ подразделяют на заменимые и незаменимые. Незаменимыми называют те, которые организм не в состоянии синтезировать в необходимых для нормального функционирования количествах из пищи, употребляемой человеком. К заменимым относят аминокислоты, присутствие которых в пище не обязательно для нормального развития организма, так как они могут синтезироваться из других аминокислот или небелковых. Такие аминокислоты, как валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин является незаменимыми почти для всех видов живых организмов, поэтому широко используются в медицине.
1.5.2 Номенклатура и строение аминокислот
Названия аминокислот произошли в основном о исходных материалов, из которых они впервые были выделены; например, аспарагин (о лат. asparagus — спаржа), цистеин и цистин (о греч. cystis — мочевой пузырь) — из камней мочевого пузыря,. Другие названия связаны с методами их выделения. Так, аргинин бы впервые получен в виде серебряной соли,cтруктурные связи с другим природным соединения также внесли вклад в названия некоторых аминокислот. Так, валин назван как производное валериановой кислоты. Большинство аминокислот имеют окончание -ин, что указывает наличие у них аминогруппы. Для удобства написания пептидных фрагментов пользуются сокращенными названиями аминокислотных остатков, которые состоят из первых трех букв тривиального названия аминокислоты, например Ala для L-аланина. У гидроксиаминокислот после первых двух букв пишется Ну от латинского слов hydro следует первая буква названия аминокислоты, например для гидроксилизина — HyI.
У аминокислот существует изомерия, связанная главным образом с расположением функциональных групп и со строением углеводородного скелета.
По радикалу:
Неполярные: глицин, аланин
Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин,
Ароматические: фенилаланин, триптофан, тирозин
Полярные заряженные отрицательно при pH=7: аспартат, глутамат
Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин
По функциональным группам:
Алифатические
Моноаминомонокарбоновые: глицин, аланин, валин
Оксимоноаминокарбоновые: серин, треонин
Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
Амиды моноаминодикарбоновых: аспарагин, глутамин
Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
Серосодержащие: цистеин, метионин
Ароматические: фенилаланин, тирозин, триптофан,
Гетероциклические: триптофан, гистидин, пролин
Иминокислоты: пролин
Согласно положению функциональных групп выделяют: 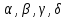 кислоты. кислоты.
Молекула аминокислоты может содержать одну или несколько карбоксильных групп и в соответствии с этим аминокислоты различаются по основности. Также в молекуле аминокислоты может находиться разное количество аминогрупп.
В соответствии со своей амфотерной природой молекулы аминокислот в зависимости от кислотности среды могут иметь разную ионную форму: в кислых растворах они представляют собой положительно заряженные ионы, в щелочных растворах отрицательно заряженные ионы , в нейтральных растворах – цвиттер-ионы. В кристаллическом состоянии молекулы аминокислот обычно имеют цвиттер- ионную форму. Кристаллические аминокислоты будучи полярными соединениями, легко растворимы в воде и почти нерастворимы в спирте и других органических растворителях.
Во всех аминокислотах, кроме глицина, атом углерода имеет четыре разных заместителя, являясь асимметрическим. Благодаря этому все аминокислоты могут существовать в виде оптически активных (L и D) формах. В живой природе осуществляется полное разделение стереоизомеров аминокислот. Все белки состоят из аминокислот L-конформации. D-аминокислоты встречаются в основном в составе оболочек некоторых бактерий и в составе антибиотиков, т.е ядов синтезируемых клетками для борьбы с другими микроорганизмами.
1.5.3 Химические свойства аминокислот
Кислотно-основные свойства аминокислот зависят от рН среды. В области pH 4 — 9 все аминокислоты выступают в качестве доноров протонов. По физическим свойствам они отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, их растворимость в воде выше, чем в органических растворителях, имеют достаточно высокие температуры плавления. Вследствие этого аминокислоты могут реагировать как с кислотами, так и с щелочами.
NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (25)
NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (26)
Вступают во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (27)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов.
Реакция образования пептидов:
HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O . (28)
1.5.4 Получение аминокислот
Один из способов заключается в гидролизе белков, однако разделить получившуюся смесь кислот крайне сложно. Как правило, пара кислот получаются в больших количествах. Их легко выделить с помощью ионообменных смол.
Так же получить аминокислоту можно из галогензамещёных кислот. Один из наиболее распространенных методов синтеза a -аминокислот заключается в аммонолизе a -галогензамещенной кислоты, полученной по реакции Геля-Фольгарда-Зелинского. Этот метод можно модифицировать, получая a-бромзамещенную кислоту через малоновый эфир.
Синтез Штреккера позволяет получить аминокислоту из карбонильных соединений путём их реакции с хлоридом аммония и цианистого натрия. Реакции присоединения — отщепления с участием аммиака и карбонильного соединения дают имин, который реагирует с цианистым водородом, образуя a-аминонитрил. В результате его гидролиза образуется a-аминокислота [5].
1.5.5 Цистеин
Цистеин (2-амино-3-меркаптопропановая кислота; -амино-β- тиопропионовая кислота) – алифатическая серосодержащая аминокислота.
Оптически активна, существует в виде L- и D- изомеров (рисунок 1)
 Рисунок 1 – D- ; L- Цистеин Рисунок 1 – D- ; L- Цистеин
L-Цистеин входит в состав белков и пептидов, играя важную роль в процессах формирования тканей кожи. Имеет значение для дезинтоксикационных процессов. Впервые выделен в виде цистина К. Мѐрнером в 1899 из рога. Цистеин можно отнести к условно заменимым -аминокислотам, потому что для её синтеза необходим атом серы, источником которого служит незаменимая аминокислота метионин либо серин, а также же АТФ и витамин В6. Получение цистеина из гомоцистеина подробно описан Сыровой А.О, которая говорит о том, что синтез происходит в 2 стадии под действием пиридоксальзависимых ферментов цистатионинсинтазы и цистатионинлиазы. Биосинтез цистеина начинается с аминокислоты серина. Сера является производным метионина, который превращается в гомоцистеин через промежуточное вещество S-аденозилметионин (SAM) и Sаденозилгомоцистеин (SАГ). Затем, под действием фермента цистатионин -синтазы гомоцистеин и серин объединяются, образуя асимметричный тиоэфирный цистатионин. Фермент цистатионин -лиаза преобразует цистатионин в цистеин и -кетобутират [6].
Цистеин является важным источником сульфида в метаболизме человека. Кластеры сульфида железа и серы в нитрогеназе извлекаются из цистеина, который в ходе этого процесса преобразуется в аланин. Цистеин входит в состав альфа-кератина, основного белка ногтей, кожи и волос. Он способствует формированию коллагена и улучшает эластичность и текстуру кожи. Цистеин растворяется лучше, чем цистин, и быстрее выводится из организма, поэтому его чаще используют в комплексном лечении различных заболеваний. Ещѐ одним важным путѐм использования цистеина можно считать синтез таурина в животных тканях, который происходит путѐм декарбоксилирования производных цистеина – цистеиновой и цистеинсульфиновой кислот. При отстутствии заболеваний, цистеин может быть синтезирован в организме человека. Он содержится в большинстве продуктов с высоким содержанием белка, например свинине, курице, твороге.
Молекулярная масса цистеина составляет 121,16 а.е.м. L-Цистеин представляет из себя бесцветные кристаллы, температура плавления которых составляет 178 °С, легко растворима в воде. При н.у. рКа = 1,71 (СООН), 8,33 (NH2), 10,78 (SH). В щелочной среде аминокислота неустойчива и разлагается на H2S, NH3 и пировиноградную кислоту. Окисляется на воздухе, образуя цистин, дает комплексы с ионами многих металлов. При окислении цистеина может также образовываться цистеиновая кислота HO3SCH2CH(NH2)COOH. Васина Я. А утверждает, что цистеин легко ацилируется и алкилируется по группе SH, но S-ацильные производные неустойчивы, особенно в щелочной среде, и претерпевают S,N-ацильную перегруппировку. В синтезе пептидов, содержащих цистеин, для защиты его меркаптогруппы применяют ацетамидометильную, трет- бутильную, третбутилтионильную группы, а также различные замещенные бензильной группы [7]. Цистеин дает характерную реакцию с водным FeCl3, в результате которой образуется соединение голубого цвета. С реактивом Эллмана образуется соединение, обладающее при рН = 8 сильным УФ поглощением (=412 нм). Количественно цистеин определяют колориметрическим методом или потенциометрическим титрованием с помощью AgNO3 или HgCl2. Характерная особенность цистеина – его способность подвергаться в составе молекулы белка самопроизвольному окислению с образованием остатков цистина. Цистеин может быть получен восстановлением цистина, взаимодействием фталимидомалонового эфира с хлорметил (бензил) сульфидом (с последующим гидролизом и восстановлением) и др. В промышленности L-цистеин получают в основном с помощью гидролиза птичьих перьев или человеческого волоса. L-цистеин получают путем гидролиза рацемического 2-амино-дельта-2-тиазолин-4-карбоновой кислоты.
1.5.7 Применение цистеина
Цистеин является исходным сырьем в пищевой, фармацевтической и медицинской промышленности. Используется для создания запахов, например, в результате взаимодействия цистеина с сахаром в ходе реакции Майяра можно ощутить ярко выраженный запах мяса. В качестве пищевой добавки цистеин обозначается как Е920. Цистеин используется как средство для перманентной завивки волос, так как он способен разрушать дисульфидные связи кератина волос. Цистеин очень широко используется в исследованиях структуры и динамики биомолекул.
Глава 2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Приборы и реактивы
Pb(NO3)2, (х.ч.);
аминокислота L-цистеин, (ч.д.а.);
Нингидрин(х.ч.);
NaOH ,(х.ч.);
Этилендиаминтетрауксусная кислота (ЭДТА), (х.ч.);
Индикатор ПАР, (х.ч.);
Уротропин, (х.ч.);
HNO3, (х.ч.).
Весы марки ВЛР 200;
Бюретка без крана с зажимом;
Штатив лабораторный;
Лабораторные стаканы на 50 мл;
Пипетка Мора;
Колбы Эрленмейера на 100 мл;
Универсальная индикаторная бумага (УИБ).
2.2 Получение Pb(L-HCys)2
Расчёты вели, исходя из цели синтезировать 1 грамм вещества. 1,06 г L-цистеина растворили в 10,6 мл воды и медленно при перемешивании добавили 0,73 г сухого 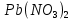 в мольном соотношении L:М= 2:1, рН раствора составляла 4. Затем 1М раствором NaOH довели рН до 7. В результате реакции выпал светло-жёлтый осадок, который был отфильтрован и высушен на воздухе при комнатной температуре до постоянной массы. Результаты итогового взвешивания, представленные в таблице 1, показали, что выход в среднем составил 65,1%. в мольном соотношении L:М= 2:1, рН раствора составляла 4. Затем 1М раствором NaOH довели рН до 7. В результате реакции выпал светло-жёлтый осадок, который был отфильтрован и высушен на воздухе при комнатной температуре до постоянной массы. Результаты итогового взвешивания, представленные в таблице 1, показали, что выход в среднем составил 65,1%.
Pb(NO3)2 + 2L- H2Cys → Pb(L-HCys)2 + 2HNO3
331 г/моль 242,32 г/моль 447,32 г/моль
ν Pb(L-HCys)2 = 1/447.32 =2.2*10-3 моль.
m(Pb(NO3)2 ) =2.2*10-3 * 331 ≈0,73 г.
m(L- H2Cys ) =4.4*10-3 *242,32 ≈1,06 г.
Объём воды, необходимой для растворения кислоты:
0,5 г→5 мл,
1,06 г → x мл. х = (1,06 * 5) /0,5 = 10,6 мл.
Таблица 1 - Масса полученного осадка
Номер навески
|
1
|
2
|
3
|
Общая масса по всем параллелям
|
Конечная масса сухого продукта, г.
|
0,626
|
0,869
|
0,459
|
1,954
|
Находим выход по всем трём параллелям:
W= (mпрактическая * 100%)/ mтеоретическая (28)
W1= (0.626*100%)/1 = 62.6%,
W2= (0.869 *100%)/1=86.9%,
W3= (0.459 *100%)/1=45.9%,
Wобщ = (1,954 *100%)/3 = 65,1%.
2.3 Анализ на содержание аминокислоты
Для определения наличия в составе синтезированного соединения аминокислоты 0,5 грамм сухого осадка растворяли в 10 мл воды, добавляли лопаточку нингидрина и пару капель 1 М раствора NaOH. Нагревали полученную смесь на плитке до появления характерной тёмно-синей окраски.
2.4 Количественное определение содержания свинца(II)
Навеску 0,05г сухого осадка растворили в 10 мл воды с добавлением пары капель 1М HNO3 до его полного растворения. УИБ измерили рН раствора, затем при помощи уротропина доводили его до 5-9. Добавили к анализируемому раствору индикатор ПАР, который окрасил раствор в красный цвет. Титровали 0,01 М раствором ЭДТА до изменения окраски раствора до оранжевой от одной капли. Исходя из объёма титранта, ушедшего на титрование, находили процентное содержание в соединении свинца. Данные о среднем значении израсходованного на титрование объёме ЭДТА и прочие расчёты приведены в таблице 2.
Таблица 2 - Объём ЭДТА, ушедший на титрование
Номер навески
|
Объём ЭДТА, ушедший на титрование, мл
|
1
|
2,40
|
2
|
2,25
|
3
|
2,50
|
Для нахождения процентного содержания Pb2+ необходимо найти его массу в каждом образце. Находили массу через молярную концентрацию, предварительно рассчитанyю по формуле:
С1V1 = C2V2 , (29)
C1 и V1 - значения для раствора ЭДТА.
C1 = (0.01*2.40)/10=0.0024 Mоль ,
C2 = (0.01*2.25)/10=0.0026 Mоль ,
C3 = (0.01*2.50)/10=0.0025 Mоль .
m= (CPb*MPb)/n, где n- во сколько раз разбавили синтезированный раствор.
m1= (207*0.0024)/20= 0.0248 г.
m2= (207*0.0026)/20= 0.0269 г.
m3= (207*0.0025)/20= 0.0258 г.
W = (mPb *100%) / mосадка . (30)
W1 = (0.0248*100%)/0.050 = 56.8% ,
W2 = (0.0269*100%)/0.050 = 53.8% ,
W3 = (0.0258*100%)/0.050 = 51.6% ,
Wсреднее= (56.8%+53.8%+51.6%)/3=54.1% .
Wтеор = (MPb *100%)/Mобщ . (31)
Wтеор = (207 * 100%) /447,32=46,3% .
ВЫВОДЫ
Синтезировано комплексное соединение состава Pb(L-HCys)2.
Средний выход комплексного соединения составил 65,1%, что является высоким выходом.
Нингидриновой реакцией доказано наличие в соединении аминокислоты.
Количественно определено процентное содержание в синтезированном веществе Pb2+, оно составляло в среднем 54.1%.
Различие практического и теоретического содержания в пробах иона Pb2+ может быть связано с неточностью измерений. Так же ошибка может заключаться в процессе синтеза соединения Pb (II) с аминокислотой L-цистеином
СПИСОК ЛИТЕРАТУРЫ
Полянский, Н. Г. Аналитическая химия элементов. Свинец / Н. Г. Полянский. – М. : Наука , 1986. – 357 с.
Гаркушин, И. К. Неорганическая химия для технических и технологических вузов. Ч.1 / И. К. Гаркушин, О. В. Лаврентьева, Н. И. Лисов, С. Н.Парфенова, И. Б. Костылева, В. И. Пенина, О.Ю. Калмыкова. - Самара: Самар. гос. техн. ун-т, 2013. – 343с.
Новикова, Г. В. Синтез и физико-химические характеристики комплексов бэ2- и ПсР- ионов металлов с аминоксилотами : Автореф. дисс … канд. хим. наук: 02. 00. 01 / Новикова Г. В. – Красноярск, 2006. -133 с.
Якубке, Х.Д. Аминокислоты, пептиды, белки / Х.Д. Якубке, Х.Ешкайт. – М. : Мир, 1985. – 82 с.
Сыровая, А.О. Аминокислоты глазами химиков, фармацевтов, биологов : в 4-х т. Т. 1 / А. О. Сыровая, Л. Г. Шаповал, В. А. Макаров, В. Н. Петюнина, Е. Р. Грабовецкая, С. В. Андреева , С. А. Наконечная, Р. О. Бачинский, Л. В. Лукьянова, С. Н. Козуб, О. Л. Левашова. - Харьков. Щедра садиба плюс, 2014. – 228 с.
Васина, Я. А. Исследование скорости и механизма твёрдофазного термического превращения L-х-аминокислот с карбоксильными, серу- и азотсодержащими заместителями : Автореф. дис ... канд. хим. наук : 02. 00. 04/ Я. А. Васина. – Н. Новгород, 2013. - 21c.
|
|
|
 Скачать 352.62 Kb.
Скачать 352.62 Kb.
 СОДЕРЖАНИЕ
СОДЕРЖАНИЕ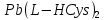 ……..………….…………………………….....22
……..………….…………………………….....22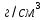 . Температура плавления 327,5
. Температура плавления 327,5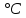 , температура кипения 1740
, температура кипения 1740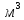
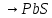 (4)
(4)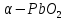 имеет ромбическую структуру,
имеет ромбическую структуру, 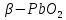 пред-ставлена в виде тетрагональной решётки. Обе модификации в составе всегда имеют воду, так как при высушивании происходит отщипление кислорода и образование низшего и высшего оксидов.
пред-ставлена в виде тетрагональной решётки. Обе модификации в составе всегда имеют воду, так как при высушивании происходит отщипление кислорода и образование низшего и высшего оксидов. 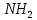 — и кислотные карбоксильные групп —СООН. Аминокислоты входят в состав природных полимеров- белков. На сегодняшний день известно более 70 аминокислот, которые в зависимости от выполняемой ими роли в организме живых существ подразделяют на заменимые и незаменимые. Незаменимыми называют те, которые организм не в состоянии синтезировать в необходимых для нормального функционирования количествах из пищи, употребляемой человеком. К заменимым относят аминокислоты, присутствие которых в пище не обязательно для нормального развития организма, так как они могут синтезироваться из других аминокислот или небелковых. Такие аминокислоты, как валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин является
— и кислотные карбоксильные групп —СООН. Аминокислоты входят в состав природных полимеров- белков. На сегодняшний день известно более 70 аминокислот, которые в зависимости от выполняемой ими роли в организме живых существ подразделяют на заменимые и незаменимые. Незаменимыми называют те, которые организм не в состоянии синтезировать в необходимых для нормального функционирования количествах из пищи, употребляемой человеком. К заменимым относят аминокислоты, присутствие которых в пище не обязательно для нормального развития организма, так как они могут синтезироваться из других аминокислот или небелковых. Такие аминокислоты, как валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин является 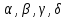 кислоты.
кислоты. Рисунок 1 – D- ; L- Цистеин
Рисунок 1 – D- ; L- Цистеин 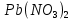 в мольном соотношении L:М= 2:1, рН раствора составляла 4. Затем 1М раствором NaOH довели рН до 7. В результате реакции выпал светло-жёлтый осадок, который был отфильтрован и высушен на воздухе при комнатной температуре до постоянной массы. Результаты итогового взвешивания, представленные в таблице 1, показали, что выход в среднем составил 65,1%.
в мольном соотношении L:М= 2:1, рН раствора составляла 4. Затем 1М раствором NaOH довели рН до 7. В результате реакции выпал светло-жёлтый осадок, который был отфильтрован и высушен на воздухе при комнатной температуре до постоянной массы. Результаты итогового взвешивания, представленные в таблице 1, показали, что выход в среднем составил 65,1%.