Лекция (9). Ядерная модель атома в 1911 г. Эрнест Резерфорд предложил ядерную модель атома
 Скачать 200.44 Kb. Скачать 200.44 Kb.
|
|
Ядерная модель атома В 1911 г. Эрнест Резерфорд предложил ядерную модель атома.  Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома (99,96%). Диаметр ядра не превышает 10-14 - 10-15 м. Атом в целом нейтрален. Вокруг ядра по замкнутым орбитам вращаются под действием кулоновских сил притяжения со стороны ядра электроны. Находиться в состоянии покоя электроны не могут. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. То есть q = +Ze = -Ze, где Z - порядковый номер элемента в таблице Менделеева, e - элементарный заряд. Опыт Резерфорда. Пучок положительно заряженных альфа-частиц, излучаемые радиоактивными элементами, направлялся на сверхтонкую золотую фольгу толщиной около 400 нм. Частицы, прошедшие через фольгу, регистрировались на экране при помощи микроскопа. Многочисленные опыты показали, что очень редкие а-частицы отклонялись на значительный угол (900 и 1800). Как писал сам Эрнест Резерфорд (1871 - 1937): "Это было почти столь же неправдоподобным, как если бы вы выстрелили в лист папиросной бумаги 15-дюймовым снарядом, а он вернулся бы назад и угодил в вас". Что бы это могло значить? То, что внутри атома имеется очень сильное электрическое поле, которое создается положительным зарядом, сконцентрированном в очень малом объеме. Название "ядро" было предложено Резерфордом. В ядре сосредоточена также вся масса атома. Постулаты Бора Ядерная модель атома не могла объяснить следующие противоречия: при движении электрона по орбите он должен излучать электромагнитные волны, вследствие этого терять энергию и через 10-13 с прекратить свое существование. Спектр излучения атома должен быть непрерывным, а не линейчатым. Нильс Хендрик Давид Бор (1885 - 1962) в 1913 г. предложил квантовую модель атома, в основе которой лежат следующие постулаты. I постулат Бора (постулат стационарных состояний): электрон в атоме может находиться только в особых (квантовых) состояниях, каждому из которых соответствует определенная энергия. Когда электрон находится в стационарном состоянии, вращаясь по орбите, он не излучает (рисунок 1) 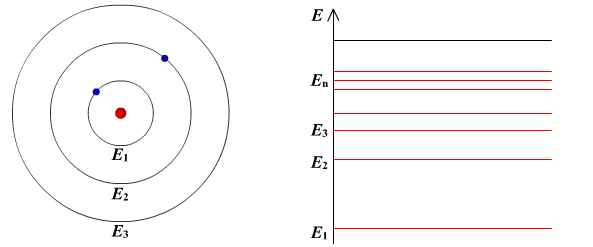  Рисунок 1 Постулат стационарных состояний Стационарные состояния можно пронумеровать, каждое состояние обладает своей фиксированной энергией. II постулат Бора (правило частот): при переходе атома из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергий электрона в данных состояниях (рисунок 2). 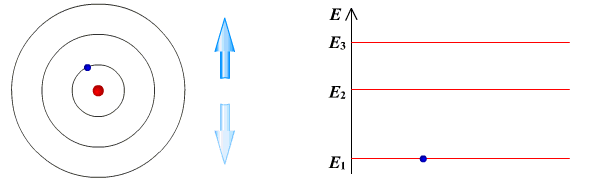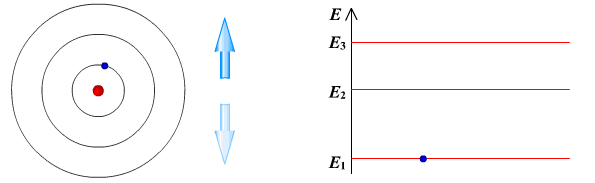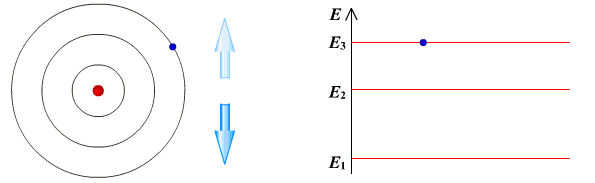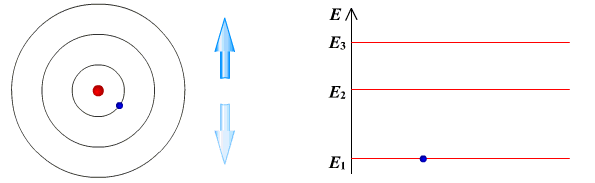 Рисунок 2 Правило частот  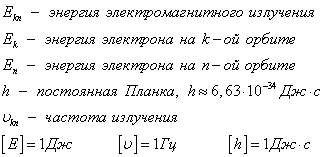 Если Еk>Еn, то происходит излучение энергии, если Еk<Еn - ее поглощение. II постулат Бора позволил объяснить линейчатую структуру атомных спектров. III постулат Бора (правило квантования орбит): стационарные электронные орбиты находятся из условия 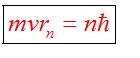  Состояние атома, которому соответствует наименьшая энергия, называется основным, а состояния с большей энергией - возбужденными. В основном состоянии электрон может находиться неограниченно долго, а в остальных состояниях не более 10-8 с. |
