физическая химия задачи. Задача 1 Вычислить тепловые эффекты химических реакций при стандартных условиях по стандартным теплотам образования. Ch
 Скачать 40.24 Kb. Скачать 40.24 Kb.
|
|
Вариант 23. Задача 1 Вычислить тепловые эффекты химических реакций при стандартных условиях по стандартным теплотам образования. CH3OH (г) + CO (г) = CH3COOH (г) ΔНf0 (CH3OH) = - 201,00 кДж/моль ΔНf 0(CO) = -110,53 кДж/моль ΔНf0 (CH3COOH) = - 434,84 кДж/моль ΔНr0 = Σn·ΔНfпрод - Σn·ΔНfисх = ΔНf0(CH3COOH) - (ΔНf0(CH3OH)+ΔНf0 (CO)) = = - 434,84 + 201,00 + 110,53 = - 123,31 кДж/моль Задача 2. Вычислить тепловые эффекты химических реакций в растворах при 250С по стандартным теплотам образования химических соединений и ионов. 2NO2 (г) + 2NaOH aq = NaNO3 aq + NaNO2 aq + H2O (ж) 2NO2 (г) + 2Na+ + 2OH- aq = Na+ + NO3- aq + Na+ + NO2- aq + H2O (ж) 2NO2 (г) + 2OH- aq = NO3- aq + NO2- aq + H2O (ж) ΔНf0 (NO2) = 34,19 кДж/моль ΔНf 0(OH-) = - 229,94 кДж/моль ΔНf 0(NO3-) = - 206,57 кДж/моль ΔНf0 (NO2-) = - 106,30 кДж/моль ΔНf 0(H2O) = - 285,83 кДж/моль ΔНr0 = Σn·ΔНfпрод - Σn·ΔНfисх = = ΔНf0 (NO3-) + ΔНf0 (NO2-) + ΔНf0(H2O) - (2·ΔНf0(NO2) + 2·ΔНf0 (OH-)) = = - 206,57 - 106,30 - 285,83 - 68,38 + 459,88 = - 207,2 кДж/моль Задача 3. Вычислить стандартные изменения энергии Гиббса химической реакции при 250С по стандартным значениям энтальпий образования и абсолютных энтропий, воспользовавшись таблицами стандартных величин. Все реакции проводятся между чистыми твердыми, жидкими и газообразными веществами (не в растворе). H2S (г) + CO2 (г) = H2O (г) + COS (г) ΔНf0 (H2S) = - 20,6 кДж/моль ΔНf 0(CO2) = - 393,51 кДж/моль ΔНf0 (H2O) = - 241,81 кДж/моль ΔНf 0(COS) = - 141,7 кДж/моль ΔНr0 = Σn·ΔНfпрод - Σn·ΔНfисх = = ΔНf 0(H2O) + ΔНf 0(COS) - (ΔНf0(H2S) + ΔНf0(CO2)) = = - 241,81 - 141,7 + 20,6 + 393,51 = 30,6 кДж/моль S0 (H2S) = 205,7 кДж/моль S0 (CO2) = 213,66 кДж/моль S0 (H2O) = 188,72 кДж/моль S0(COS) = 231,53 кДж/моль ΔSr0 = Σn· S0прод - Σn· S0исх = S 0(H2O) + S0(COS) - (S0(H2S) + S0(CO2)) = = 188,72 + 231,53 - 205,7 - 213,66 = 0,89 Дж/моль·К = 0,00089 кДж/моль·К ΔGr = ΔНr0 - T·ΔSr0 = 30,6 - 298·0,00089 = 30,33 кДж/моль Задача 4. Выразить концентрацию водного раствора через массовые проценты, молярность, моляльность, молярность и нормальность Вещество - AlCl3 N2 = 0,083 ρ = 1,341 г/мл t = 150C N2 = 0,083 = 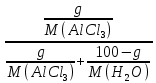 = = 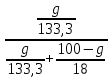 = = 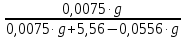 0,0006225·g + 0,46148 - 0,004615·g = 0,0075·g 0,46148 = 0,01149·g g = 40,15% С = 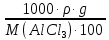 = = 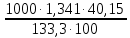 = 4,04 моль/л = 4,04 моль/лN = 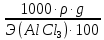 = = 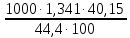 = 12,12 г-экв/л = 12,12 г-экв/лm = 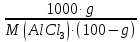 = = 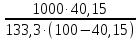 = 5,03 моль/кг = 5,03 моль/кгЗадача 5. По значениям констант скоростей при двух температурах определить энергию активации, предэкспоненциальный множитель, константу скорости при температуре Т3, температурный коэффициент скорости реакции. 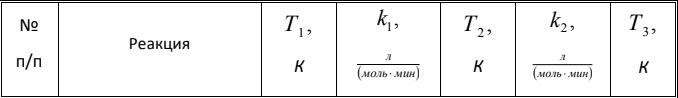  1) Еа = 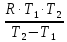 · ln · ln 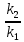 = = 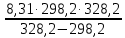 · ln · ln 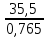 = 104031 Дж/моль = 104031 Дж/моль2) k0 = kT1· 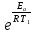 = 0,765· = 0,765·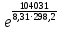 = 1,31·1018 л/моль·мин = 1,31·1018 л/моль·минk0 = kT2· 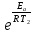 = 35,5· = 35,5·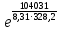 = 1,31·1018 л/моль·мин = 1,31·1018 л/моль·мин3) ln 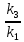 = = 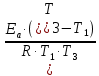 = = 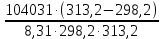 = 2,011 = 2,011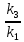 = е2,011 = 7,47 = е2,011 = 7,47k3 = 7,47·k1 = 7,47·0,765 = 5,71 л/моль·мин 4) 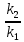 = = 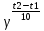 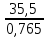 = = 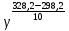 46,41 = γ3 γ = 3,6 |
