Практическое занятие 2. Прак.занят №2. Задача Масса 200 мл ацетилена при нормальных условиях равна 0,232г. Определить мольную массу ацетилена. Решение
 Скачать 36.92 Kb. Скачать 36.92 Kb.
|
|
Тема №2: Определение молекулярных масс веществ в газообразном состоянии Количество часов: 2 Основные вопросы темы: 1. Определение молекулярной массы по уравнению Клайперона-Менделеева. 2. Определение молекулярной массы газа по мольному объему. 3. Решение задач и упражений Определение молекулярных (мольных) масс веществ в газообразном состоянии Задача 1. Масса 200 мл ацетилена при нормальных условиях равна 0,232г. Определить мольную массу ацетилена. Решение: 1 моль любого газа при нормальных условиях (Т = 00С и Р = 101,325кПа) занимает объём равный 22,4л. Зная массу и объём ацетилена при нормальных условиях рассчитаем мольную массу его, составив пропорцию: 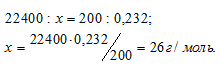 Ответ: Задача 2. Вычислить мольную массу газа, если масса 600 мл его при нормальных условиях равна 1,714г. Решение: 1 моль любого газа при нормальных условиях (Т = 00С и Р = 101,325 кПа) занимает объём равный 22,4л. Зная массу и объём ацетилена при нормальных условиях рассчитаем мольную массу его, составив пропорцию: Ответ: Задача 3. Масса 0,001м3 газа (0°С, 101,33 кПа) равна 1,25г. Вычислить: а) мольную массу газа; б) массу одной молекулы газа. Решение: а) Выразив данные задачи в системе единиц СИ (Р = 10,133 . 104Па; V = 10 . 104м3; m = 1,25 . 10-3кг; Т = 273К) и подставив их в уравнение Клапейрона- Менделеева (уравнение состояния идеального газа), находим мольную массу газа: Здесь R – универсальная газовая постоянная, равная 8,314Дж/(моль . К); Т – температура газа, К; Р – давление газа, Па; V – объём газа, м3; М – мольная масса газа, г/моль. Отсюда б) 1 моль любого вещества содержит 6,02 . 1023 частиц (атомов, молекул), тогда масса од-ной молекулы рассчитывается из соотношения: Ответ: М = 28г/моль; m = 4,65 .10-23г. Задача 4. Масса 0,001м3 газа при нормальных условиях равна 0,0021кг. Определить мольную массу газа и его плотность по воздуху. Решение: 1 моль любого газа при нормальных условиях (Т = 00С и Р = 101,325кПа) занимает объём равный 22,4л. Зная массу и объём газа при нормальных условиях рассчитаем мольную массу его, составив пропорцию:  Плотность газа по воздуху равна отношению мольной массы данного газа к мольной массе воздуха: Здесь - плотность газа по воздуху; - мольная масса газа; - мольная масса воздуха (29г/моль). Тогда Ответ: Задача 5. Плотность этилена по кислороду равна 0,875. Определить молекулярную массу газа. Решение: Из закона Авогадро следует, что при одном и том давлении и одинаковых температуре массы равных объёмов газов относятся как их молекулярные массы: где m1/m2 - относительная плотность первого газа по второму, обозначаемая D. Следовательно, по условию задачи: Мольная масса кислорода равна 32г/моль. Тогда Ответ: Задача 6. Масса 0,001м3 некоторого газа при нормальных условиях равна 0,00152кг, а масса 0,001м3 азота составляет 0,00125кг. Вычислить молекулярную массу газа, исходя: а) из его плотности относительно азота; б) из мольного объема. Решение: Из закона Авогадро следует, что при одном и том давлении и одинаковых температуре массы равных объёмов газов относятся как их молекулярные массы: где m1/m2 - относительная плотность первого газа по второму, обозначаемая D. Следовательно, по условию задачи: Мольная масса азота равна 28г/моль. Тогда б) 1 моль любого газа при нормальных условиях (Т = 00С и Р = 101,325кПа) занимает объём равный 22,4л. Зная массу и объём газа при нормальных условиях рассчитаем мольную массу его, составив пропорцию:  Ответ: М(Газа) = 34 г/моль. |
