Лекция 1_ФХ. Закон термодинамики, его приложение к термодинамическим процессам
 Скачать 189 Kb. Скачать 189 Kb.
|
|
Лекция 1 Предмет физической химии. Химическая термодинамика. Основные понятия и определения. Первый закон термодинамики, его приложение к термодинамическим процессам. Предмет физической химии Химические реакции связаны с разнообразными физическими явлениями: выделением или поглощением теплоты, изменением объема, испусканием света, электрическими явлениями и т.д. В химических реакциях всегда осуществляется тесная связь физических и химических явлений, изучение этой взаимосвязи – основная задача физической химии. Физическая химия – это наука, объясняющая химические явления и устанавливающая их закономерности на основе общих принципов физики (Большой энциклопедический словарь). Главное внимание в физической химии уделяется установлению закономерностей протекания химических процессов: возможности их осуществления, направления, механизма, скорости и конечных результатов при различных условиях. Установление таких закономерностей в конечном итоге позволяет прогнозировать ход химического процесса и управлять им, т.е. обеспечивать наиболее полное и быстрое его проведение. Пример 1. Синтез аммиака ведется при высоком давлении в присутствии катализатора согласно реакции: N  2 + 3H2 2NH3 2 + 3H2 2NH3 Если эту реакцию проводить при давлении р = 850 атм, содержание NH3 в реакционной смеси составит 30 %. Если же давление повысить до 1700 атм, выход аммиака увеличится до 50 %. Таким образом, изменяя лишь один физический параметр – давление, – можно почти вдвое увеличить выход конечного продукта. Пример 2. Температура, как известно, оказывает существенное влияние на скорость реакции (при повышении температуры на каждые 10 ºС скорость реакции увеличивается в 2 – 4 раза). Но не всегда для увеличения скорости протекания реакции целесообразно повышать температуру реакционной смеси, поскольку при этом может сократиться выход продуктов реакции. Таким образом, изменяя различные физические параметры, можно управлять процессом и подбирать оптимальные условия его проведения. Название науки «Физическая химия» введено М.В. Ломоносовым, который впервые сформулировал ее предмет и задачи. В 1752 г. он написал «Введение в истинную физическую химию», в котором дал близкое к современному определение ее предметной области: «Физическая химия есть наука, объясняющая на основании положений и опытов физики, то, что происходит в сложных телах при химических операциях». Физическая химия – теоретическая основа современных технологий. Раздел I. Основы химической термодинамики Термодинамика – наука о взаимном превращении одних видов энергии в другие. Термодинамика базируется на нескольких постулатах, основными из которых являются I и II законы. Эти постулаты не могут быть выведены теоретически, их истинность подтверждена многолетним опытом человечества. Различают общую, техническую и химическую термодинамику. Общая термодинамика рассматривает теоретические основы всех направлений термодинамики. В технической термодинамике рассматриваются взаимные превращения теплоты и работы применительно, главным образом, к конструированию и эксплуатации тепловых двигателей. Химическая термодинамика – раздел физической химии, в котором термодинамические методы применяются для анализа химических и физико-химических процессов – химических реакций, фазовых переходов, явлений в растворах и т.п. Знание законов термодинамики позволяет: 1) рассчитать тепловой эффект процесса и определить влияние на него изменения внешних условий; 2) «apriori» определить принципиальную возможность анализируемого процесса и тем самым исключить ненужные эксперименты; 3) рассчитать конечный результат химического процесса – равновесный состав реакционной смеси, оценить максимально возможный выход продуктов реакции и подобрать оптимальные условия ее проведения. 1.1 Основные понятия, используемые в химической термодинамике Объектом изучения термодинамики является термодинамическая система. Термодинамическая система (или просто система) – это тело или совокупность тел, выделяемых в пространстве с помощью реально существующей или воображаемой границы. Иными словами, система – это та часть материального мира, которая является предметом нашего наблюдения или исследования. Системой может быть, например, колба с реакционной смесью, человек, теплообменник на предприятии. Все то, что окружает систему, – окружающая среда. Термодинамическая система обязательно должна содержать большое число микрочастиц (молекул, атомов). Системы с малым числом частиц не подчиняются законам термодинамики. Взаимодействие системы с окружающей средой состоит из обмена энергией и веществом. Различают открытые, закрытые и изолированные системы. 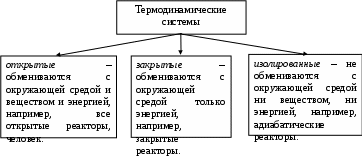 Каждая система характеризуется определенным набором свойств. Различают экстенсивные и интенсивные свойства. Экстенсивные свойства зависят от массы системы. Например, объем, масса, площадь поверхности. Интенсивные свойства не зависят от массы системы (температура, давление). Интенсивными являются также удельные (т.е. отнесенные к чему-либо) значения экстенсивных свойств, например, концентрации веществ, плотность. Состояние любой термодинамической системы может быть охарактеризовано количественно с помощью термодинамических параметров состояния. Это температура Т, давление р, объем V и концентрация (для химически неоднородных систем). Все остальные свойства системы (например, внутренняя энергия, энтальпия, …) зависят от параметров состояния, т.е. являются функциями состояния системы. Термодинамические функции состояния обладают двумя важными свойствами. И 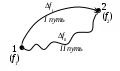 зменение функции состояния определяется только исходным 1 и конечным 2 состояниями системы и не зависит от пути перехода этой системы из исходного в конечное состояние. зменение функции состояния определяется только исходным 1 и конечным 2 состояниями системы и не зависит от пути перехода этой системы из исходного в конечное состояние. fI = fII = f2 – f1. С математической точки зрения это означает, что любое бесконечно малое изменение функции состояния системы является полным дифференциалом: 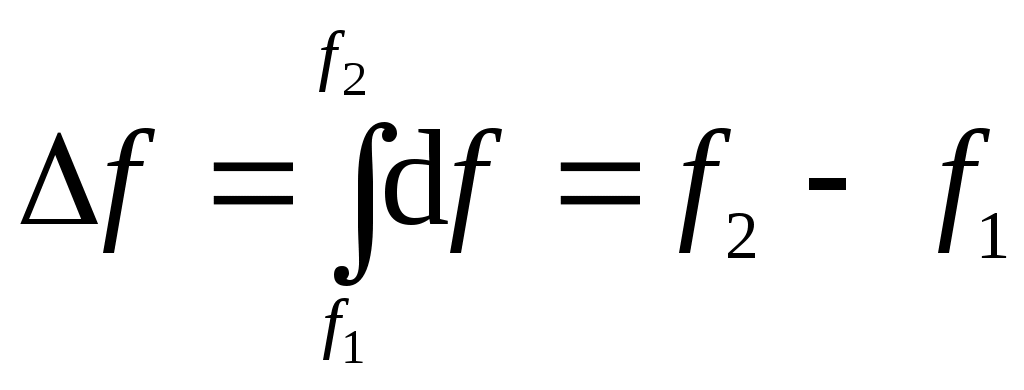 . .В круговом процессе конечное состояние совпадает с начальным, поэтому любая функция состояния принимает первоначальное значение, а ее изменение равно нулю: Свойство аддитивности: величина термодинамической функции состояния для всей системы складывается из величин этой функции для отдельных частей системы. Уравнение состояния системы – это уравнение, связывающее между собой параметры состояния данной системы. Например, уравнением состояния идеального газа является уравнение Менделеева-Клапейрона где n – число моль газа; R – универсальная газовая постоянная, R = 8,314 Дж/(мольК). Процесс – это любое изменение в системе, приводящее к изменению хотя бы одного параметра состояния. Обычно термодинамические процессы проводят при постоянстве определеннныъ параметров системы, что отражается в их названии. Например: 1) изотермический (T = const); 2) изобарный (р = const); 3) изохорный (V = const); 4) адиабатический (нет теплообмена с окружающей средой); 5) изобарно-изотермический (р, T = const); 6) изохорно-изотермический (V, T = const). Если в результате процесса система возвращается в исходное состояние, такой процесс называется круговым (или циклом). Циклические процессы часто совершаются в природе и технике, например, при работе двигателя внутреннего сгорания. Материя не может существовать без движения, а мерой движения является энергия. Энергия (философская категория) – это мера способности системы совершать работу. Энергия может существовать в разнообразных формах, например, химическая, электрическая, механическая, ядерная, солнечная энергия. В термодинамике принято энергию подразделять на внешнюю энергию системы и внутреннюю энергию. В понятие внешней энергии входят кинетическая энергия движения самой системы и потенциальная энергия положения ее в пространстве. Большое значение в термодинамике имеет внутренняя энергия U системы – сумма кинетической и потенциальной энергий всех микрочастиц в системе. Кинетическая энергия движения самой системы и потенциальная энергия положения ее в пространстве во внутреннюю энергию не входят. А 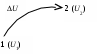 бсолютное значение внутренней энергии определить невозможно, но легко найти изменение ее ΔU при переходе системы из исходного состояния 1 в конечное 2: бсолютное значение внутренней энергии определить невозможно, но легко найти изменение ее ΔU при переходе системы из исходного состояния 1 в конечное 2:ΔU = U2 – U1. В 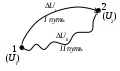 нутренняя энергия – функция состояния: каким бы способом не проводили переход системы из исходного 1 в конечное 2 состояние, изменение внутренней энергии будет одним и тем же, т.е. нутренняя энергия – функция состояния: каким бы способом не проводили переход системы из исходного 1 в конечное 2 состояние, изменение внутренней энергии будет одним и тем же, т.е.UI = UII = U2 – U1. Работа А и теплота Q – две возможные формы передачи энергии от одной системы к другой. При этом теплота связана с беспорядочным (хаотическим) перемещением микрочастиц: энергия передается путем хаотических столкновений молекул соприкасающихся тел, т.е. путем теплопроводности. Работа – форма передачи энергии путем упорядоченного движения частиц. Например, расширение газа, находящегося под давлением. Теплота и работа, в отличие от внутренней энергии, не являются свойствами системы: они возникают только тогда, когда возникает процесс, и характеризуют только процесс. Теплота и работа в общем случае являются функцией процесса. Единица измерения Q, U и A – Дж (1 Дж = 1 Нм). 1.2 Первый закон термодинамики, его приложение к термодинамическим процессам Первый закон термодинамики является количественной формулировкой всеобщего закона сохранения энергии применительно к процессам, связанным с превращениями теплоты и работы. Закон сохранения энергии: энергия не возникает из ничего и не исчезает бесследно; она лишь превращается из одних видов в другие, причем, строго в эквивалентных количествах. Первый закон термодинамики возник в эпоху создания тепловых двигателей. С появлением тепловых машин перед человечеством встала естественная задача создания экономически выгодных машин. Предпринимались многочисленные попытки создания вечного двигателя I рода − тепловой машины, производящей работу без затрат энергии. Первый закон термодинамики – это постулат; он не может быть доказан логическим путем или выведен из каких-либо более общих положений. Истинность его подтверждается тем, что ни одно из его следствий не находится в противоречии с опытом. Существует несколько формулировок I закона, например: – в любой изолированной системе запас энергии остается постоянным; – невозможно создать вечный двигатель I рода; –  теплота, подведенная к системе Q, расходуется на совершение системой работы A и на увеличение ее внутренней энергии U: теплота, подведенная к системе Q, расходуется на совершение системой работы A и на увеличение ее внутренней энергии U:Для бесконечно малого изменения состояния системы (в дифференциальной форме) Знак в уравнении (2) отражает тот факт, что теплота и работа − функции процесса и их бесконечно малое изменение не является полным дифференциалом. В уравнениях (1) и (2) используется термодинамическая система знаков: теплота положительна, если она передается системе; работа положительна, если она совершается системой. В общем случае работа является суммой нескольких качественно различных видов работ (механической, электрической, магнитной, поверхностной и др.). В термодинамике принято все виды работы за исключением работы расширения (сжатия) pV называть полезной работой Тогда уравнения (1)-(2) примут вид: Q= U + pV + A, Если совершается только работа расширения (сжатия), т.е. A= 0, то Q= U + pV, Практическое значение I закона термодинамики состоит в возможности расчета тепловых эффектов различных процессов и работы, совершаемой системой при их осуществлении. Применим уравнение (3) к основным термодинамическим процессам. 1) Изохорный процесс (V = const, dV = 0). Так как работа расширения при этом равна 0, то, очевидно, что вся теплота, подведенная к системе, идет на увеличение внутренней энергии: 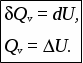 Таким образом, теплота изохорного процесса равна изменению внутренней энергии и, следовательно, является функцией состояния. 2) Изобарный процесс (p = const, dp = 0). Из математики: любую константу можно внести под знак дифференциала, а сумма дифференциалов равна дифференциалу от суммы. Уравнение (3) в этом случае запишется в виде где U + pVH − функция состояния системы, называемая энтальпией. 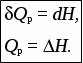 Таким образом, теплота изобарного процесса равна изменению энтальпии и является функцией состояния. Работа расширения изобарного процесса А = pV = p(V2 – V1), где V1, V2 – объем системы в исходном и конечном состояниях. Если изобарный процесс протекает в идеальном газе, то в соответствии с уравнением Менделеева-Клапейрона для исходного 1 и конечного 2 состояний можно записать: 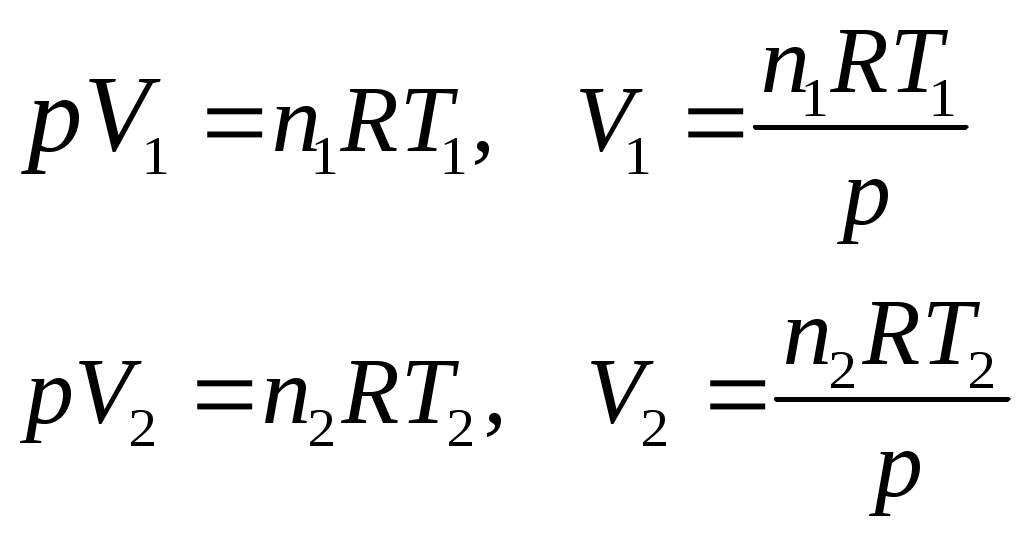 . .Тогда Для изобарно-изотермического процесса (р, Т = const) Т1 = Т2 = Т уравнение (4) запишется: где Связь между Qv и Qp определяется уравнением: Для реакций, протекающих с участием только конденсированных фаз (твердых и жидких), объем системы практически не изменяется (V = 0) и Qp Qv. Для реакций, протекающих с участием веществ в газообразном состоянии, в том числе идеальных и реальных газов при невысоких давлениях, к которым применимо уравнение Менделеева-Клапейрона, т.е. при р, Т = const изменение объема вызвано уменьшением или увеличением числа моль газообразных! компонентов в системе: Следовательно, 3. Изотермический процесс (Т = const) Рассмотрим изотермический процесс, протекающий в идеальном газе. Согласно закону Гей-Люссака-Джоуля внутренняя энергия идеального газа зависит только от температуры и не зависит от давления и объема. Это значит, что при Т = constΔU = 0. Это означает, что при Т = const внутренняя энергия идеального газа не изменяется, т.е. U = const, а dU= 0. Следовательно, Таким образом, в изотермическом процессе работа (A = pdV) совершается только за счет поглощаемой теплоты(QT). Для идеального газа в соответствии с уравнением Менделеева Клапейрона После интегрирования 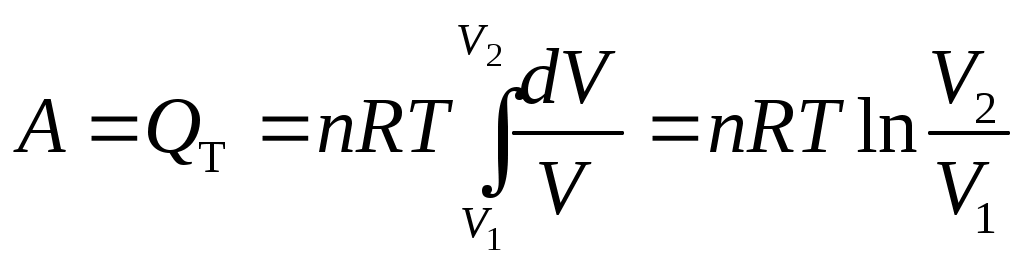 . .При Т = const тогда 4) Адиабатический процесс осуществляется без теплообмена с окружающей средой (Q = 0). 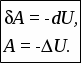 . .В адиабатическом процессе работа может совершаться только за счет убыли внутренней энергии. Таблица – Приложение I закона к термодинамическим процессам
| |||||||||||||||||
