рк-1. 1. аминокислоты и их биологические функции Аминокислоты
 Скачать 2.38 Mb. Скачать 2.38 Mb.
|
|
Регуляция активности ферментов путем фосфорилирования-дефосфорилирования. Протекает при участии протеинкиназ по ОН-группам серина и треонина, а в ряде случаев – тирозина. Активным ферментом может быть или фосфорилированная или дефосфорилированная форма. Регуляция активности путем ассоциации-диссоциации субъединиц в олигомерном ферменте. Например, фермент протеинкиназа в неактивной форме построена как тетрамер. Активная протеинкиназа представляет собой субъединицу С, для освобождения которой необходима диссоциация комплекса. Активация ферментов путем частичного протеолиза. Некоторые ферменты синтезируются первоначально неактивными и лишь после секреции из клетки переходят в активную форму. Неактивный предшественник называется проферментом. Активация профермента включает модификацию первичной структуры с одновременным изменением конформации. Например, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента с N-конца. Химическая постсинтетическая модификация ферментов включает также процессы метилирования, гликозилирования, уридилирования, аденилирования, АДФ-рибозилирования и др. Активаторы и ингибиторы в физиологических условиях это регуляторы активности ферментов. В роли активаторов могут быть Н+ - активаторы пепсина, катионы металлов, например, Mg2+ является активатором очень многих ферментов в обмене углеводов, в биосинтезе белка и др. Активаторами ферментов могут быть и анионы, например, Cl активирует -амилазу. Также ктиваторами ферментов могут быть белки, например, белок кальмодулин – активатор некоторых протеинкиназ. Ингибиторы – специфические для определенной группы ферментов вещества. Например, цианиды – это необратимые ингибиторы ферментов, имеющих в своём составе Fe3+ (цитохромоксидаза). Ингибиторами могут быть эндогенные вещества – регуляторы активности и экзогенные вещества – лекарства, яды, токсины бактерий и т.д. Ингибиторы делятся на необратимые и обратимые. Необратимые ингибиторы образуют с ферментом прочную ковалентную связь и подавляют его активность на всё время жизни фермента. Обратимые ингибиторы присоединены к ферментам более слабыми не ковалентными связями и действуют кратковременно. Факторы денатурации не являются ингибиторами, хотя и подавляют действие ферментов. ФОС (фосфорорганические соединения) необратимо ингибируют ферменты, содержащие в активном центре -ОН группу серина. К таким ферментам относится ацетилхолинэстераза. Этот фермент катализирует реакцию: ацетилхолинэстераза + ФОС АЦЕТИЛХОЛИН-----------------------------------------ХОЛИН + АЦЕТАТ Если фермент заингибирован и эта реакция не происходит, ацетилхолин (АХ) накапливается. Атетилхолин – это возбуждающий медиатор, он вызывает эффект перевозбуждения, например, судороги, спазм дыхательных мышц. В медицине используются лекарства, являющиеся необратимыми ингибиторами. Например, аспирин – необратимый ингибитор ферментов циклооксигеназ. Обратимые ингибиторы подразделяются на неконкурентные и конкурентные. Неконкурентные ингибиторы связываются с ферментами не в активном субстратном центре, а в другом месте. Неконкурентные ингибиторы могут связываться либо с ферментом, либо с фермент-субстратным комплексом. Обратимые конкурентные ингибиторы связываются с субстратным центром. Они конкурируют с субстратом за связывание с этим центром из-за сходства ингибитора с субстратом. Классическим примером ингибирования такого типа является ингибирование фермента сукцинатдегидрогеназы малоновой кислотой (структурный аналог сукцината). По механизму конкурентного ингибирования оказывают своё лечебное действие многие лекарства. Например, антибактериальное действие сульфаниламидных препаратов основано на подавлении синтеза фолиевой кислоты у бактерий. Фолиевая кислота (тетрагидрофолат) необходима для синтеза нуклеиновых кислот. Бактерии её синтезируют, используя ГТФ (Гуанозинтрифосфат), ПАБК (парааминобензойная кислота) или глутамат. Сульфаниламидные препараты являются структурными аналогами ПАБК и конкурентными ингибиторами ферментов синтеза фолиевой кислоты. Кроме того, сульфаниламиды могут использоваться как псевдосубстраты, и синтезировать соединение похожее на фолиевую кислоту, но не выполняющее её функции. Функции фолиевой кислоты, точнее её коферментной формы тетрагидрофолата – перенос одноуглеродных групп при синтезе нуклеотидов и нуклеиновых кислот. Без фолиевой кислоты прекращается деление и рост бактерий. Изменение количества фермента. На бактериях хорошо изучен феномен индуцированного (индуцирующего) синтеза ферментов при выращивании их на среде, где единственным источником углерода и энергии служит тот или иной углевод, например глюкоза. Замена в среде глюкозы на лактозу (индуктор) приводит к индуцированному или адаптивному синтезу фермента галактозидазы (программированному лактозным геном), расщепляющей лактозу на глюкозу и галактозу. В клетках прокариот и эукариот имеются ферменты, концентрация которых не требует добавления индуктора; это так называемые конститутивные ферменты. Количество фермента в клетке зависит от наличия продукта реакции, катализируемой данным ферментом, причем продукт реакции вызывает торможение синтеза фермента в результате репрессии. В животных тканях быстрый синтез ферментов наблюдается реже. Механизм его (индуцирующий синтез) изучен только для небольшого числа ферментов: тирозинтрансаминазы, серин- и треониндегидратазы, триптофанпирролазы и др. – в ответ на введение гормонов или прием белковой пищи. Однако при поступлении в организм некоторых ядов, канцерогенных веществ, алкалоидов, инсектицидов через несколько дней наблюдается резкое повышение активности (соответственно количества) ферментов-гидроксилаз (монооксигеназ) эндоплазматической сети клеток печени, окисляющих чужеродные вещества в нетоксичные для организма продукты. Вполне допустимо предположить, что в этих случаях имеет место синтез ферментов путем индукции. Описаны случаи, когда под действием подобных гидроксилаз чужеродные вещества превращаются в организме в более токсичные соединения. Это явление, обратное детоксикации, получило название летального синтеза. Химическая модификация ферментов относится к модификации ферментативной структуры с помощью технологии рекомбинантной ДНК или химической обработки для получения желаемой функции, которая может быть использована в медицинском, промышленном и сельскохозяйственном секторах. 4. Принципы регуляции метаболизма: принцип обратной связи, закон действия масс, локализация ферментов в клетке. Живая клетка — открытая система, постоянно обменивающаяся с внешней средой веществами и энергией, в неё поступают питательные вещества, которые подвергаются превращениям и используются в качестве строительного и энергетического материала, из клетки выводятся конечные продукты метаболизма. В многоклеточном организме клетка реагирует не только на изменение окружающей среды, но и на функциональную активность соседних клеток. При этом она стремится сохранить неизменным свой внутренний состав. Это состояние называют стационарным или клеточным гомеостазом. Принцип обратной связи Скорость метаболических процессов зависит от концентрации веществ, использующихся и образующихся в данной цепи реакций. Такая регуляция представляется логичной, так как при накоплении конечного продукта он (конечный продукт) может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути: 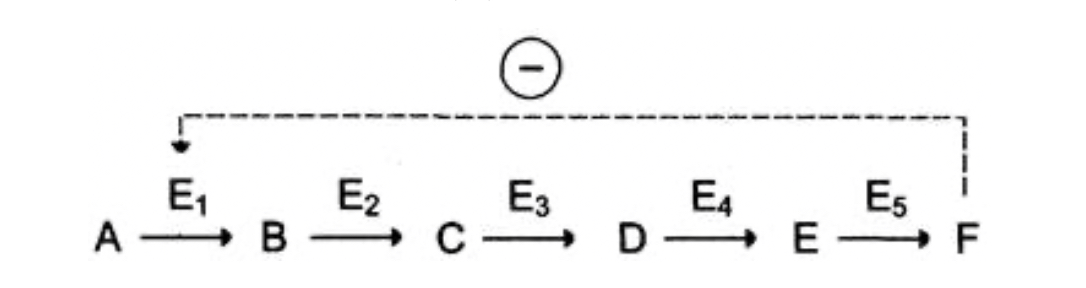 Фермент, катализирующий превращение субстрата А в продукт В, имеет аллостерический центр для отрицательного эффектора, которым служит конечный продукт метаболического пути F. Если концентрация F увеличивается (т. е. вещество F синтезируется быстрее, чем расходуется), ингибируется активность одного из начальных ферментов. Такую регуляцию называют отрицательной обратной связью, или ретроингибированием. Отрицательная обратная связь — часто встречающийся механизм регуляции метаболизма в клетке. Закон действия масс Зависимость скорости реакции от концентрации реагирующих веществ. Эту зависимость описывает закон действующих масс: скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ; В случае реакции А+В-->C этой зависимости соответствует уравнение v=K*[A]*[B], где К – константа скорости реакции. Пространственная локализация ферментов Оптимальная активность ферментов, катализирующих реакции одного метаболического пути, достигается благодаря определённой пространственной организации в клетке. В клетке постоянно происходит большое количество разнообразных химических реакций, которые формируют метаболические пути — последовательное превращение одних соединений в другие. Метаболизм — совокупность всех метаболических путей, протекающих в клетках организма. Среди всех метаболических путей, протекающих в организме, выделяют противоположно направленные процессы: катаболизм и анаболизм. Катаболизм — распад сложных веществ до простых с высвобождением энергии. Анаболизм — синтез из простых более сложных веществ. Метаболические пути согласованы между собой по месту, времени и интенсивности протекания. Эта согласованность протекания всех процессов обеспечивается сложными и многообразными механизмами регуляции. Большинство ферментов имеет внутриклеточную локализацию и распределены в организме неравномерно. Все ферменты одного метаболического пути, как правило, находятся в одном отделе клетки. Особенно разделение метаболических путей важно для противоположно направленных катаболических и анаболических процессов. Промежуточные продукты метаболического пути могут высвобождаться из последовательности реакций и использоваться в других метаболических путях, т. е. метаболические пути связаны между собой промежуточными продуктами. В ряде случаев пространственная организация ферментов настолько сильно выражена, что продукт реакции ни при каких условиях не может быть вычленен из метаболического пути и обязательно служит субстратом следующей реакции. Такая организация метаболического пути носит название мультиферментного комплекса и возникает в результате структурно-функциональной организации ферментов. Обычно такие комплексы связаны с мембранами. Многообразие функций клетки обеспечивается пространственной и временной (в первую очередь, в зависимости от ритма питания) регуляцией определённых метаболических путей. Пространственная регуляция связана со строгой локализацией определённых ферментов в различных органеллах. Так, в ядре находятся ферменты, связанные с синтезом молекул ДНК и РНК, в цитоплазме — ферменты гликолиза, в лизосомах — гидролитические ферменты, в матриксе митохондрий — ферменты ЦТК, во внутренней мембране митохондрий — ферменты цепи переноса электронов и т. д. Такая субклеточная локализация ферментов способствует упорядоченности биохимических процессов и увеличивает скорость обмена веществ. 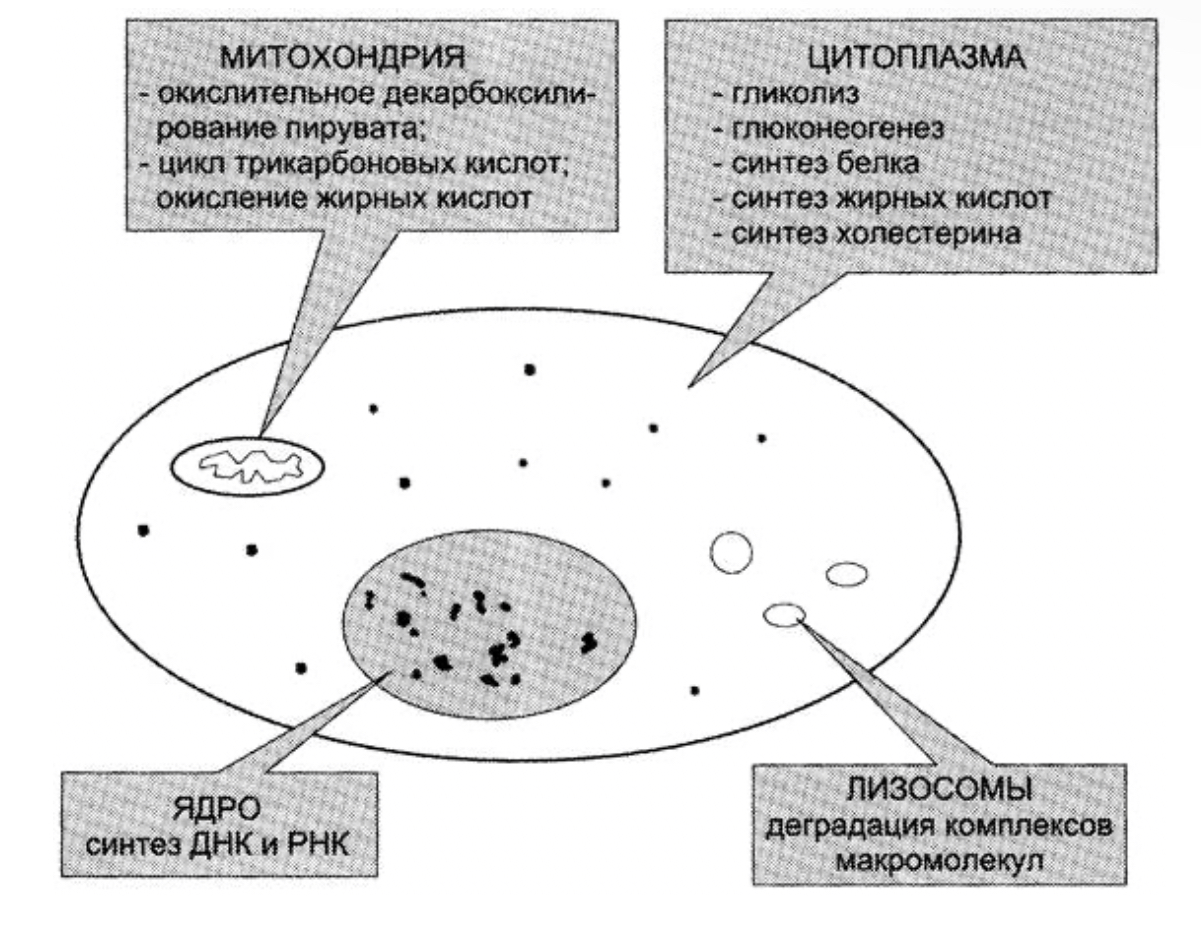 Регуляция количества молекул фермента в клетке Известно, что белки в клетке постоянно обновляются. Количество молекул фермента в клетке определяется соотношением 2 процессов — синтеза и распада белковой молекулы фермента: 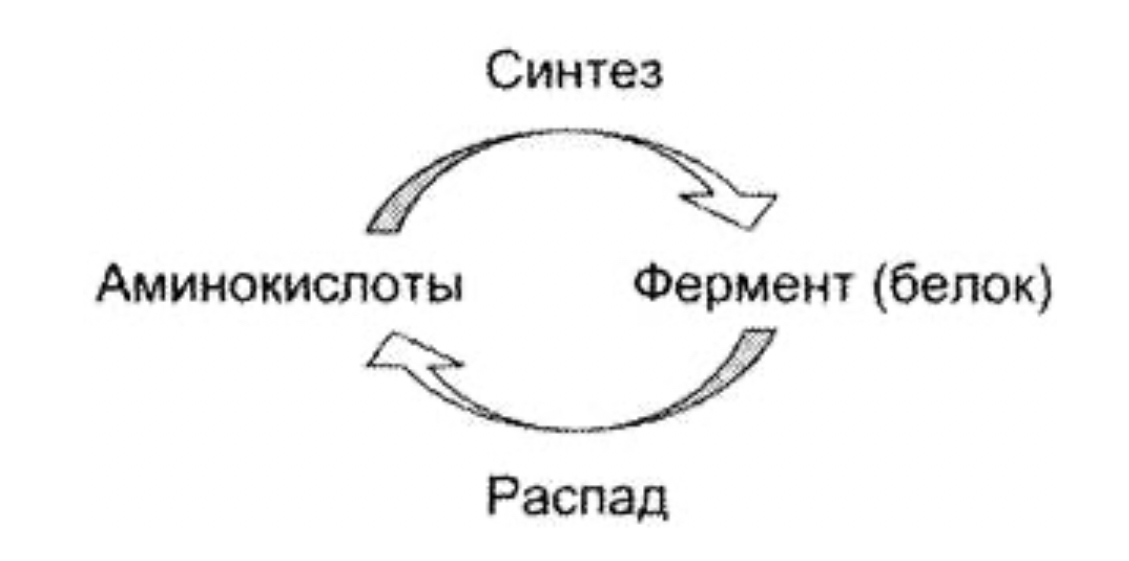 Синтез и фолдинг (распад) белка — многостадийный процесс. Регуляция синтеза белка может происходить на любой стадии формирования белковой молекулы. Наиболее изучен механизм регуляции синтеза белковой молекулы на уровне транскрипции, который осуществляется определёнными метаболитами, гормонами и рядом биологически активных молекул. Что касается распада ферментов, то регуляция этого процесса менее изучена. Можно только предполагать, что это не просто процесс протеолиза (разрушения белковой молекулы), а сложный механизм, возможно, определяемый на генетическом уровне. 5. Активность и число оборотов ферментов. Четыре особенности отличают ферменты от всех прочих катализаторов. Во-первых, эти биокатализаторы исключительно эффективны. Нри оптимальных условиях большинство ферментативных реакций протекает в 10 —10 раз быстрее, чем те же реакции в отсутствие ферментов. Число оборотов (т. е. число молекул субстрата, превращаемых за одну минуту, на одну молекулу фермента) для большинства ферментов равно приблизительно 1000, а в некоторых случаях может превышать 10 . Следует при этом иметь в виду, что скорость отдельных стадий ферментативных реакций лимитируется диффузией реагирующих веществ или, во всяком случае, зависит от нее. Таким образом, многие химические реакции, которые обычно протекают только при высоких температурах или только в сильно кислой или сильно щелочной среде, в присутствии соответствующих ферментов могут идти быстро и количественно при комнатной температуре и при значениях pH, близких к нейтральному. Во-вторых, для большинства ферментативных реакций характерна высокая специфичность как в отношении природы катализируемой реакции, так и в отношении структуры используемого субстрата. В-третьих, круг реакций, катализируемых ферментами, необычайно широк. Ферменты катализируют реакции гидролиза, поликонденсации, окисления — восстановления, дегидрирования, альдольно11 конденсации, реакции переноса различных групп, а также ряд других реакций. Мы можем, таким образом, сказать, что белки — катализаторы с исключительно широким спектром действия. Наконец, в-четвертых, активность самих ферментов в клетке строго регулируется. Скорость синтеза ферментов, а также их конечная концентрация находятся под генетическим контролем и регулируются с помощью малых молекул эти малые молекулы часто являются субстратами или продуктами реакций, катализируемых теми н е ферментами. Кроме того, ферменты могут существовать как в активной, так и в неактивной форме, причем скорость и степень их превращения в каждом конкретном случае зависит от свойств окружающей среды Число оборотов можно измерить только для чистых ферментов. Отчасти по этой причине активность фермента чаще выражается в единицах активности на i мг белка (удельная активность). Одна международная единица представляет такое количество фермента, которое-катализирует образование I мкмоль продукта в 1 мин при стандартных (обычно оптимальных) условиях. В настоящее время Международный биохимический союз [7] рекомендует новую единицу — катал (кат), представляющую собой количество фермента, которое катализирует превращение 1 моль субстрата в продукт за 1 с. Каталитическую активность ферментов можно характеризовать как отношение скорости реакции при концентрации катализатора, равной единице, к скорости той же реакции без катализатора, или по снижению энергии активации при концентрации катализатора, равной единице, и, наконец, числом оборотов фермента. Числом оборотов называется количество молей субстрата, превращаемое в единицу времени одним молем фермента. В табл. 28 приведены величины чисел оборотов некоторых ферментов.   6. Определение активности ферментов. Ферменты – это биологические катализаторы белковой природы, которые образуются в живых клетках и обладают способностью активировать различные химические соединения. Характеристикой активности ферментов является скорость, с которой они катализируют ту или иную реакцию. Она измеряется скоростью превращения субстрата или скоростью накопления продуктов реакции. Измерять нужно начальную скорость превращения, а не количество субстрата, превращенного за определенный отрезок времени. Комиссия по ферментам Международного биохимического союза дает понятие о стандартной единице активности. Единица активности (Е) – это количество фермента, которое катализирует превращение одного микромоля субстрата в мин при стандартных условиях (в оптимуме рН, при избытке субстрата, температуре 37 или 20º С). Для определения ферментативной активности используют следующие методы: 1. Химический метод – количественное определение субстрата или продуктов с помощью химических реагентов (О-гликозилгидролазы – по образованию восстанавливающих сахаров). 2. Спектрофотометрический метод – измерение скорости ферментативной реакции по изменению поглощения субстрата при характеристической длине волны (лиазы – по образованию двойной связи). 3. Манометрический метод – определение количества газа, выделяющегося в процессе реакции (оксидазы – по поглощению О2, декарбоксилазы – по выделению СО2). 4. Поляриметрический метод – фиксируется изменение оптического вращения (β-фруктофуранозидаза). 5. Хроматографический – количественное определение субстрата или продуктов с помощью различных видов хроматографии: бумажной (анализ сахаров), тонкослойной (гликозидов со сложными агликонами), ВЭЖХ (аминокислотный анализ и др.). Удельная активность – это число единиц активности (Е) на мг белка. 7. Международная классификация и номенклатура ферментов. В настоящее время известно более двух тысяч химических реакций, катализируемых ферментами, и число это непрерывно возрастает. Чтобы ориентироваться в таком множестве превращений, ещё в 1961 году Международной комиссией по ферментам (IEC) были разработаны принципы рациональной международной классификации и номенклатуры, при помощи которой любой фермент можно было бы точно идентифицировать. Приведенная ниже классификация ферментов основана на рекомендациях Комитета по номенклатуре Международного Объединения Биохимии и Молекулярной Биологии (NC-IUBMB). Число типов химических реакций сравнительно невелико, что позволило разделить все известные в настоящее время ферменты на 6 важнейших классов, в зависимости от типа катализируемой реакции. Такими классами являются: 1. Оксидоредуктазы (окислительно-восстановительные реакции); 2. Трансферазы (перенос функциональных групп); 3. Гидролазы (реакции расщепления с участием воды); 4. Лиазы (разрыв связей без участия воды); 5. Изомеразы (изомерные превращения); 6. Лигазы (синтез с затратой молекул АТФ). Ферменты каждого класса делят на подклассы, руководствуясь строением субстратов. В подклассы объединяют ферменты, действующие на сходно построенные субстраты. Подклассы разбивают на подподклассы, в которых ещё строже уточняют структуру химических групп, отличающих субстраты друг от друга. Внутри подподклассов перечисляют индивидуальные ферменты. Все подразделения классификации имеют свои номера. Таким образом, любой фермент получает свой уникальный кодовый номер (шифр), со стоящими перед ним буквами КФ («Каталог ферментов», английская аббревиатура ЕС). Шифр каждого фермента содержит четыре числа, разделенных точками. Первое число обозначает класс, второе – подкласс, третье – подподкласс, четвёртое – номер фермента в пределах подподкласса. Согласно классификации, каждый фермент имеет два названия: рекомендуемое (рабочее), предназначенное для повседневного употребления, и систематическое, которое составляется в определенном порядке и подчеркивает тип катализируемой реакции. Систематическое название составляется из двух частей. Первая часть содержит название субстрата или субстратов, часто – наименование кофермента, вторая часть указывает на природу катализируемой реакции и включает название класса, к которому относится данный фермент. При необходимости приводится дополнительная информация о реакции в скобках после второй части названия. Систематическое название присваивается только тем ферментам, каталитическое действие которых полностью изучено. Пример. Систематическое название фермента АТР: D-гексозо-6-фосфотрансфераза (КФ 2.7.1.1) указывает на то, что этот энзим катализирует перенос фосфатной группы от АТР на гидроксильную группу атома углерода в шестом положении гексозы; фермент относится к классу 2 (трансферазы); подклассу 7 (перенос фосфатных групп); подподклассу 1 (акцептором фосфата являются спирты). |
