рк-1. 1. аминокислоты и их биологические функции Аминокислоты
 Скачать 2.38 Mb. Скачать 2.38 Mb.
|
Денатурация и ренатурацияДенатурация - нагревание растворов белков до 60-80% или действие реагентов, разрушающих нековалентные связи в белках, что происходит разрушение третичной (четвертичной) и вторичной структуры белковой молекулы, она принимает форму беспорядочного случайного клубка. В качестве денатурирующих реагентов могут быть кислоты, щелочи, спирты, фенолы, мочевина, гуанидинхлорид и др. Сущность их действия в том, что они образуют водородные связи с =NH и =СО - группами пептидного остова и с кислотными группами радикалов аминокислот, подменяя собственные внутримолекулярные водородные связи в белке вследствие чего вторичная и третичная структуры изменяются. При денатурации падает растворимость белка, он "свертывается" (например, при варке куриного яйца), утрачивается биологическая активность белка. На этом основано, например, применение водного раствора карболовой кислоты (фенола) в качестве антисептика. Денатурация — нарушение пространственной структуры белков (первичная структура молекулы сохраняется). Может быть обратимая (структура белка восстанавливается после устранения денатурирующего агента) или необратимая (пространственная структура молекулы не восстанавливается, например, при осаждении белков минеральными концентрированными кислотами, солями тяжелых металлов). В определенных условиях при медленном охлаждении раствора денатурированного белка происходит ренатурация - восстановление исходной (нативной) конформации. Это подтверждает тот факт, что характер укладки пептидной цепи определяется первичной структурой. Методы выделения белковДля выделения нативных белков (без изменения пространственной структуры) из биологического раствора используют методы: высаливание: осаждение солями щелочных, щелочноземельных металлов (хлорид натрия, сульфат магния), сульфатом аммония; при этом не нарушается первичная структура белка; осаждение: использование водоотнимающих веществ: спирт или ацетон при низких температурах (около –20 С). При использовании этих методов белки лишаются гидратной оболочки и выпадают в осадок в растворе. Методы фракционирования и очистки белковПосле экстрагирования белков, т.е. перевода в растворенное состояние, приступают к разделению, фракционированию смеси белков на индивидуальные белки. Для этого применяют методы: • высаливания; • осаждения органическими растворителями; • тепловой денатурации; • хроматографии; • гель фильтрации; • ультрацентрифугирования; • кристаллизации; • электрофореза; • распределения в двухфазных системах. Как известно, растворение белков в воде связано с гидратацией отдельных молекул, что приводит к образованию вокруг белковой молекулы водных (гидратных) оболочек, состоящих из ориентированных в определенной форме в пространстве молекул воды. Эта вода (гидратной оболочки) отличается от чистого растворителя. Растворы белков отличаются крайней неустойчивостью и под действием разнообразных факторов, нарушающих гидратацию, белки легко выпадают в осадок. Поэтому добавление к раствору белка любых водоотнимающих средств (спирт, ацетон, концентрированные растворы нейтральных солей щелочных металлов), а также воздействие физических факторов (нагревание, облучение) приводит к дегидратации молекул и их выпадению в осадок. Высаливание. При высаливании белка солями щелочных и щелочноземельных металлов белок обычно не теряет способности растворяться вновь в воде после удаления солей (диализом, гельфильтрацией). Например: глобулины выпадают в осадок при 50% насыщения, а альбумины при 100% насыщении раствора сульфатом аммония. При выпадении белковой молекулы в осадок, большое значение имеет не только концентрация солей, но температура и ионная сила раствора. Методы хроматографии. Метод хроматографии, разработанный в 1903 г. русским ученым М.В. Цветом, основан на способности пигментов (или др. веществ) специфически связываться с адсорбентом, заключенном в колонке; используются также процессы сорбции и десорбции. Применяют различные методы хроматографии – адсорбционную, распределительную, ионнобменную. Адсорбционная хроматография – адсорбентом является активированный уголь, окись алюминия или кремния. Широко применяются для разделения белков и другие вещества. Распределительная хроматография. При этом твердая фаза является только носителем для жидкой фазы. Виды: хроматография на бумаге, на колонках, где в качестве стационарной фазы применяют крахмал или селикагель. Ионообменная хроматография. Ионообменные смолы являются полимерными органическими соединениями, содержащими функциональные группы, способные вовлекаться в ионный обмен. Различают анионообменники (органические основания и амины), катионообменники, содержащие фенольные, сульфо-и карбоксильные группы. Широко применяются диэтиламиноэтилцеллюлоза (ДЭАЭ-целлюлоза), триэтиламиноэтил (ТЭАЭ) и аминоэтил (АЭ) - целлюлозы. Аффинная хроматография (или хроматография по сродству) основана на принципе избирательного взаимодействия белков со специфическими веществами, закрепленными на носителе. В качестве носителя применяют активированную бромцианом сефарозу (CNBr-сефароза), к которой присоединяют различные вещества – субстрат, кофермент, антиген, гормон и т.д. Метод позволяет одноэтапно получить высокоочищенный препарат белка. Гель-фильтрация или метод молекулярных сит – широко применяется для очистки белков от примесей. С помощью сефадекса (декстран, полисахарид микробного происхождения, обработанный для разделения белков) можно разделить белки с разной молекулярной массой, так как зерна сефадекса разных номеров имеют различного размера поры, в которые способны проникать белки с определенной молекулярной массой. Метод электрофореза основан на различии в скорости движения белков в электрическом поле, которая определяется величиной заряда белка при определенных рН и ионной силе раствора. Первоначально метод разработан А. Тизелиусом, в последнее время широко применяется метод зонального электрофореза белков на различных носителях – на бумаге (целлюлозе), крахмале, в полиакриламидном геле. Метод диск-электрофореза в полиакриламидном геле позволяет получить до 50 фракций белков, т.е. имеет очень высокую разрешающую способность. Изоэлектрическое фокусирование белков – на амфолинах позволяет выделить индивидуальные белки в препаративных количествах. Ультрацентрифугирование в градиенте плотности сахарозы или хлорида цезия получило широкое применение для очистки, а также определения молекулярной массы белков по константе седиментации (единица Сведберга - S). Очистка белка от низкомолекулярных примесей достигается методом диализа, гельфильтрации, кристаллизации, ультрафильтрации. При диализе применяют полупроницаемые мембраны (целлофан, коллоидиновая пленка), диаметр пор которой варьирует в широких пределах. Белки, как правило, через такую мембрану не диффундируют, а низкомолекулярные вещества легко проходят через нее в окружающую среду. Наилучшие результаты дают методы гельфильтрации и ультрафильтрации, т.к. дают возможность, как освободиться от низкомолекулярных компонентов, так и сконцентрировать белки. Методы определения гомогенности белков. Наилучшие результаты дают ультрацентрифугирование в градиенте плотности, диск-электрофорез в полиакриламидном геле, иммунохимические методы. Молекулярная масса белков. Размеры и форма белковых молекул. Белки глобулярные и фибриллярные, свойства, представители. Белки - высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Д и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров. По форме белки делятся на глобулярные и фибриллярные. К глобулярным относят белки, соотношение продольной и поперечной осей которых не превышает 1:10, т.е. белковая молекула имеет форму эллипса. Глобулярные белки водорастворимы. К ним относятся миоглобин и гемоглобин. Фибриллярные белки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. Фибриллярные белки выполняют главным образом опорные функции, обеспечивая прочность тканей. К фибриллярным белкам относят коллагены, эластин, кератин, миозин и фибрин. 6. Принципы классификации белков. Классификация белков по третичной структуре: глобулярные и фибриллярные белки. Простые и сложные белки. Основные функции белков в клетке. Принципы классификации белков: Существует несколько классификаций белков. В основе их лежат разные принципы: по степени сложности (простые и сложные); по форме молекул (глобулярные и фибриллярные белки); по растворимости в отдельных растворителях (водорастворимые, растворимые в слабых солевых растворах — альбумины, спирторастворимые — проламины, растворимые в щелочах — глютелины), по выполняемым ими функциям, например запасные белки, скелетные и т. д. Классификация белков по третичной структуре: глобулярные и фибриллярные белки: Третичная структура белка возникает при взаимодействии радикалов аминокислот, а также за счёт дисульфидных мостиков, водородных и ионных связей. Стабилизируется молекула слабыми нековалентными связями, дисульфидными связями и является самой неустойчивой структурой. 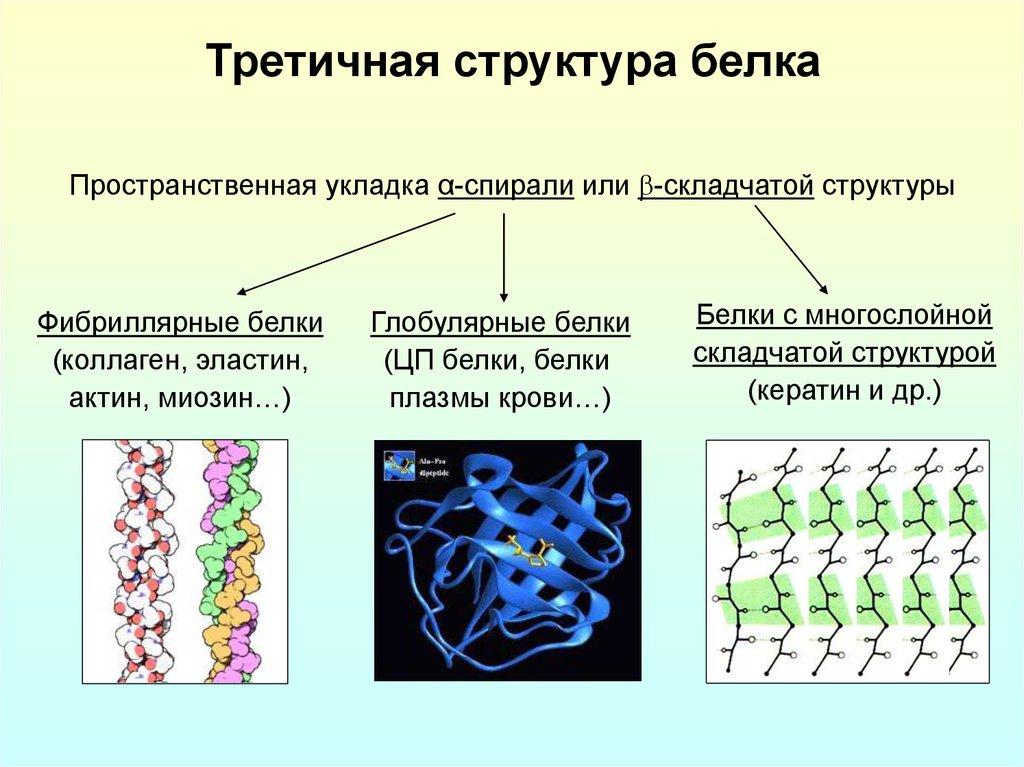 По форме молекулы и особенности пространственной структуры белки делятся на две группы: глобулярные и фибриллярные. Форма глобулярных белков близка к сферической или эллипсоидной, с отношением короткой и длинной осей до 1:50. Молекулы фибриллярных белков имеют удлинённую форму (длина больше диаметра) и могут образовывать многомолекулярные нитевидные агрегаты – фибриллы. Фибриллярные белки выполняют главным образом опорные функции, обеспечивая прочность тканей; глобулярные белки несравненно более разнообразны по функциям. Существенны различия белков этих групп и по физико-химическим свойствам. Третичная структура глобулярных белков образуется путём дополнительного складывания пептидной цепи, содержащей α-спирали, β-структуры и участки без периодической структуры. Это происходит прежде всего в результате взаимодействий между боковыми группами аминокислот. Простые и сложные белки: По ст6епени сложности белки делятся на простые (протеины) и сложные (протеиды). Простые белки состоят из полипептидной цепи и больше ничего не включают, кроме аминокислот. Протеиды – белки, в состав которых включена простетическая группа (небелковая часть). Протеины — запасные, скелетные, отдельные ферментные белки. Например: альбумины — белки с относительно небольшой молекулярной массой, хорошо растворимые в воде и в слабых солевых растворах; типичный представитель альбуминов — белок яйца — овальбумин; глобулины — растворяются в водных растворах солей. Это очень распространенные белки, входят в состав мышечных волокон, крови, молока, они составляют большую часть семян бобовых и масличных культур. Представителем глобулинов животного происхождения является лактоглобулин молока; Протеиды: нуклеопротеиды — кроме белка включают нуклеиновые кислоты. Нуклеиновые кислоты относятся к важнейшим биополимерам, которым принадлежит огромная роль в наследственности; липопротеиды — содержат кроме белка липиды. Содержатся в протоплазме и мембранах. Принимают участие в формировании клейковинных белков; Основные функции белков в клетке: Белки выполняют в клетке ряд функций: пластическую (строительную), каталитическую (ферментативную), энергетическую, сигнальную (рецепторную), сократительную (двигательную), транспортную, защитную, регуляторную и запасающую. Строительная функция белков связана с их наличием в клеточных мембранах и структурных компонентах клетки. Энергетическая обусловлена тем, что при расщеплении 1г белка высвобождается 17,2 кДж энергии. Белки — рецепторы мембран принимают участие в восприятии сигналов окружающей среды и их передаче в клетке, а также в межклеточном узнавании. Без белков невозможно движение клеток и организмов в целом. Они составляют основу жгутиков и ресничек, а также обеспечивают сокращение мышц и перемещение внутриклеточных компонентов. В крови человека и многих животных белок гемоглобин переносит кислород и часть углекислого газа, другие белки транспортируют ионы и электроны. Защитная роль белков связана с иммунитетом: белок интерферон способен уничтожать многие вирусы, а белки-антитела участвуют в иммунных реакциях. Также есть белки-регуляторы, например, гормон поджелудочной железы, инсулин, регулирующий концентрацию глюкозы в крови. 7-характристика иммуноглобуллина зложена на разныеЧеловеческий иммунитет – это сложная многоступенчатая система защиты организма от вредоносного воздействия извне (вирусов, бактерий, аллергенов, грибков). Не существует одного органа, который бы отвечал за иммунную защиту. Эта функция возложена на разные органы иммунной системы: начиная с лимфатических узлов до кишечника и заканчивая белковыми веществами – иммуноглобулинами. ОБЩАЯ ХАРАКТЕРИСТИКА ИММУНОГЛОБУЛИНОВ Иммуноглобулины (Ig), или антитела, представляют собой гликопротеины, имеющие в своем составе центры специфического нековалентного связывания антигена, основанного на принципе комплементарности. Существуют растворимые формы иммуноглобулинов, которые и называют антителами, и мембранные формы иммуноглобулинов, составляющие основу В-клеточных рецепторов на поверхности В-лимфоцитов. Иммуноглобулины содержатся в крови и в некоторых секреторных жидкостях и вырабатываются как ответ на контакт с антигенами, например, бактериями или вирусами. Иногда иммуноглобулины продуцируются после контакта с собственными тканями организма, называемыми аутоантигенами. Дефицит или избыток антител может быть признаком различных патологий, поэтому определение их количества в крови является важной частью при диагностике многих заболеваний. Кроме того, современные достижения в биомедицине позволяют использовать синтетические антитела в лечении некоторых заболеваний. характеристика гемоглобина Гемоглобин – сложный белок, основной компонент эритроцитов, переносящий кислород от легких ко всем тканям организма и участвующий в выведении углекислого газа из клеток организма. Молекула гемоглобина состоит из гема (небелковой части) и глобина (белковой части, которая содержит в своей молекуле четыре полипептидные цепи: две альфа-цепи и две бета-цепи). К каждой из четырех глобиновых субъединиц прикреплена группа гема с атомом железа. Молекула гемоглобина состоит из двух частей: Гем — небелковая часть, соединение порфирина с железом. В каждой молекуле гемоглобина — четыре гема. Глобин — белок, составляющий 96% всей массы гемоглобина и состоящий из четырёх цепочек. Гемоглобин, который захватил кислород из лёгких и несёт его к тканям и органам, называется оксигемоглобин. Он находится в артериальной крови, идущей от лёгких, и придаёт ей ярко-алый цвет. Добравшись до пункта назначения, оксигемоглобин выгружает кислород, а взамен забирает отработанный углекислый газ — так образуется карбгемоглобин. Карбогемоглобин циркулирует в венозной крови (идёт от тканей и органов к лёгким) и придаёт ей вишнёвую окраску. характеристика миоглобина Миоглобин относят к классу гемсодержащих белков, т.е. он содержит простетическую группу - гем, довольно прочно связанную с белковой частью. Миоглобин относят к глобулярным белкам; он имеет только одну полипептидную цепь. 1. Клеточная локализация и функция Миоглобин содержится в красных мышцах и участвует в запасании кислорода. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в ткани падает, О2 освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения необходимой для работы мышц энергии. 2. Строение миоглобина Миоглобин содержит небелковую часть (гем) и белковую часть (апомиоглобин). · Гем - молекула, имеющая структуру циклического тетрапиррола, где 4 пиррольных кольца соединены метиленовыми мостиками и содержат 4 метальные, 2 винильные и 2 пропионатные боковые цепи. Эта органическая часть тема называется протопорфирином. Возможны 15 вариантов расположения боковых цепей, но в составе гемопротеинов присутствует только один изомер, называемый протопорфирин IX. В теме 4 атома азота пиррольных колец протопорфирина IX связаны четырьмя координационными связями с Fe2+, находящимся в центре молекулы характеристика фосфопротеинов Это структуры, содержащие белковую часть – апопротеин и небелковый компонент – простетическую группу. В зависимости от строения последней принято различать следующие их варианты. Фосфопротеины – это сложные белки, простетической группой которых является остаток фосфорной кислоты. Тип связи между апопротеином и небелковым компонентом – сложноэфирная, которая образуется при взаимодействии ОН-группы серина или треонина с фосфорной кислотой. К протеинам этого класса относятся казеиноген молока, фосфорилированные модификации гистонов, ферменты (РНК-полимеразы, некоторые фосфотрансферазы, фосфатазы) и другие, а также вителлин, фосвитин желтка и овальбумин белка яиц, ихтуллин икры рыб. Остатки фосфорной кислоты, включённые в белки, находятся в диссоциированом состоянии, что придаёт молекуле сильный отрицательный заряд. Поэтому фосфопротеины могут легко взаимодействовать с лигандами или отталкивать их. Так, например, они связывают ионы Са2+ и транспортируют их. Но главная особенность данной простетической группы – это возможность изменения конформации и заряда белковой молекулы, что сказывается на её свойствах и функциях. Реакция взаимодействия с фосфорной кислотой называется фосфорилирование или дефосфорилирование и используется, например, для регулирования активности ферментов и изменения функциональной активности биомембран (проницаемости и др.). характеристика инсулина Инсулин – это гормон, вырабатываемый поджелудочной железой, который необходим для метаболизма углеводов и, в меньшей степени, жиров. Благодаря инсулину энергия (глюкоза) из пищи переносится из крови в клетки. Таким образом снижается уровень сахара в крови и обеспечивается питание клеток. Когда уровень инсулина в норме, уровень сахара в крови в норме. Когда инсулин слишком низкий (или не работает должным образом), диагностируется диабет. Когда уровень инсулина высокий, а уровень сахара в норме, мы говорим об инсулинорезистентности. Диабет 1 типа, диабет 2 типа и инсулинорезистентность – это проблемы со здоровьем, которые связаны с инсулином – гормоном, необходимым для жизни. Он нужен организму в строго определенном количестве. Опасны как дефицит инсулина, так и его чрезмерный избыток. ------------------------------------------------------------------------------------------ Практика 2 8. Нуклеиновые кислоты. Виды нуклеиновых кислот и их основные функции. Строение нуклеиновых кислот. (Даша Е) Нуклеиновые кислоты представляют собой биополимерные соединения, которые играют жизненно важную роль при поддержании жизни в клетках живого организма. Впервые они были выявлены в ядре клеток в конце XIX столетия. Основные функции нуклеиновых кислот — это сохранение, копирование и реализация наследственной (генетической) информации. виды: В природе существует два вида нуклеиновых кислот — рибонуклеиновые (РНК) и дезоксирибонуклеиновые (ДНК). Основанием каждой из них является азотистое основание, остаток фосфорной кислоты и пятиуглеродный сахар. В состав ДНК входит четыре разновидности нуклеотидов, отличие которых заключается в азотистом соединении: А — аденин; Т — тимин; Ц — цитозин; Г — гуанин. Что касается РНК, то они тоже имеют несколько видов в зависимости от азотистого основания: У — урацилом; Ц — цитозин; Г — гуанин; А — аденин. Поговорим и о физических свойствах нуклеотидов. Они легко растворяются в воде, но при этом практически нерастворимы в растворителях, имеющих органическое происхождение. Очень восприимчивы к температурным перепадам, а также критическим показателям значения уровня рН. Строение: Прежде всего необходимо узнать, что нуклеотидами являются мономеры нуклеиновых кислот. Они соединены между собой линейно, формируя длинные молекулярные соединения нуклеиновых кислот. Самыми длинными полимерами являются цепочки молекул ДНК. Как правило, длина молекул РНК значительно меньше, но при этом может отличаться (зависит от типа). При формировании полинуклеотидного соединения остатки фосфорной кислоты взаимодействуют с трехатомным углеродом пентозы. Аналогичная связь формируется между фосфорной кислотой и пятиатомным углеродом сахара непосредственно в нуклеиновой кислоте. Исходя из этого, индивидуальная характеристика нуклеиновой кислоты — это последовательность пентозы с мостиками фосфорных кислот. Азотистые основания отделяются по сторонам. Стоит добавить, что молекулы ДНК не только длиннее в сравнении с РНК, но и состоят из нескольких цепей, которые соединены между собой химически водородными связями. Такие структурные связи формируются по принципу комплементарности: гуанин комплементарен цитозину, а аденин — тимину. Функции нуклеотидов Местонахождение в клетках аминокислот, белка и нуклеотидов поддерживает их жизнедеятельность, а также сохранение, передачу и верную реализацию генетической наследственности. Стоит в отдельности рассмотреть функции ДНК, РНК и их разновидностей в жизни живых организмов. Значение ДНК В клетках ДНК вся информация в основном сосредоточена в ядре клетки. Бактериальная среда, как правило, в формуле занимает одну кольцевую молекулу, находится в неправильной формы образовании в цитоплазме, именуемым нуклеотидом. Гены, входящие в состав наследственной информации генома, являются единицей передачи генетической наследственности. Признак частицы — открытая рама считывания. - Самая важная биологическая функция вида — генетическая, клетка является носителем - генетической информации (благодаря этой особенности, каждый вид на планете обладает своими индивидуальными особенностями). - Наследственную информацию ДНК способно передавать в ряду целых поколений не без дополнительного участия и РНК. - Осуществляет процессы регуляции биосинтеза белка. Хранение и передача информации (генетической предрасположенности) осуществляется за счет биосинтеза белка посредством и-РНК, т-РНК. Свойства РНК В природе различают три разновидности РНК, каждая из которых предназначена для выполнения особой роли в осуществлении синтеза белка. Транспортная предназначена для транспортировки активированных аминокислот по организму к рибосомам. Это необходимо для осуществления синтеза полипептидных молекул. Исследования показали, что одна транспортная молекула способна связаться лишь с одной из 20 аминокислот. Они служат в качестве транспортировщиков специфических аминокислот и углеводов. Длина транспортной цепи значительно короче матричной, в состав входит приблизительно 80 нуклеотидов, визуально имеет вид клеверного листа. Матричная занимается копированием наследственного кода из ядра в цитоплазму. За счет этого процесса осуществляется синтез разнообразных белков. Схема строения представляет собой одноцепочную молекулу, она является неотъемлемой составляющей цитоплазмы. В составе молекулы содержится до нескольких тысяч нуклеотидов, они занимаются транспортировкой наследственной информации через мембрану ядра к очагу синтеза на рибосоме. Копирование информации осуществляется посредством транскрипции. Рибосомная задействует около 73 белков для формирования рибосом. Они собой представляют клеточные органеллы, на которых осуществляется сбор полипептидных молекул. Основные задачи рибосомной молекулы — это формирование центра рибосомы (активного); неотъемлемый структурный элемент рибосом, обеспечивающий их правильное функционирование; первоначальное взаимодействие рибосомы с кодоном-инициатором для выявления рамки считывания; обеспечение взаимодействия рибосомных молекул с транспортными. 9. Нуклеозиды и нуклеотиды. Циклические нуклеотиды. Нуклеотидные коферменты и переносчики соединений, их основные типы. Олиго- и полинуклеотиды. (Маша) Нуклеиновые кислоты – присутствующие в клетках всех живых организмов биополимеры, которые выполняют важнейшие функции по хранению и передаче генетической информации и участвуют в механизмах ее реализации в процессе синтеза клеточных белков. Нуклеозиды Нуклеозиды – это N-гликозиды, образованные нуклеиновыми основаниями и рибозой или дезоксирибозой. В зависимости от природы моносахаридного остатка нуклеозиды делят на рибонуклеозиды (содержат остаток рибозы) и дезоксирибонуклеозиды (содержат остаток дезоксирибозы). Названия нуклеозидов строят на основе тривиальных названий нуклеиновых оснований, добавляя окончание –идин для производных пиримидина и -озин для производных пурина. К названиям дезоксирибонуклеозидов добавляют приставку дезокси-. Исключение составляет нуклеозид, образованный тимином и дезоксирибозой, к которому приставка дезокси- не добавляется, так как тимин образует нуклеозиды с рибозой лишь в очень редких случаях. В природе нуклеозиды встречаются также в свободном состоянии, преимущественно в виде нуклеозидных антибиотиков, которые проявляют противоопухолевую активность. Нуклеозиды-антибиотики имеют некоторые отличия от обычных нуклеозидов в строении либо углеводной части, либо гетероциклического основания, что позволяет им выступать в качестве антиметаболитов, чем и объясняется их антибиотическая активность. Нуклеотиды Нуклеотиды – это эфиры нуклеозидов и фосфорной кислоты (нуклеозидфосфаты). Сложноэфирную связь с фосфорной кислотой образует ОН группа в положении 5/ или 3/ моносахарида. В зависимости от природы моносахаридного остатка нуклеотиды делят на рибонуклеотиды (структурные элементы РНК) и дезоксирибонуклеотиды (структурные элементы ДНК). Названия нуклеотидов включают название нуклеозида с указанием положения в нем остатка фосфорной кислоты. Сокращенные обзначения нуклеозидов содержат обозначение нуклеозида, остатка моно-, ди- или трифосфорной кислоты, для 3/-производных указывается также положение фосфатной группы. Нуклеотиды являются мономерными звеньями, из которых построены полимерные цепи нуклеиновых кислот. Некоторые нуклеотиды выполняют роль коферментов и участвуют в обмене веществ. Циклический нуклеотид представляет собой однофосфатный нуклеотид с расположением циклических связей между сахарной и фосфатной группами. Как и другие нуклеотиды, циклические нуклеотиды состоят из трех функциональных групп: сахара, азотистого основания и единственной фосфатной группы. Нуклеотидные коферменты Коферменты – это органические соединения небелковой природы, которые необходимы для осуществления каталитического действия ферментов. Коферменты относятся к разным классам органических соединений. Важную группу коферментов составляют нуклеозидполифосфаты. Аденозинфосфаты – производные аденозина, содержащие остатки моно-, ди- и трифосфорных кислот. Особое место занимают аденозин-5/-моно-, ди- и трифосфаты - АМФ, АДФ и АТФ - макроэргические вещества, которые обладают большими запасами свободной энергии в подвижной форме. Молекула АТФ содержит макроэргические связи Р-О, которые легко расщепляются в результате гидролиза. Выделяющаяся при этом свободная энергия обеспечивает протекание сопряженных с гидролизом АТФ термодинамически невыгодных анаболических процессов, например, биосинтез белка. Олиго- и полинуклеотиды. Олигонуклеотидами называют полимеры, в которых несколько нуклеозидов (до 20) соединены друг с другом фосфодиэфирными связями; более длинные цепи называют полинуклеотидами. 10. Строение и функции АТФ (Бикеша) Молекула АТФ или аденозинтрифосфорная кислота (аденозинтрифосфат). Как и все нуклеотиды, АТФ состоит из пятиуглеродного сахара – рибозы, азотистого основания – аденина, и, в отличие от нуклеотидов ДНК и РНК, трех остатков фосфорной кислоты Важнейшая функция АТФ состоит в том, что она является универсальным хранителем и переносчиком энергии в клетке. Все биохимические реакции в клетке, которые требуют затрат энергии, в качестве ее источника используют АТФ. При отделении одного остатка фосфорной кислоты, АТФ переходит в АДФ (аденозиндифосфат). Если отделяется ещё один остаток фосфорной кислоты (что случается в особых случаях), АДФ переходит в АМФ (аденозинмонофосфат) При отделении второго и третьего остатков фосфорной кислоты освобождается большое количество энергии, до 40 кДж. Именно поэтому связь между этими остатками фосфорной кислоты называют макроэргической и обозначают соответственным символом. При гидролизе обычной связи выделяется (или поглощается) небольшое количество энергии, а при гидролизе макроэргической связи выделяется намного больше энергии (40 кДж). Связь между рибозой и первым остатком фосфорной кислоты не является макроэргической, при её гидролизе выделяется всего 14 кДж энергии. Макроэргические соединения могут образовываться и на основе других нуклеотидов, например ГТФ (гуанозинтрифосфат) используется как источник энергии в биосинтезе белка, принимает участие в реакциях передачи сигнала, является субстратом для синтеза РНК в процессе транскрипции, но именно АТФ является наиболее распространенным и универсальным источником энергии в клетке. АТФ содержится как в цитоплазме, так и в ядре, митохондриях и хлоропластах. 11.структурная щрганизации ДНК ДНК большинства организмов – это длинная двухцепочечная полимерная молекула. Последовательность мономерных звеньев (дезоксирибонуклеотидов) в одной ее цепи соответствует (комплементарна) последовательности дезоксирибонуклеотидов в другой. Принцип комплементарности обеспечивает синтез новых молекул ДНК, идентичных исходным, при их удвоении (репликации). Участок молекулы ДНК, кодирующий определенный признак, – ген. Гены – это индивидуальные генетические элементы, имеющие строго специфичную нуклеотидную последовательность, и кодирующие определенные признаки организма. Одни из них кодируют белки, другие — только молекулы РНК. Информация, которая содержится в генах, кодирующих белки (структурных генах), расшифровывается в ходе двух последовательных процессов: синтеза РНК (транскрипции): на определенном участке ДНК как на матрице синтезируется матричная РНК (мРНК). синтеза белка (трансляции): В ходе согласованной работы многокомпонентной системы при участии транспортных РНК (тРНК), мРНК, ферментов и различных белковых факторов осуществляется синтез белковой молекулы. Все эти процессы обеспечивают правильный перевод зашифрованной в ДНК генетической информации с языка нуклеотидов на язык аминокислот. Аминокислотная последовательность белковой молекулы определяет ее структуру и функции. Строение ДНК ДНК – это линейный органический полимер. Его мономерные звенья – нуклеотиды, которые, в свою очередь, состоят из: азотистого основания; пятиуглеродного сахара (пентозы); фосфатной группы При этом, фосфатная группа присоединена к 5′-атому углерода моносахаридного остатка, а органическое основание — к 1′-атому. Основания в ДНК бывают двух типов: Пуриновые: аденин ( А ) и гуанин (G); Oсновные функции ДНК. ДНК является носителем генетической информации, что обеспечивается фактом существования генетического кода. Воспроизведение и передана генетической информации в поколениях клеток и организмов. Эта функция обеспечивается процессом репликации. Реализация генетической информации в виде белков, а также любых других соединений, образующихся с помощью белков-ферментов. Эта функция обеспечивается процессами транскрипции и трансляции. Пиримидиновые: цитозин (С) и тимин (Т) Строение нуклеотидов в молекуле ДНК В ДНК моносахарид представлен 2′-дезоксирибозой, содержащей только 1 гидроксильную группу (ОН), а в РНК — рибозой, имеющей 2 гидроксильные группы (OH). Нуклеотиды соединены друг с другом фосфодиэфирными связями, при этом фосфатная группа 5′-углеродного атома одного нуклеотида связана с З’-ОН-группой дезоксирибозы соседнего нуклеотида (рисунок 1). На одном конце полинуклеотидной цепи находится З’-ОН-группа (З’-конец), а на другом — 5′-фосфатная группа (5′-конец). Уровни структуры ДНК Принято выделять 3 уровня структуры ДНК: первичную; вторичную; третичную. Первичная структура ДНК – это последовательность расположения нуклеотидов в полинуклеотидной цепи ДНК. Вторичная структура ДНК стабилизируется водородными связями между комплементарными парами оснований и представляет собой двойную спираль из двух антипараллелных цепочек, закрученных вправо вокруг одной оси. Общий виток спирали- 3,4нм, расстояние между цепочками 2нм. Третичная структура ДНК – суперсперализация ДНК. Двойная спираль ДНК на некоторых участках может подвергаться дальнейшей спирализации с образованием суперспирали или открытой кольцевой формы, что часто вызвано ковалентным соединением их открытых концов. Суперспиральная структура ДНК обеспечивает экономную упаковку очень длинной молекулы ДНК в хромосоме. Так, в вытянутой форме длина молекулы ДНК составляет 8 см, а в форме суперспирали укладывается в 5 нм. Правило Чаргаффа Правило Э. Чаргаффа – это закономерность количественного содержания азотистых оснований в молекуле ДНК: У ДНК молярные доли пуриновых и пиримидиновых оснований равны: А+ G = C + Т или (А + G)/(C + Т)=1. В ДНК количество оснований с аминогруппами (А +C) равно количеству оснований с кетогруппами (G + Т): А +C= G + Т или (А +C)/(G + Т)= 1 Правило эквивалентности, то есть : А=Т, Г=Ц; А/Т = 1; Г/Ц=1. Нуклеотидный состав ДНК у организмов различных групп специфичен и характеризуется коэффициентом специфичности: (Г+Ц)/(А+Т). У высших растений и животных коэффициент специфичности меньше 1, и колеблется незначительно: от 0,54 до 0,98, у микроорганизмов он больше 1. Вопросы: 1) Где расположена ДНК? Расположена в ядре, митохондриях, хлоропластах. 2) Как связаны азотистые основания между собой? Связаны водородными связями. 3) Сходство и различие ДНК и РНК  12. Суперспирализация ДНК. Гистоны и строение хроматина. Типы связей, стабилизирующих уровни структурной организации ДНК. (мб Полина Г) СУПЕРСПИРАЛИЗАЦИЯ ДНК — структурная форма двуцепочечной молекулы ДНК, в которой она образует супервитки, пересекая при этом собственную ось. Суперспирализованная ДНК обладает большой энергией. В нормальных условиях в ДНК образуются только отрицательные супервитки, которые закручивают ДНК вокруг ее оси против часовой стрелки, т.е. в направлении, противоположном правосторонней двойной спирали. Имея форму суперспирали, ДНК в большей степени подвержена структурным изменениям. Гистоны и строение хроматина. Хроматин — это вещество хромосом — комплекс ДНК, РНК и белков. Хроматин находится внутри ядра клеток эукариот и входит в состав нуклеоида у прокариот. Именно в составе хроматина происходит реализация генетической информации, а также репликация и репарация ДНК. Основную массу хроматина составляют белки гистоны. Гистоны являются компонентом нуклеосом, — надмолекулярных структур, участвующих в упаковке хромосом. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Связи, стабилизирующие двойную спираль ДНК: 1 Водородные связи между комплементарными парами азотистых оснований. Между аденином и тимином могут образовываться две, а между гуанином и цитозином – три водородных связи (рис. 10). Комплементарные пары азотистых оснований одинаковы по размерам и форме, обращены внутрь молекулы ДНК и лежат в одной плоскости (рис. 11). 2 Между основаниями в ДНК возникают гидрофобные взаимодействия, обеспечивающие стабилизацию структуры спирали. 3 Стэкинг-взаимодействие – взаимодействие π-облаков азотистых оснований вдоль оси молекулы ДНК. Денатурация, ренатурация ДНК. Растворы ДНК при pH 7,0 и комнатной температуре (около 20-25 °С) обладают высокой вязкостью. Если раствор нагреть до 80 °С или сильно изменить pH, то вязкость раствора резко упадет. Этот факт указывает на изменение физического состояния ДНК. Высокая температура и экстремальное значение pH вызывают денатурацию ДНК, подобную денатурации белков. ДНК в клетке термодинамически стабильна и спирализована, однако некоторые её области подвергаются «плавлению» (т.е. двойная спираль разматывается) из-за происходящих процессов репликации, транскрипции, репарации и рекомбинации. Полное расплетение цепей и их разделение называют денатурацией. Двухцепочечная ДНК может быть денатурирована воздействием высоких температур или хаотропных агентов, таких как мочевина или гуанидин хлорид. Денатурация ДНК приводит к расплетанию двухцепочечной структуры, разрушая водородные связи между спаренными основаниями и гидрофобные взаимодействия, удерживавшие структуру двойной спирали. В результате образуются одноцепочечные хаотические клубки. Температура, при которой половина молекулы ДНК подверглась денатурации, называется точкой плавления Tm. Степень денатурации можно измерить с помощью абсорбции ультрафиолетовых лучей. Одноцепочечные ДНК при длине волны 260 нм поглощают 12-40% света.(гипохромный эффект) Разумеется, области, богатые парами A = T быстрее подвергаются плавлению, чем Г ≡ Ц участки. Ренатурацией называется процесс восстановления нативной конформации ДНК. Ренатурация происходит самопроизвольно при охлаждении раствора, в котором содержатся диссоциировавшие цепи ДНК. При отжиге нити ДНК "отыскивают" комплементарные участки друг у друга и, в конце концов, вновь сворачиваются в двойную спираль. 14. Основные виды РНК, их функции и локализация в клетке. (Диана) РНК – биополимер, мономерами которого являются рибонуклеотиды. Рибонуклеиновые кислоты представлены одной полинуклеотидной цепью, которая состоит из четырех разновидностей нуклеотидов, содержащих сахар, рибозу, фосфат и одно из четырех азотистых оснований — аденин, гуанин, урацил или цитозин. РНК синтезируется на молекулах ДНК при помощи ферментов РНК-полимераз с соблюдением принципа комплементарности и антипараллельности, причем аденину ДНК в РНК комплементарен урацил. Все многообразие РНК, действующих в клетке, можно разделить на три основных вида: мРНК (информационная или матричная), тРНК (транспортная), рРНК (рибосомная). Основная функция РНК – перенос генетической информации от ДНК на белки. Матричная или информационная РНК – это копия определенного участка ДНК выполняет роль переносчика генетической информации от ДНК на рибосому и участвует в сборке молекул белка. Локализуется в митохондриях, ядре, цитоплазме, хлоропластах. Транспортная РНК – переносят аминокислоты из цитоплазмы на рибосому. Локализация в цитоплазме. Рибосомная РНК – входя в состав рибосом обеспечивает определенное пространственное внутрирасположение иРНК и тРНК, участвует в синтезе белка. Локализуется в ядре и цитоплазме. Функция: реализация наследственной информации. --------------------------------------------------------------------------------- Практика 3 Ферменты. Их роль в живой природе Ферменты – биологические катализаторы белковой природы. Термин фермент был предложен в начале 17 века голландским ученым Ван Гельмонтом для веществ, влияющих на спиртовое брожение. |
