5fan_ru_Функциональные группы органических лекарственных средств. Контрольная работа Функциональные группы органических лекарственных средств
 Скачать 202 Kb. Скачать 202 Kb.
|
Контрольная работа Функциональные группы органических лекарственных средств Введение Большинство лекарственных средств, используемых в медицинской практике, являются органическими соединениями. Подлинность таких веществ подтверждают с помощью реакций на функциональные группы. Функциональной группой называют реакционно-способный атом, группу атомов или реакционный центр в молекуле органического соединения. Общим принципом функционального анализа является применение характерных реакций для групп, подлежащих определению. Реакция должна быть не только возможно более специфичной, но и достаточно быстрой, и в ней должны участвовать реагент или продукт реакции, легко поддающиеся определению.   1. Идентификация спиртового гидроксила. Спирты – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами. В общем виде молекулу спирта можно представить как ROH. 1.1. Реакция образования сложных эфиров. Спирты образуют с органическими кислотами или ангидридами кислот в присутствии водоотнимающих средств (например, серная кислота концентрированная) сложные эфиры. Сложные эфиры, полученные на основе низкомолекулярных спиртов, обладают характерным запахом, а сложные эфиры на основе высокомолекулярных спиртов являются кристаллическими веществами, имеющими четкую температуру плавления. Методика. К 1 мл этанола прибавляют 5 капель ледяной уксусной кислоты, 0,5 мл концентрированной серной кислоты и осторожно нагревают; обнаруживается характерный запах этилацетата (свежих яблок).  1.2. Реакция окисления спиртов до альдегидов. Образующиеся альдегиды обнаруживают по запаху. В качестве окислителей используют калия гексациано-(Ш)-феррат, калия перманганат, калия дихромат и др. Методика. В первую пробирку помещают 2 капли этанола, 1 каплю 10%-го раствора серной кислоты и 2 капли 10%-го раствора дихромата калия. Полученный раствор имеет оранжевую окраску. Нагревают его над пламенем, пока раствор не начнет приобретать синевато-зеленую окраску (одновременно ощущается характерный запах уксусного альдегида, напоминающий запах антоновских яблок). Вносят 1 каплю полученного раствора во вторую пробирку с 3 каплями фуксинсернистой кислоты. Появляется розово-фиолетовое окрашивание.  1.3. Реакция образования комплексных соединений.Многоатомные спирты образуют с сульфатом меди в щелочной среде (с реактивом Фелинга) комплексные соединения синего цвета. Методика. К 0,5 мл глицерина прибавляют по 5 капель растворов натрия гидроксида и меди (II) сульфата, появляется интенсивное синее окрашивание.  2. Идентификация фенольного гидроксила 2.1. Реакция с железа (111) хлоридом.Характерной качественной реакцией на фенолы является реакция с железа (III) хлоридом. В зависимости от количества фенольных гидроксилов, наличия в молекуле фенола других функциональных групп, их взаимного расположения, рН среды, температуры, образуются комплексные соединения различного состава и окраски. Методика. К 0,01 г препарата, растворенного в 1 мл воды (для фенола, резорцина) добавляют 2 капли раствора железа (III) хлорида - наблюдается характерное окрашивание (табл. 1.).  Таблица 1. Окраска комплексов препаратов с железа (III) хлоридом
С помощью раствора аммиака можно отличить фенол от резорцина. Окраска комплекса резорцина с железом после добавления реактива изменяется до буровато-желтой. 2.2. Реакции электрофильного замещения. Гидроксильная группа, связанная с атомом углерода бензольного ядра в щелочном растворе - сильнейший орто-пара-ориентант. В связи с этим у препаратов, содержащих фенольный гидроксил, легко протекают следующие реакции. 2.2.1. Нитрование. Фенолы нитруются разбавленной кислотой азотной при комнатной температуре с образованием о- и n- нитрофенола. Методика. К 0,001 г препарата, растворенного в 2 мл воды, добавляют 1-2 мл разведенной кислоты азотной и нагревают на водяной бане. Постепенно появляется желтое окрашивание. 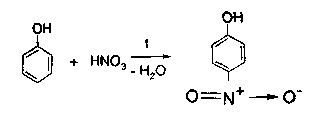 Добавление раствора натрия гидроксида усиливает окраску вследствие образования хорошо диссоциируемой соли: 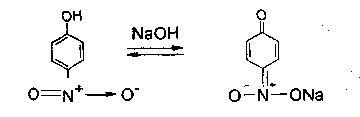 2.2.2. Реакция бромирования. При бромировании бромной водой производных фенолов образуются белые или желтые осадки бромпроизводных. Методика. 0,05 г лекарственного средства растворяют в 2 мл воды (салициловая кислота, салициламид, фенилсалицилат в 95% спирте), прибавляют по каплям бромную воду. Выпадает белый осадок. Если бромирование фенола вести бромной водой, то образуется белый осадок 2,4,6-трибромфенола. 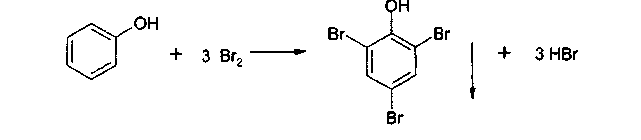 2.2.3. Реакция сочетания фенолов с солью диазония в щелочной среде. При взаимодействии фенолов с солью диазония образуется азокраситель. Сочетание идет в о- и n-положениях по отношению к фенольному гидроксилу в щелочной среде (рН 9,0-10,0). Методика. К 0,05 г препарата, растворенного в 5 мл воды (синэстрол растворяют в 5 мл 95% спирта; 0,05 г кислоты салициловой растворяют в 1 мл 4% раствора натрия гидроксида), добавляют 1 мл диазореактива. Появляется красное или оранжево-красное окрашивание (табл. 2). При добавлении 0,5 г натрия ацетата образуется желтый осадок.  Таблица 2. Обнаружение фенолов по окраске азосочетания
2.3. Реакции окисления. Присутствие гидроксильной группы, связанной с ядром, резко изменяет отношение ароматического ядра к окислителям. Фенолы окисляются легко, причем образуется смесь разных продуктов окисления. Примером реакции окисления является индофеноловая проба. 2.3.1. Индофеноловая проба. Проба проводится в растворе аммиака при взаимодействии с такими окислителями, как хлорамин, хлорная известь, бромная вода. Индофенол — амфотерное соединение, способное образовывать хорошо диссоциируемые окрашенные соли как с кислотой, так и с основанием. Окраска индофенола также зависит от заместителей и количества фенольных гидроксилов. Реакция используется для дифференциации препаратов данной группы. Методика. 0,05 г препарата растворяют в 0,5 мл раствора аммиака и добавляют 3-4 капли раствора хлорамина. Нагревают смесь на кипящей водяной бане. Через несколько минут появляется окрашивание, изменяющееся от добавления кислот (табл. 3).  Таблица 3. Окраска индофенола
2.4. Реакции электрофильного замещения в сочетании с окислением. В связи с этим у препаратов, содержащих фенольный гидроксил, выделяют следующие реакции. 2.4.1. Реакции конденсации с альдегидами (с реактивом Марки). При нагревании фенолов с реактивом Марки (раствором формальдегида в концентрированной серной кислоты) образуются бесцветные продукты конденсации, при окислении которых получаются интенсивно окрашенные соединения хиноидной структуры. Серная кислота играет в данной реакции роль дегидратирующего, конденсирующего средства и окислителя. Методика. 10 мг препарата помещают на часовое или предметное стекло и добавляют 3 капли реактива Марки. При стоянии появляется красное окрашивание.  2.4.2. Нитрозирование (нитрозореакция Либермана). Реакция нитрозирования является разновидностью индофеноловой реакции:  Хиноксим взаимодействует с фенолом, находящимся в реакционной смеси, с образованием индофенола: 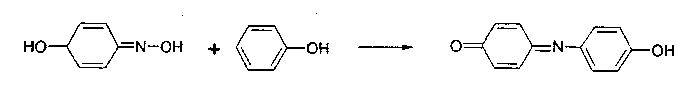 Методика. 0,01 г препарата помещают на предметное стекло, смачивают 2-3 каплями 1% раствора натрия нитрита в концентрированной кислоте серной. Наблюдается окрашивание, изменяющееся при добавлении раствора щелочи (табл. 4.). Таблица 4. Окраска индофенола
3. Идентификация простой эфирной связи 3.1. Реакции образования оксониевых солей с кислотой серной концентрированной. Методика. На часовое стекло или фарфоровую чашку наносят 3-4 капли кислоты серной концентрированной и прибавляют 0,05 г димедрола, появляется желто-оранжевое окрашивание, постепенно переходящее в кирпично-красное. При добавлении воды окраска исчезает.  4. Идентификация альдегидной группы 4.1. Реакции окисления альдегидов.Альдегиды превращаются в кислоты под влиянием окислителей. Они восстанавливают из растворов солей многие металлы (например, катионы Ag, Cu, Hg и др.), особенно в присутствии щелочи. Комплексные соединения этих металлов позволяют применять их в щелочной среде в виде растворов, из которых при действии на них альдегидов выделяются характерные осадки различного цвета. 4.1.1. Реакция с аммиачным раствором серебра нитрата (реакция «серебряного зеркала»). Методика. К 2 мл раствора нитрата серебра прибавляют 10% раствор аммиака ( 0,5 мл) до растворения образующегося при постепенном приливании раствора аммиака осадка, затем доливают раствор, содержащий 0,01-0,005 г вещества, при осторожном нагревании (лучше на водяной бане при температуре 50-60 °С); выделяется металлическое серебро.  4.1.2. Реакция с реактивом Фелинга. Методика. К 2 мл раствора, содержащего около 0,01-0,005 г вещества, приливают 5 мл раствора Фелинга, нагревают до кипения; образуется красно-оранжевый осадок. 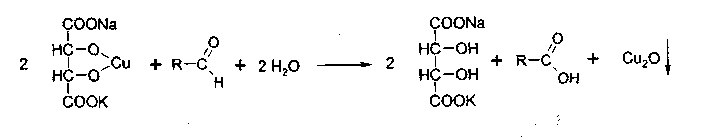 4.1.3. Реакция с реактивом Несслера Методика. К 2-3 каплям раствора альдегида прибавляют 2-3 капли реактива Несслера и нагревают. Выделяется бурый осадок металлической ртути. 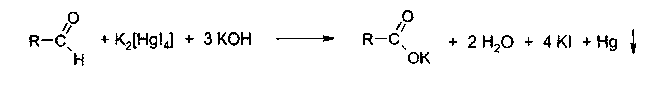 4.2. Реакция нуклеофильного присоединения-отщепления. В качестве реагентов используются первичные амины (образуются основания Шиффа); гидрохлорид гидроксиламина (образуются оксимы). Методика. К 1 мл раствора альдегида прибавляют 1 мл щелочного раствора гидроксиламина гидрохлорида. Постепенно выпадает осадок оксима. 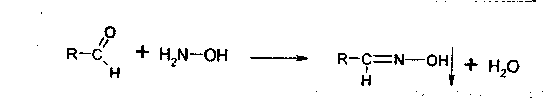 . .4.3. Реакции конденсации. Альдегиды в среде кислоты серной конденсируются с фенолами, образуются окрашенные хиноны. 4.3.1. Реакция с кислотой салициловой См. методику 2.4.1. 5. Идентификация карбоксильной группы. 5.1. Реакция диссоциации – кислая среда 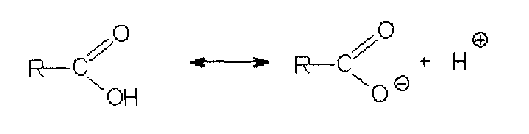 (метилоранж окрашивается в розовый цвет, лакмусовая бумага розовеет) 5.2. Реакция образования сложных эфиров (этерификация). См. раздел 1.1.  Общий вид реакции: Например, кислота бензойная образует сложный эфир (этилбензоат) в присутствии концентрированной серной кислоты. 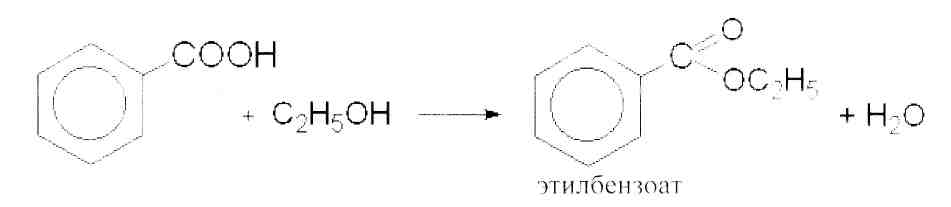 5.3. Реакция с солями тяжелых металлов При этом образуются: серебряные соли белого цвета; ртутные - серого цвета; соли железа (Ш) -розовато-жёлтого цвета - и др.; соли меди (П) - голубого или синего цвета; кобальтовые - сиреневого или розового цветов. Методика: К 5 мл теплого раствора никотиновой кислоты (1:100) приливают 1 мл раствора ацетата меди или сульфата меди, выпадает осадок синего цвета.  На бензоаты: с раствором хлорида окисного железа (III) образуется розовато-желтый осадок. Методика. Препарат растворяют в щелочи, взбалтывают, разбавляют водой, фильтруют. К фильтрату прибавляют раствор хлорида окисного железа, образуется:  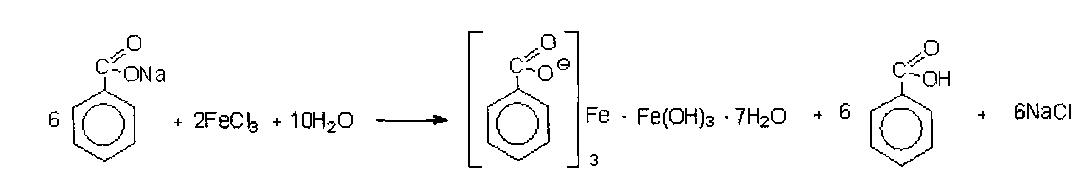 На салицилаты: раствором хлорида окисного железа (III) образуется фиолетовое окрашивание. 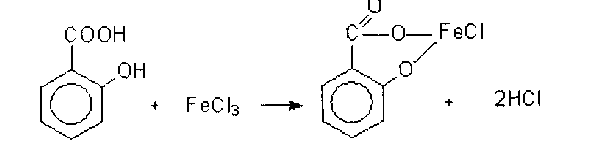 6. Идентификация сложноэфирной группы. 6.1. Реакции гидролиза. Препараты, содержащие в своей структуре сложноэфирную группу, подвергаются щелочному или кислотному гидролизу. 6.1.1. Реакции щелочного гидролиза. Под действием щелочей образуется соль органической кислоты и спирт. Методика. 0,05 г анестезина нагревают с 5 мл раствора едкого натра и приливают 0,1 н. раствор йода до неисчезающего желтого окрашивания; появляется запах йодоформа. 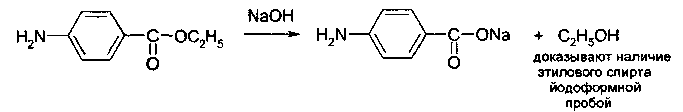 6.1.2. Реакции кислотного гидролиза. Под действием кислоты образуется органические кислоты. Методика. 0,2 г кислоты ацетилсалициловой помещают в фарфоровую чашку, добавляют 0,5 мл концентрированной кислоты серной, перемешивают и добавляют 1-2 капли воды; ощущается запах кислоты уксусной. Затем добавляют 1-2 капли формалина; появляется розовое окрашивание. 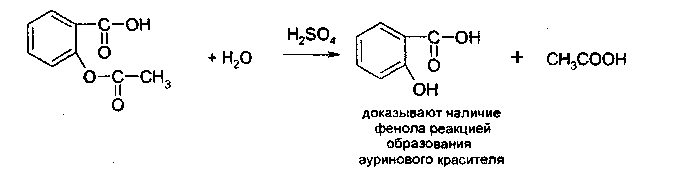 6.2. Гидроксамовая реакция.При взаимодействии с гидроксиламином в щелочной среде образуются гидроксамовые кислоты, которые после подкисления кислотой хлороводородной образуют окрашенные гидроксаматы с солями железа (III) или меди (II). Методика. 0,1 г новокаина растворяют в 2 мл воды, прибавляют 2 мл щелочного раствора гидроксиламина, встряхивают 5 мин, прибавляют 2 мл разведенной кислоты хлороводородной и 0,5 мл 10% раствора железа (III) хлорида. Появляется вишневое окрашивание. 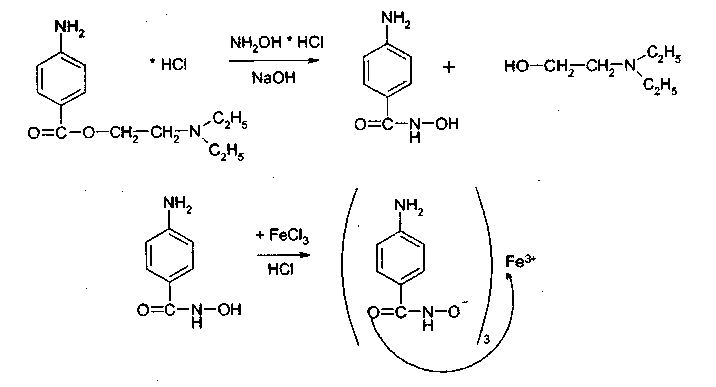 7. Идентификация лактонов. Лактонами называются внутренние сложные эфиры. 7.2. Гидроксамовая реакция. Методика: 0,02 г препарата (пилокарпин) растворяют в 3 мл спирта 95%, прибавляют 1 мл щелочного раствора гидроксиламина, встряхивают, ставят на водяную баню на 5 минут. Затем добавляют 2 мл кислоты хлористоводородной разведенной, 0,5 мл 10% раствора железа (III) хлорида в 0,1 моль/л растворе кислоты хлористоводородной. Появляется красное или красно-фиолетовое окрашивание. 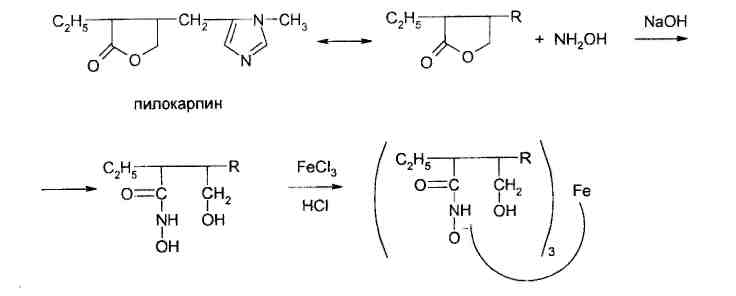 8. Идентификация первичной ароматической аминогруппы. 8.1. Реакция диазотирования с последующим азосочетанием (реакция образования азокрасителя).Общим свойством первичных ароматических аминов является способность к образованию соли диазония и азокрасителей. Реакция образования соли диазония проводится с натрия нитритом в кислой среде. Ионы диазония, обладающие электрофильными свойствами, вступают с ароматическими соединениями (с фенолами или ароматическими аминами) в реакцию электрофильного замещения с образованием азокрасителя. Реакция диазотироеания с последующим азосочетанием включены в раздел «Общие реакции на подлинность» ГФ XI и широко используются в внутриаптечном контроле. Методика. 0,05 г препарата растворяют в 1 мл разведенной хлористоводородной кислоты, если необходимо, нагревают, охлаждают во льду, прибавляют 2 мл 1% раствора нитрита натрия; полученный раствор прибавляют к 1 мл щелочного раствора β-нафтола, содержащего 0,5 г ацетата натрия; образуется осадок от желто-оранжевого до оранжево-красного цвета.  9. Идентификация имидной группы 9.1. Реакция образования солей с тяжелыми металлами.Многие лекарственные вещества содержат в своей молекуле имидную группу, например, все сульфаниламидные препараты, производные барбитуровой кислоты, производные пурина (теофиллин, теобромин) и др.  Для всех этих соединений характерны реакции с солями тяжелых металлов с образованием окрашенных солей. Методика. 0,05 г препарата (если он нерастворим в воде, т.е. кислые формы) переводят в соли добавлением 0,1 н. раствора щелочи до едва заметного голубоватого окрашивания раствора (индикатор тимолфталеин) или приготавливают насыщенный раствор препарата в 0,1 н. растворе щелочи. После встряхивания полученной смеси ее фильтруют. Фильтрат нейтрализуют 0,1 н. раствором соляной кислоты до слабо-голубого окрашивания (индикатор - тимолфталеин). Полученный раствор разливают в три пробирки и в каждую прибавляют по 2-Зкапли растворов хлорида окисного железа, хлорида кобальта и сульфата меди соответственно. Образующиеся при этом окрашенные растворы или осадки приведены в табл. 5. Таблица 5. Цветные реакции сульфаниламидных препаратов с солями тяжелых металлов.
Список литературы
. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
