лекция 2. Цель лекции
 Скачать 126.87 Kb. Скачать 126.87 Kb.
|
|
ЛЕКЦИЯ 2. Основы молекулярной генетики. Биосинтез белков и его регуляция Цель лекцииОзнакомиться с понятием трансляции (биосинтеза белка). Уметь интерпретировать информацию о биосинтезе белка для объяснения адаптации организма к изменяющимся условиям среды и решения вопросов лечения и профилактики опухолевых и инфекционных болезней. План лекции1. Генетический код и его свойства. 2. Основные этапы биосинтеза белка: инициация, элонгация, терминация. Посттрансляционная модификация белков. 3. Общая теория регуляции синтеза белка по Ф. Жакобу и Ж. Моно. Ингибиторы синтеза белка. Механизм действия дифтерийного токсина на биосинтез белка. 1. Генетический код и его свойства1.1 Генетический код - это система записи информации о последовательности расположения аминокислот в белках с помощью последовательности расположения нуклеотидов в ДНК. Генетическая информация, закодированная в ДНК, сначала транскрибируется на мРНК, а затем транслируется в цепочку аминокислот. Отрезок мРНК, кодирующий последовательность аминокислот в белке, считывается триплетами (кодонами), каждый из которых кодирует одну аминокислоту. Синтез белка отличается от других матричных биосинтезов тем, что между матрицей (мРНК) и продуктом-белком нет комплементарного соответствия. Поскольку матрица построена из 4 нуклеотидов, а продукт - полипептидная цепь из 20 аминокислот, то существует определенный закон шифрования аминокислот в нуклеотидной последовательности матрицы, т.е. генетический код (рис. 6). 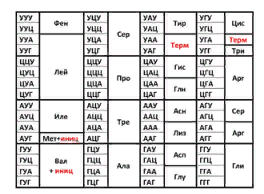 Рис. 6. Таблица генетического кода 1.2 Свойства генетического кода · Триплетность — значащей единицей кода является сочетание трёх нуклеотидов (триплет, или кодон). · Непрерывность — между триплетами нет знаков препинания, то есть информация считывается непрерывно. · Неперекрываемость — один и тот же нуклеотид не может входить одновременно в состав двух или более триплетов. · Специфичность — определённый кодон соответствует только одной аминокислоте (однако, кодон UGA у Euplotes crassus кодирует две аминокислоты — цистеин и селеноцистеин). · Вырожденность — одной и той же аминокислоте может соответствовать несколько кодонов. · Универсальность — биологический код одинаков для всех видов организмов на Земле (однако в митохондриях млекопитающих есть исключения). · Знаки препинания — триплеты выполняют функцию знаков препинания. 2. Основные этапы биосинтеза белка: инициация, элонгация, терминация. Посттрансляционная модификация белковОсновными компонентами синтеза белкаявляются: аминокислоты, тРНК, аминоацил-тРНК-синтетазы, мРНК, рибосомы, источники энергии, белки - факторы инициации, элонгации и терминации и кофакторы (табл. 1). Таблица 1 Основные компоненты белоксинтезирующей системы и их функции в процессе трансляции
Биосинтез белка у всех организмов происходит в 5 сновных стадий: 1.Активация аминокислот. 2.Инициация. 3.Элонгация. 4.Терминация и диссоциация рибосом. 5.Фолдинг и посттрансляционный процессинг. 2.1 Активация аминокислот тРНК выполняет адапторную роль, которая заключается: 1) в специфичном связывании с аминокислотами, 2) во включении аминокислот в белковую цепь в соответствии с матрицей мРНК. Избирательное присоединение аминокислоты к тРНК осуществляется ферментом аминоацил-тРНК-синтетазой (рис. 7):  Рис. 7. Реакция активации аспартата, катализируемая аспарагил-тРНК-синтетазой 2.2 Инициация трансляции Инициация начинается с присоединения к мРНК в области «кэпа» малой субъединицы рибосомы 40S, факторов инициации (IF), инициирующей Мет-тРНКМет и ГТФ. Когда в результате движения этого комплекса по мРНК антикодон Мет-тРНКМет свяжется с инициирующим кодоном АUG, комплекс останавливается. Происходит присоединение 60S-субъединицы рибосомы, сопровождающееся гидролизом ГТФ и отделением факторов инициации. Формируется 80S-рибосома с двумя активными центрами: Р (пептидильным) центром, в котором находится Мет-тРНКМет, и А(аминоацильным) центром, в область которого поступает первый смысловой кодон мРНК (рис. 8.). 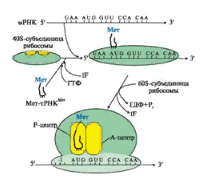 Рис. 8. Инициация белкового синтеза 2.3. Элонгация трансляции Стадия элонгации включает три последовательных этапа: 1) связывание аа-тРНКаа в А-центре, 2) образование пептидной связи, 3) транслокация (рис. 9). 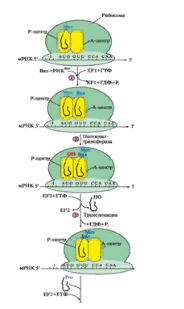 Рис. 9. Элонгация полипептидной цепи: 1 - связывание аа-тРНКаа в А-центре требует затраты энергии ГТФ и участия фактора элонгации EF1 (на схеме аа-тРНКаа - Вал-тРНКВал); 2 - образование пептидной связи катализирует пептидилтрансфераза, активный центр которой формируется рРНК, входящей в состав большой субъединицы рибосомы; 3 - перемещение рибосомы по мРНК на один кодон в направлении от 5'- к 3'-концу идет с использованием энергии ГТФ (транслокация) и при участии фактора EF2. 2.4 Терминация трансляции Терминация трансляции происходит после включения в А-центр одного из стоп кодонов: UAG, UGA, UAA (рис. 10). 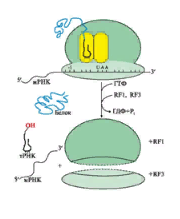 Рис.10. Терминация синтеза белка 3. Общая теория регуляции синтеза белка по Ф. Жакобу и Ж. Моно. Ингибиторы синтеза белка. Механизм действия дифтерийного токсина на биосинтез белкаМеханизм регуляции генетического кода был открыт французскими учеными Ф. Жакобом и Ж. Моно в 1961 г. на бактериях. E. coli и получил название механизма индукции-репрессии. В основе теории лежат следующие понятия: -оперон– группа тесно связанных между собой генов, которые программируют образование структурных белков и ферментов в клетке, - конституитивные гены – те, которые активны в клетках всегда, независимо от ее активности, -индуцибельныегены – те, которые считываются при необходимости, -ген-регулятор– ген, регулирующий работу оперона, но не входящий в его состав. Он синтезирует белок-регулятор (чаще называемый белок-репрессор), который может быть в активной или неактивной форме, -ген-оператор– участок ДНК, способный связываться с белком-регулятором, и "решающий" нужно работать РНК-полимеразе или нет. Если оперон регулируется по механизму индукции (например, лактозный оперон), то в отсутствии индуктора (лактозы) белок-репрессор связан с оператором. Комплекс белок-репрессор-оператор препятствует связыванию РНК-полимеразы с промотором, и транскрипция структурных генов оперона не идет. Когда концентрация индуктора в клетке возрастет, то он присоединится к белку-репрессору, который имеет центр для связывания индуктора, изменяет его конформацию и снижает сродство к оператору. Комплекс индуктор-белок-репрессор теряет сродство к ДНК и уходит в цитозоль клетки. РНК-полимераза связывается с промотором и транскрибирует структурные гены. Идет синтез белков, закодированных в данном опероне. Лекарственная регуляция Ингибирование 1. Гетероциклические соединения доксорубицин, дауномицин и актиномицин D обладают способностью встраиваться между нитей ДНК между двумя соседними парами оснований Г-Ц, препятствуя движению РНК-полимеразы. 2. Рифампицин связывается с β-субъединицей РНК-полимеразы прокариот и ингибирует ее. Благодаря такой избирательности действия рифампицин действует только на бактерии и является препаратом для лечения туберкулеза. 3. α-Аманитин, октапептид бледной поганки (Amanita phalloides) блокирует РНК-полимеразу II эукариот и предотвращает продукцию мРНК. 4. Энтеротоксин возбудителя дифтерии Сorynebacterium diphteriae ингибирует синтез белков в клетках слизистой оболочки зева и гортани. В цитоплазме клеток под влиянием протеолитических ферментов токсин расщепляется на два фрагмента, один из которых является АДФ-рибозилтрансферазой. Этот фермент катализирует реакцию: FE-2 + NAD → АДФ-рибозил-FE-2 + никотинамид + Н+ Субстратом реакции является фактор элонгации FE-2, модификация которого нарушает транслокацию рибосом, прекращает биосинтез белков в инфицированных клетках и вызывает их гибель. Активация Активация транскрипции используется в клинике намного реже и заключается в применении аналогов стероидных гормонов для достижения анаболического эффекта в органе-мишени. |
