1. Биотехнология растительных тканей
 Скачать 488.95 Kb. Скачать 488.95 Kb.
|
1 2 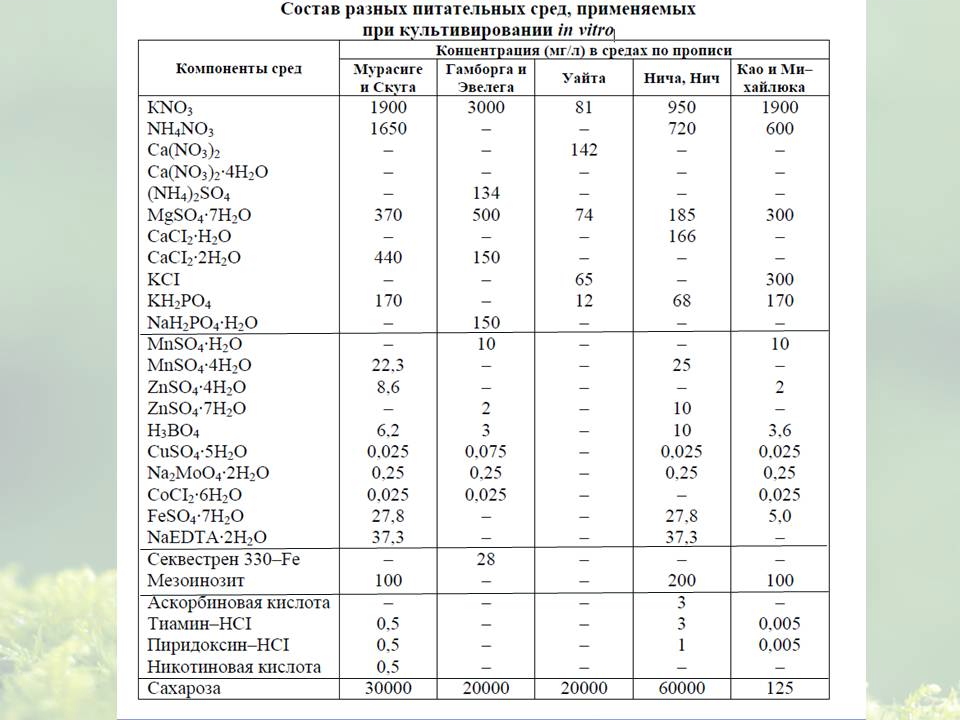 9. Модель Миллера- Скуга. О роли гормонов в клеточной и тканевой культуре. В 1955 г. Скуг и Миллер предложили гипотезу гормональной регуляции в культуре клеток и тканей, которая сейчас известна, как правило Скуга-Миллера: если концентрация ауксинов и цитокининов в питательной среде относительно равны или концентрация ауксинов незначительно превосходит концентрацию цитокининов, то образуется каллус; если концентрация ауксинов значительно превосходит концентрацию цитокининов, то формируются корни; если концентрация ауксинов значительно меньше концентрации цитокининов, то образуются почки, побеги. Фитогормоны способны изменять проницаемость клеточных мембран. Под действием ауксинов и гиббереллинов усиливается выброс протонов из клетки, что приводит к подкислению клеточной стенки и ослаблению связей между целлюлозными фибриллами в результате частичного кислотного гидролиза пектиновых веществ. Поэтому клеточная стенка становится более эластичной и под действием тургорного давления вакуоли клетка приобретает способность к растяжению. Фитогормоны – это биологические регуляторы роста и развития растений, осуществляющие взаимодействие клеток, тканей и органов, стимулирующие и ингибирующие морфогенетические и физиологические процессы в растительных организмах. Фитогормоны влияют на деление и рост клеток растяжением, состояние покоя, созревание, старение, формирование пола, устойчивость к стрессу, тропизмы, транспирацию; обеспечивают функциональную целостность растительного организма, закономерную последовательность фаз индивидуального развития. По химической природе гормоны растений четко подразделяются на две группы: производные мевалоновой кислоты (гиббереллины, абсцизины, брассины, фузикокцин, цитокинины), производные аминокислот (ауксины –из триптофана, этилен – из метионина и аланина). Биосинтез фитогормонов происходит в определенных частях растений: в апексах побегов образуется ИУК– индолил-3-уксусная кислота, лист служит донором ключевого продукта синтеза гиббереллинов – каурена, а также абсцизовой кислоты, в апексах корней синтезируется кинетин, а в зоне растяжения корня – гиббереллины, источником зеатина является эндосперм прорастающих семян. По функциональному действию различают 5 основных групп фитогормонов: ауксины, цитокинины, гиббереллины, абсцизины и этилен. Ауксины в культуре тканей вызывают рост клеток растяжением, в больших концентрациях – деление клеток, в сочетании с цитокининами – органогенез. В биотехнологии применяют как природные ауксины (ИУК), так и синтетические [ИМК (индолил-З-масляная кислота), ИПК (индолил-З-пропионовая кисло-та), 2,4-Д (2,4-дихлорфеноксиуксусная кислота), НУК(нафтилуксусная ки-слота)]. Цитокинины в сочетании с ауксинами индуцируют митозы, пролиферацию клеток, почек и побегов. К природным цитокининам относятся: зеатин, кинетин (6-фурфуриламинопурин), NN-дифенилмочевина (кокосовое молоко); к синтетическим – 6-БАП (6-бензиламинопурин). Гиббереллины стимулируют рост клеток растяжением, а также синтез ауксинов и цитокининов. Сейчас известно около 60 видов гиббереллинов. В культуре ткани используется гибберелловая кислота. Абсцизины (АБК – абсцизовая кислота) и этилен ингибируют ростовые процессы, деление клеток, в сочетании с цитокининами и хлорхолинхлоридом индуцируют органогенез (образование микроклубней). Гормональная система тесно связана с генетическим аппаратом клетки. Фитогормоны не только влияют на степень метилирования ДНК и таким образом регулируют экспрессию генов, но и связываются с белками – репрессорами на опероне, что приводит к активации структурных генов и синтезу определенных ферментов. Следовательно, изменяя соотношение гормонов в питательных средах, можно в какой-то степени изменять и генетические программы клеток и тканей. Эти процессы известны как дедифференциация, ре-дифференциация и дифференциация клеток и тканей. В растении фитогормоны находятся в тесном взаимодействии друг с другом: ИУК индуцирует синтез этилена и цитокининов, ГК увеличивает содержание ИУК, цитокинины усиливают синтез МУК, но снижают содержание свободной АБК, этилен тормозит транспорт ИУК и увеличивает содержание АБК. В культуре ткани фитогормоны, добавленные в различных пропорциях, регулируют синтез эндогенных гормонов растений, что проявляется в разнообразных морфогенетических реакциях клеток и тканей. 10. Условия культивирования клеток и тканей in vitro (освещение и температура). На рост и развитие растительных тканей in vitro большое влияние оказывают физические факторы – свет, температура, аэрация, влажность. Большинство каллусных тканей могут расти в условиях слабого освещения или в темноте, так как они не способны фотосинтезировать. Вместе с тем свет может выступать как фактор, обеспечивающий морфогенез и активирующий процессы вторичного синтеза. В качестве источника света используют люминесцентные лампы. Для большинства травянистых растений оптимум освещённости составляет 1000 люкс, низкая (300 люкс) или высокая (3000–10000 люкс) освещённость подавляет рост. Освещение может влиять на метаболизм каллусных клеток. Так, в культурах чайного растения под действием света увеличивался биосинтез полифенолов, а в культуре клеток Scopolia parviflora свет подавлял образование алкалоидов. Кроме интенсивности освещённости на культуру ткани и её физиологические особенности влияет качество света. Так, более 20 флавонов и флавоновых гликозидов образуется в культурах клеток петрушки после освещения её непрерывным люминисцентным светом «холодный белый», а синтез других флавоновых гликозидов активируется при последовательном облучении ультрафиолетовым светом, а затем светом, лежащим в области «красный – длинноволновый красный». Для большинства каллусных культур оптимальна температура 26оС, но каллусы и культуры клеток диоскореи дельтавидной хорошо растут даже при температуре 32оС. В отличие от роста культур клеток и тканей индукция их морфогенеза требует более низких температур (18–20оС). Так, в каллусных культурах максимальное образование алкалоидов наблюдалось при температуре 25оС, а при повышении температуры резко снижалось. В суспензионных культурах клеток Ipomoea содержание жирных кислот значительно увеличивалось, если их выращивали при субоптимальных температурах роста (15оС). Поэтому при выращивании культуры in vitro необходимо тщательно изучать влияние всех абиотических факторов, в том числе температурного на рост и метаболизм клеток. Для выращивания суспензионных культур большое значение имеет аэрация. Особенно важно снабжение воздухом культивируемых клеток в больших объемах ферментеров. При сравнении разных типов ферментеров было показано, что синтезвторичных метаболитов в суспензионной культуре был наибольшим при подаче воздуха снизу. При выращивании клеток в малых объемах (в колбах) нормальная аэрация достигается при постоянном перемешивании суспензии. Оптимальная влажность в помещении, где растут культуры, должна составлять 60–70%. Таким образом, культивирование клеток и тканей зависит от многих факторов внешней среды. Поэтому при введении в культуру нового вида растений необходимо, прежде всего, тщательно изучить влияние физических факторов на рост и физиологические характеристики этой культуры. 11. Размножение растений in vitro активацией пазушных меристем. Методы клонального микроразмножения Существует много методов клонального микроразмножения, а также различных их классификаций. Согласно одной из них, предложенной Мурасиге в 1977 году, процесс можно осуществлять следующими путями: 1. Активация пазушных меристем. 2. Образование адвентивных побегов тканями экспланта. 3. Возникновение адвентивных побегов в каллусе. 4. Индукция соматического эмбриогенеза в клетках экспланта. 5. Соматический эмбриогенез в каллусной ткани. 6. Формирование придаточных эмбриоидов в ткани первичных соматических зародышей (деление первичных эмбриоидов). Основной метод, использующийся при клональном микроразмножении растений - активация развития уже существующих в растении меристем. Он основан на снятии апикального доминирования (рис. 18). Этого можно достичь двумя путями: а) удалением верхушечной меристемы стебля и последующим микрочеренкованием побега in vitro на безгормональной среде; б) добавлением в питательную среду веществ цитокининового типа действия, индуцирующих развитие многочисленных пазушных побегов. Как правило, в качестве цитокининов используют 6-бензиламинопурин (БАП) или 6-фурфуриламинопурин (кинетин) и зеатин. Полученные таким образом побеги отделяют от первичного экспланта и вновь самостоятельно культивируют на свежеприготовленной питательной среде, стимулирующей пролиферацию пазушных меристем и возникновение побегов более высоких порядков. Часто в качестве экспланта используют верхушечные или пазушные почки, которые изолируют из побега и помещают на питательную среду с цитокининами. Образующиеся пучки побегов делят, при необходимости черенкуют и переносят на свежую питательную среду. После нескольких пассажей, добавляя в питательную среду ауксины, побеги укореняют in vitro (рис. 19), а затем переносят в почву, где создают условия, способствующие адаптации растений В настоящее время этот метод широко используется в производстве посадочного материала сельскохозяйственных культур, как технических, так и овощных, а также для размножения культур промышленного цветоводства (например, гвоздики, рис. 21), тропических и субтропических растений, плодовых и ягодных культур, древесных растений. Для некоторых культур, таких как картофель, технология клонального размножения поставлена на промышленную основу. Применение метода активации развития существующих меристем позволяет получать из одной меристемы картофеля более 100000 растений в год, причем технология предусматривает получение в пробирках микроклубней - ценного безвирусного семенного материала. 12. Размножение растений in vitro индукцией развития адвентивных точек. Второй метод - индукция возникновения адвентивных почек непосредственно тканями экспланта. Он основан на способности изолированных частей растения при благоприятных условиях питательной среды восстанавливать недостающие органы и таким образом регенерировать целые растения. Можно добиться образования адвентивных почек почти из любых органов и тканей растения (изолированного зародыша, листа, стебля, семядолей, чешуек и донца луковиц, сегментов корней и зачатков соцветий). Этот процесс происходит на питательных средах, содержащих цитокинины в соотношении с ауксинами 10:1 или 100:1. В качестве ауксина используют ИУК или НУК. Таким способом были размножены многие представители семейства лилейных, томаты, древесные растения (из зрелых и незрелых зародышей). 13. Микрочеренкование in vitro побега, сохраняющего апикальное доминирование. Способ — микрочеренкование побега, сохраняющего апикальное доминирование. Растения - регенеранты, полученные любым другим способом, можно черенковать в стерильных условиях, высаживать на свежую питательную среду, укоренять, и адаптировать к полевым условиям либо снова подвергать микрочеренкованию для того, чтобы увеличить количество посадочного материала. Достаточно хорошо разработана технология клонального размножения земляники, основанная на культивировании апикальных меристем. Меристематические верхушки изолируют из молодых, свободных от вирусных болезней растений, и выращивают на питательной среде МС, содержащей БАП в концентрации 0,1 - 0,5 мг/л. Через 3 - 4 недели культивирования меристема развивается в проросток, в основании которого формируются адвентивные почки, быстро растущие и дающие начало новым почкам. В течение 6-8 недель образуется конгломерат почек, связанных между собой соединительной тканью и находящихся на разной стадии развития. Появляются листья на коротких черешках, в нижней части которых формируются новые адвентивные почки. Эти почки разделяют и пересаживают на свежую питательную среду. На среде без регуляторов роста за 4 - 5 недель формируются нормальные растения с корнями и листьями. От одного материнского растения таким образом можно получить несколько миллионов растений-регенерантов в год. 14. Размножение in vitro в биореакторах и образование соматических зародышей. Размножение в биореакторах микроклубнями. Это один из способов ускоренного размножения оздоровленного материала. О. Мелик-Саркисов сконструировал гидропонную установку, позволяющую получать около 7000 микроклубней с 1 м2 при массе одного клубня 5 г. Предусмотрена последующая механизированная посадка их в грунт. В отделе биологии клетки и биотехнологии Института физиологии растений им. К. А. Тимирязева РАН создана эффективная полупромышленная замкнутая система пневмоимпульсного биореактора для получения микроклубней картофеля, в которой предусмотрена возможность воздействия на направление и скорость процессов клубнеобразования. Технологии клонального микроразмножения в биореакторах разработаны не только для сельскохозяйственных, но и для декоративных растений (лилии, гладиолусы, гиацинты, филодендроны и т.д.). Однако созданные установки пока носят лабораторный, модельный характер. Следующий способ размножения — образование соматических зародышей — основан на морфогенных изменениях — соматическом эмбриогенезе. Впервые это явление было отмечено в середине 50-х годов XX в. в культуре клеток моркови. Формирование эмбриоидов в культуре осуществляется в два этапа. На первом соматические клетки дифференцируются в эмбриональные в присутствии в питательной среде ауксинов, обычно это 2,4-D. На следующей стадии развиваются эмбриоиды. Этот процесс идет только при значительном снижении концентрации ауксина или полном отсутствии его в питательной среде. Соматический эмбриогенез может происходить в тканях первичного экспланта, в каллусной и суспензионной культурах. Поскольку соматические зародыши представляют собой полностью сформированные растения, данный метод позволяет сократить затраты, связанные с подбором условий укоренения и адаптации растений-регенерантов. Кроме того, преимущество получения соматических эмбриоидов состоит в том, что при использовании соответствующей техники капсулирования из них можно получать искусственные семена. Соматический эмбриогенез в настоящее время применяют для размножения пшеницы, ячменя, моркови, редиса, винограда, некоторых древесных растений (дуб, ель, эвкалипт). Метод, практикуемый при клональном микроразмножении, основывается на дифференциации из соматических клеток зародышеподобных структур, которые по своему виду напоминают зиготические зародыши. Этот метод получил название соматического эмбриогенеза. В отличие от развития in vivo, соматические зародыши развиваются асексуально вне зародышевого мешка и по своему внешнему виду напоминают биполярные структуры, у которых одновременно наблюдается развитие апикальных меристем стебля и корня. Согласно Стеварду, соматические зародыши проходят 3 стадии развития: глобулярную, сердцевидную, торпедовидную и в конечном итоге имеют тенденцию развития в проросток. На рисунке 3 показан конечный результат развития – растение пшеницы. Наиболее впечатляющим применением метода соматического эмбриогенеза стало размножение гвинейской масличной пальмы (Elaeis guineensis), масло которой широко используется при производстве маргарина и пищевого масла. Масличная пальма в природе не образует побегов и боковых ростков, что затрудняет ее вегетативное размножение. Культивирование черенков in vitro также невозможно. Было решено получить скопления клеток недифференцированной ткани (каллусы) путем дедифференцировки специфических тканей, а затем культивировать их до регенерации целых проростков. В первой культуральной среде каллусы из фрагментов листьев развивались в течение 90 дней, при переносе во вторую и третью культуральные среды превращались в "эмбриоиды". Эмбриоиды размножались самопроизвольно, в течение месяца число эмбриоидов возрастало втрое, а за год из 10 эмбрионов можно было получить потомство численностью 500000 растений. Формирование эмбриоидов в культуре тканей осуществляется в несколько этапов. Сначала происходит дифференциация клеток под влиянием ауксинов, добавленных в питательную среду (2,4-Д) и превращение их в эмбриональные. Получить эмбриоиды из этих клеток можно уменьшая концентрацию ауксинов или исключая их из питательной среды. Соматические зародыши представляют собой полностью сформированные зародыши, из которых путем соответствующего капсулирования можно получить искусственные семена. 1 2 |
