1. Фармакологическое действие и анализ структуры
 Скачать 76.57 Kb. Скачать 76.57 Kb.
|
|
Содержание 1. Фармакологическое действие и анализ структуры 2. Потребность в препарате Заключение 1. Фармакологическое действие и анализ структуры Rucaparib (фирменное наименование Rubraca) является ингибитором ПАРП использовать как противораковое средство. Rucaparib - это первый в своем классе препарат, ориентированных на репарацию ДНК фермента Поли-АДФ-рибоза-полимеразы-1 (ПАРП-1). Он был обнаружен в рамках сотрудничества между учеными, работающими в Северного института исследования рака и медицинского факультета Университета Ньюкасла и Agouron Pharmaceuticals в Сан-Диего, Калифорния. Она разработана на Кловис онкологии. 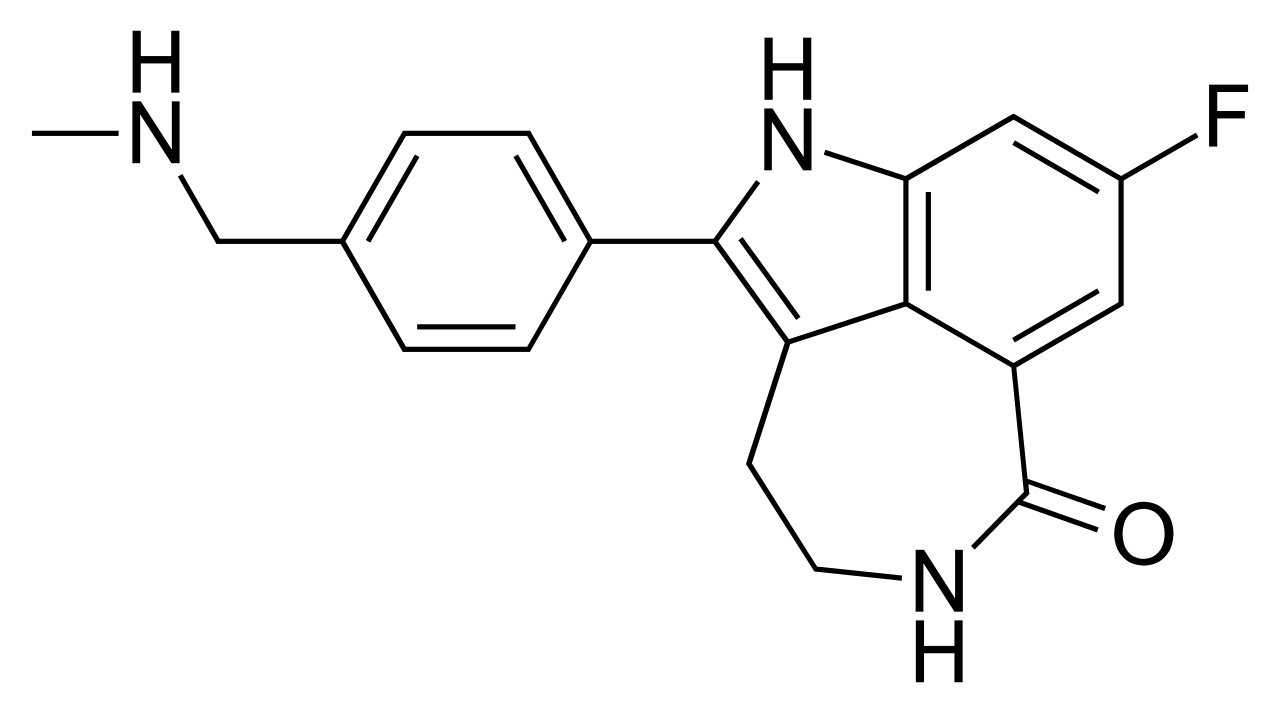 Рисунок 1 – Химическое строение Рубрака В декабре 2016 года, в FDA США получили ускоренное утверждение для использования в случаях протравлены передовых рака яичников. В Европе он был обозначен как орфанный лекарственный продукт 10 октября 2012 года. 22 марта 2018 года Комитет по лекарственным средствам для человека (ЧМП) принял положительное мнение, рекомендуя предоставлении условного регистрационного удостоверения на лекарственное средство, предназначенное для лечения рецидивирующего или прогрессирующего рака яичников. Механизм действия. Rucaparib блокирует " сужение изолированной васкулярной ровной мышцы, включая то от опухолей пациентов рака. Он также уменьшает миграцию некоторых раковых и нормальных клеток в культуре." В качестве ингибитора ПАРП, rucaparib, как ожидается, будет более эффективным в 9% панкреатического рака при мутации ген рака груди (BRCA1 или BRCA2). Ингибиторам PARP – это группа фармакологических ингибиторов этого фермента Поли-АДФ-рибоза-полимераза(ПАРП). Они разработаны для множественных показаний; наиболее важным является лечение рака. Некоторые виды рака являются более зависимой от ППА, чем обычные клетки, делая ПАРП привлекательной мишенью для терапии рака. Ингибиторам PARP, как представляется, увеличивает выживаемость без прогрессирования у женщин с привычным платиночувствительный яичников, о чем свидетельствует в основном olaparib добавил к традиционному лечению. В дополнение к их использованию в терапии рака, ингибиторам PARP рассматриваются как потенциальное лекарство для лечения острых угрожающих жизни заболеваний, таких как инсульт и инфаркт миокарда, а также для длительного нейродегенеративных заболеваний. Рубрача может вызвать серьезные побочные эффекты, включая проблемы с костным мозгом, называемые Миелодиспластическим синдромом (MDS) или типом рака крови, называемым острым Миелоидным лейкозом (AML). Некоторые люди, которые имеют рак яичников и которые получили Предыдущее лечение химиотерапией или некоторые другие лекарства для их рака разработали MDS или AML во время или после лечения с Рубрача. MDS или AML могут привести к смерти. Если вы разрабатываете MDS или AML, ваш врач прекратит лечение с Rubraca. Симптомы низких отсчетов клетки крови общие во время обработки с Rubraca но могут быть знаком серьезных проблем, включая MDS или AML. Скажите вашему провайдеру медицинских услуг если вы имеете любые следующие симптомы во время обработки с Rubraca:
Самые общие побочные эффекты Rubraca включают:
ДНК подтверждается тысячи раз во время каждого клеточного цикла, и это повреждение должно быть восстановлено, в том числе и в раковых клетках. В противном случае клетки могут погибнуть из-за этого повреждения. Генов BRCA1, BRCA2, поставленным и PALB2 представляют собой белки, которые важны для восстановления двунитевых разрывов ДНК путем безошибочное гомологичных стадии ремонта, или ГРР, путь. Когда ген для одного из этих белков мутирует, изменение может привести к ошибкам в ремонте ДНК, которые могут в конечном итоге вызвать рак молочной железы. Подверганный к достаточному повреждению в одно время, измененный ген может причинить смерть клеток. PARP1 протеин который важен для ремонтировать Single-strand проломы ("забоины" в дна). Если такие ники сохраняются до тех пор, пока не будет реплицирована ДНК (которая должна предшествовать делению клеток), то сама репликация может вызвать двойные разрывы нити. Препараты, которые подавляют PARP1 вызвать множественные двунитевые разрывы в эту сторону, а в опухолях с генами BRCA1, BRCA2, поставленным или PALB2 мутации, эти двунитевые разрывы не могут быть эффективно восстановлены, ведущих к гибели клетки. Нормальные клетки, которые не реплицируют свою ДНК так часто, как раковые клетки, и которые не имеют мутировавших BRCA1 или BRCA2, все еще имеют гомологический ремонт, который позволяет им пережить ингибирование PARP. Ингибиторы PARP приводят к захвату белков PARP на ДНК в дополнение к блокированию их каталитического действия. это мешает репликации, вызывая гибель клеток преимущественно в раковых клетках, которые растут быстрее, чем non-раковидные клетки. Некоторые раковые клетки, что отсутствие опухолевого супрессора PTEN могут быть чувствительными к ингибиторам PARP из-за подавление Rad51, критическая гомологичной рекомбинации компонентов, хотя другие данные говорят о том PTEN не может регулировать Rad51. таким образом ингибиторам PARP может быть эффективным против многих PTEN-неисправен опухолей (например, некоторые агрессивного рака предстательной железы). Раковые клетки с низким содержанием кислорода (например, при быстрорастущих опухолях) чувствительны к ингибиторам PARP. Ингибирование PARP1 приводит к нарушению репарации ДНК. Известно, что в ответ на повреждение ДНК PARP1 связывается с одно- и двухцепочечными разрывами ДНК. В отсутствие повреждений активность PARP1 минимальна, однако появление повреждений вызывает его немедленную и значительную (до 500-кратной) активацию. PARP1 отыскивает разрывы в ДНК, действуя как сенсор и обеспечивая быстрое привлечение белков, требуемых для репарации, к месту повреждения. PARP1 контролирует несколько путей репарации ДНК, в том числе эксцизионную репарацию оснований (base excision repair, BER) и нуклеотидов (nucleotide excision repair, NER), репарацию мисматчей (mismatch repair, MMR), репарацию двухцепочечных разрывов с помощью гомологичной рекомбинации (HR) и с помощью негомологичного соединения концов (non-homologous end joining, NHEJ). Ингибирование PARP приводит к инактивации системы репарации и сохранению спонтанных одноцепочечных разрывов (SSB) (рис. 5А), что может быть причиной последующего формирования двухцепочечных разрывов ДНК (DSB). DSB можно устранить двумя способами – либо «репарацией ДНК без ошибок» с помощью HR, либо репарацией с возможностью замены в последовательности нуклеотидов путем NHEJ. В ряде опухолевых клеток с нарушениями в системе гомологичной рекомбинации (например, BRCA-мутантные клетки) может включаться система NHEJ, однако использование NHEJ в этих опухолях приводит к дестабилизации генома и, в конечном итоге, к гибели клеток из-за быстрого накопления генетических ошибок. В 2005 году произошел прорыв в области исследований ингибиторов PARР1. Двумя независимыми группами ученых было показано, что BRCA1- и BRCA2-дефицитные линии клеток чувствительны к прямому действию ингибиторов PARP. Это были первые свидетельства того, что ингибиторы PARP1 могут выступать как самостоятельные лекарственные средства в случае опухолей, в которых нарушены определенные пути репарации ДНК. Известно, что опухоль-ассоциированный ген BRCA1 играет важную роль в репарации двойных разрывов ДНК по механизму HR. Клетки с дефицитом BRCA1 характеризуются менее эффективной HR, и репарация ДНК в них происходит преимущественно с помощью системы BER. BRCA2 взаимодействует с белком RAD51 и также играет существенную роль в HR. Клетки с мутациями в области связывания BRCA2 с RAD51 проявляют гиперчувствительность к повреждениям ДНК и хромосомную нестабильность. Например, 10–15% серозного рака яичников имеет наследственный характер, обусловленный мутацией в генах BRCA1 или BRCA2. Показано, что дефекты в HR-репарации, возникающие вследствие мутаций в RAD51, DSS1, RPA1 или CHK1, вызывают повышенную чувствительность клеток к ингибированию PARP1. Ингибирование репарации повреждений ДНК при условии дефицита гомологичной рекомбинации приводит клетку к гибели из-за невозможности исправить все повреждения ДНК. Объяснить прямое действие ингибиторов PARP1 на опухолевые клетки можно также с помощью другого механизма. Предполагается, что в результате действия ингибиторов PARP1 остается связанным с поврежденной ДНК, поэтому он не может отделиться от ДНК и «освободить» место для PARP1-зависимых ферментов репарации. Третья модель прямого действия ингибиторов PARP1 основана на наблюдении Li и Yu, которые показали, что в присутствии ингибиторов PARP1 мутантный BRCA1 в меньшей степени накапливается в области повреждений ДНК. Предложена также четвертая модель прямого действия ингибиторов PARP1. Согласно этой модели, при двухцепочечных разрывах в клетках с дефицитом HR активируется другая система NHEJ. Ключевые белки этой системы – Ku70, Ku80 и DNA-PKcs, как показано ранее, имеют PARP1-связывающие мотивы и могут регулироваться с помощью АDP-рибозилирования. В клинических исследованиях монотерапия олапарибом приводила к ингибированию опухолей с мутациями в BRCA1 или BRCA2 (рак молочной железы и рак яичников). При этом клетки с дефицитом BRCA1 или BRCA2 были в 57 или 133 раза более чувствительны к ингибированию PARP1 соответственно. Однако эффективность подобной терапии была невысокой – положительный ответ наблюдался менее чем у 50% пациентов. Поэтому очень важно правильно определить прогностические маркеры терапии ингибиторами PARP1. Терминальные мутации генов BRCA1 или BRCA2 в опухолевых клетках приводят к появлению дефектов в системе гомологичной рекомбинации ДНК, в работе которой в норме принимают участие оба белка BRCA. В этом случае опухолевые клетки становятся чрезвычайно зависимыми от одной из пяти других систем репарации, в работе каждой из которых участвует PARP1. Ингибирование PARP1 при условии дефицита гомологичной рекомбинации ведет клетку к апоптозу из-за невозможности репарации всех возникших повреждений ДНК. Этот процесс назван «синтетической летальностью». В ряде работ показана перспективность применения ингибиторов PARP1 у больных с опухолями, возникшими из-за дефектов в генах BRCA. Пре парат Rubraca от ком па нии Clovis по лучил вто рое одоб ре ние в США в ка чес тве под держи ва юще го ле чения па ци ен тов с ре циди виру ющим ра ком я ич ни ков. Этот ин ги битор PARP те перь мож но наз на чать взрос лым с ре циди виру ющим эпи тели аль ным ра ком я ич ни ков, фал ло пи евой труб ки или пер вичным пе рито не аль ным ра ком, ко торые пол ностью или час тично ре аги ру ют на хи ми оте рапию на ос но ве пла тины. Rubraca (rucaparib) бло киру ет вос ста нов ле ние пов режден ной ДНК в ра ковых клет ках и, как ре зуль тат, зас тавля ют ра ковые клет ки уми рать. FDA одоб рил пре парат на ос но вании дан ных кли ничес ко го ис сле дова ния III фа зы ARIEL3, в ко тором бы ли дос тигну ты как пер вичные, так и ос новные вто рич ные ко неч ные точ ки, что поз во лило уве личить вы жива емость без прог ресси рова ния (PFS) по срав не нию с пла цебо у всех па ци ен тов, не зави симо от на личия му таций BRCA в ди аг но зе. Бы ло ус та нов ле но, что ме ди ан ная PFS сос тавля ет 10,8 ме сяца для груп пы, по лучав шей Rubraca, и 5,4 ме сяца для груп пы пла цебо. 2. Потребность в препарате Рак яичников занимает пятое место по частоте встречаемости среди злокачественных образований у женщин. В России заболеваемость раком яичника составляет приблизительно 77 случаев на 100 тысяч населения. Средний возраст, когда возникает рак яичников, составляет 61 год. Наиболее высокая распространенность рака яичников отмечается в развитых странах. Возможно, этому способствуют особенности питания, некоторые физические и химические факторы. Канцерогены, вызывающие рак яичников, не описаны. Рак яичников относится к категории трудноизлечимых злокачественных новообразований, у которых есть патогномоничные симптомы. Опухоль имеет высокий потенциал к развитию рецидивов. В яичниках встречаются эпителиальные и неэпителиальные новообразования. Эпителиальные опухоли можно обнаружить в 80 – 90% случаев, а неэпителиальные в 10 – 20%. В странах Западной Европы заболеваемость раком яичников составляет 18000 на 1000 представительниц женского пола. В РФ ежегодно диагностируют рак яичников у 11000 женщин, в Беларуси – в 80000. Эта патология составляет 5% в структуре заболеваемости онкологическими заболеваниями. В Великобритании заболеваемость раком яичников составила в 2012 году 7000 человек. В день выявляли 19 новых случаев заболевания. Это 2% от всех новых случаев рака. Во всём мире в 2012 году зарегистрировано 239000 новых случаев рака яичников. Он находится на третьем месте среди злокачественных новообразований женских репродуктивных органов после рака шейки и тела матки. Средний возраст пациенток, страдающих раком яичников, составляет 63-64 года. 28% рака яичника выявляют у женщин старше 75 лет. Подростков и женщин молодого возраста поражают преимущественно гермиогенные опухоли. Средний возраст женщин, у которых выявляют эти новообразования, составляет 20лет. Их доля в структуре онкологической заболеваемости такова: 81% злокачественных новообразований яичников у подростков и 6% всех опухолей яичников. Негермиогенные опухоли яичников встречаются у женщин после 50 лет. У них в 66% случаев выявляют аденокарциномы. Заболеваемость раком яичников в мире увеличилась с конца семидесятых годов прошлого столетия на 1/3. За последнее десятилетие благодаря новым методам исследования она снизилась на 14%. К сожалению, растёт и показатель смертности от этого новообразования. Так, ежегодно во всём мире умирает от рака придатков матки около 152000 женщин. Скорее всего, это происходит из-за того, что от этого новообразования умирают в основном пожилые люди, у которых есть тяжёлая сопутствующая соматическая патология. Так, процент смертности женщин, страдающих раком яичников, после 65 лет составил 37,5, а после семидесяти лет – 65. Наиболее высокая смертность женщин в возрасте после 85 лет. Это связано с проблемами герниопатологии. Смертность от рака яичников составляет 4% женской смертности и 2% от общего показателя. Она наиболее высокая в странах Восточной Азии и Малайзии. Истинные причины возникновения рака яичника остаются малоизученными. К факторам риска можно отнести наследственную предрасположенность (наличие в семье злокачественных заболеваний яичников), наличие рака тела матки и молочных желез, а также отсутствие беременностей на протяжении всей жизни. Рак яичников на ранних стадиях протекает, как правило, бессимптомно. На более поздних стадиях может появиться учащенное мочеиспускание, запор, кровянистые выделения из влагалища, неприятные ощущения и болезненность в животе. Женщины детородного возраста могут обращаться к врачу по поводу нерегулярных менструаций. Рак яичника наиболее характерен для женщин в постменопаузе. Следует заметить, что многие женщины в это время перестают регулярно посещать гинеколога, так как не видят в этом особой необходимости. Такая позиция является ошибочной. Рак яичника характерен именно для этого возрастного периода. Таким образом, для своевременной диагностики женщинам следует регулярно посещать гинеколога на протяжении всей жизни. Следующей проблемой является страх подтверждения диагноза. После осмотра, гинеколог отправляет пациентку на дополнительные исследования: опасаясь положительного ответа, женщина откладывает посещение специалистов и проведение анализов на все более отдаленный срок, а заболевание тем временем может прогрессировать. И наконец последнее: после постановки диагноза некоторые женщины отказываются от лечения или откладывают его на неопределенный срок, руководствуясь тем, что «детей им уже не рожать», а следовательно можно и так жить. Рак яичника – это опасное заболевание. Лечение будет тем более эффективным, чем раньше оно начато. Если вам поставлен диагноз рака яичника, старайтесь как можно скорее начать лечение и выполняйте все рекомендации врачей. Rubraca не имеет аналогов. Заключение Исходя из выше изложенной информации рубрака – это препарат применяемый от рака, которое препятствует росту и распространению раковых клеток в организме. Этот препарат используют для лечения прогрессирующего рака яичников. Препарат использую в случае, когда опухоль пациента имеет определенный генетический маркер. Рубрака обычно назначают после опробования как минимум 2 других противораковых препаратов безуспешно. Этот препарат может вызвать лейкемию или серьезные проблемы с костным мозгом, что не является его положительным качеством. Также этот препарат нельзя принимать при беременности, так как он может нанести вред не рожденному ребенку или привести к выкидышу. При принятии препарата следует избегать солнечных лучей или соляриев. |
