1 График 1 соответствует газу с большей массой молекул
 Скачать 83.5 Kb. Скачать 83.5 Kb.
|
|
1 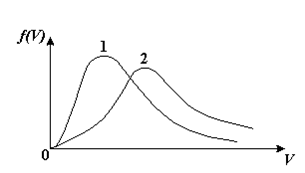 . Для распределения Максвелла по модулям скоростей молекул для разных газов при одинаковой температуре верны утверждения: . Для распределения Максвелла по модулям скоростей молекул для разных газов при одинаковой температуре верны утверждения:1) График 1 соответствует газу с большей массой молекул 2) График 2 соответствует газу с большей молярной массой. 3) Площадь под этими кривыми тем больше, чем больше молярная масса газа 4) Площади под этими кривыми одинаковы. 2. Абсолютное число dN молекул идеального газа, скорости которых при данной температуре T заключены в интервале от V до V + dV, НЕ ЗАВИСИТ от: 1) температуры газа 2) общего числа N молекул этого газа 3) объема, занимаемого газом 4) значения скорости V, в окрестности которой выбран рассматриваемый интервал dV 3 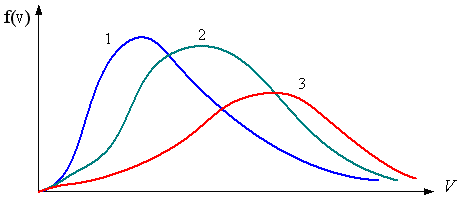 . В трех одинаковых сосудах находится одинаковое количество одного и того же газа при разных температурах. Функцию распределения молекул по скоростям в сосуде с максимальной температурой будет описывать кривая, обозначенная номером… . В трех одинаковых сосудах находится одинаковое количество одного и того же газа при разных температурах. Функцию распределения молекул по скоростям в сосуде с максимальной температурой будет описывать кривая, обозначенная номером…4. Правильные утверждения о средней квадратичной скорости ( 1) При одинаковой температуре 2) Средняя квадратичная скорость 3) Чем больше масса молекулы газа, тем меньше 4) При возрастании температуры системы в четыре раза средняя квадратичная скорость 5. В сосуде находятся одинаковые количества азота N2 (M1 = 28 г/моль) и водорода H2 (M2 = 2 г/моль). Функции распределения молекул этих газов по скоростям будут описываться кривыми, изображенными на рисунке под номером 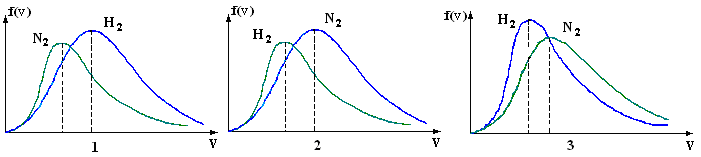 1) 1 2) 2 3) 3 4) правильного рисунка нет 6. Если средняя квадратичная скорость молекул некоторого газа равна 500 м/с, то наиболее вероятная скорость составляет … м/с. 1) 327 2) 250 3) 630 4) 408 7. Если при нагревании некоторого газа наиболее вероятная скорость молекул газа увеличилась в 2 раза, то средняя квадратичная скорость … раз(а). 1) увеличится в 4 2) уменьшится в 3) уменьшится в 8 4) увеличится в 2 8. Если при нагревании некоторого газа средняя квадратичная скорость молекул газа увеличилась в 4 раза, при этом наиболее вероятная скорость … раз(а). 1) увеличится в 4 2) уменьшится в 3) уменьшится в 8 4) увеличится в 2 9. Три газа: водород (M1 = 2 г/моль), гелий (M2 = 4 г/моль) и кислород (M3 = 32 г/моль) находятся при одинаковой температуре T. Тогда значение f(Vвер) функции распределения Максвелла, соответствующее наиболее вероятной скорости молекул,.. 1)одинаково для всех газов 2) максимально для водорода 3) минимально для гелия 4) максимально для кислорода 10. Три газа: водород (M1 = 2 г/моль), гелий (M2 = 4 г/моль) и кислород (M3 = 32 г/моль) находятся при одинаковой температуре T. Тогда наиболее вероятная скорость Vвер… 1) у всех газов одинакова 2) у кислорода наибольшая 3) у гелия наименьшая 4) у водорода наибольшая 11. В статистике Максвелла функция распределения по определению имеет вид 1) f(V) - вероятность того, что скорость данной молекулы находится в единичном интервале скоростей вблизи заданной скорости V. 2) f(V)dV- вероятность того, что скорость данной молекулы заключена в интервале скоростей от V до V+dV. 3) f(V) - относительное число молекул, скорости которых заключены в интервале скоростей от V до V+dV. 4) f(V)NdV - абсолютное число молекул, скорости которых заключены в интервале скоростей от V до V+dV. 12. Правильные утверждения о наиболее вероятной скорости Vвер частиц системы, подчиняющейся распределению Максвелла: 1) Наиболее вероятная скорость Vвер зависит от температуры и молярной массы идеального газа. 2) Скорость Vвер можно найти, приравняв нулю производную функции распределения Максвелла по скоростям: 3) Чем больше молярная масса газа, тем меньше при данной температуре значение Vвер. 4) Vвер линейно возрастает с увеличением температуры. 13. Н 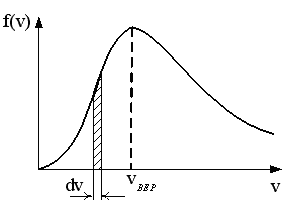 а рисунке представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где а рисунке представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где 1) величина максимума уменьшится 2) площадь под кривой увеличится 3) максимум кривой сместится влево, в сторону меньших скоростей 4) максимум кривой сместится вправо, в сторону больших скоростей |
