КР №27. 1) H2SO4 Ba(OH)2 2H2O BaSO4
 Скачать 5.67 Mb. Скачать 5.67 Mb.
|
|
7. Какие из приведенных ниже гидроксидов могут взаимодействовать как с кислотой, так и со щелочью, а какие – только с кислотой: Ba(OH)2, Be(OH)2, H2CO3? Составьте уравнения соответствующих реакций в молекулярном и ионно-молекулярном виде и назовите образующиеся соли. 1) H2SO4 + Ba(OH)2 → 2H2O + BaSO4 - Сульфатбария Ba2+ + 2OH- +2H+ +SO4 2- = Ba2+ SO4 2- + 2H2O 2OH- +2H+= 2H2O 2) H2SO4 + Be(OH)2 → 2H2O + BeSO4 - Сульфатбериллия Be²⁺+2OH⁻ + 2H⁺+SO²⁻₄ -->Be²⁺+SO²⁻₄ + 2H2O 2OH⁻ + 2H⁺-->2H2O Be(OH)2 + 2 NaOH → Na2[Be(OH)4] - Тетрагидроксобериллатнатрия 2NaOH+ Be(OH)2= Na2BeO2+ 2H2O Be(OH)2 +2 OH- = BeO2- + 2H2O 3) H2CO3 + 2 NaOH → 2 H2O + Na2CO3 - Карбонатнатрия 2H(+) + CO3(2-) + 2Na(+) + 2OH(-) --> 2Na(+) + CO3(2-) + 2H2O 2H(+) + 2OH(-) --> 2H2O 28. При взаимодействии 20 г металла (+2) с избытком соляной кислоты выделилось 11,2 л Н2 (н.у.). Определите, о каком металле идет речь. Me + 2HCl = MeCl2 + H2↑ n(Me) = n(H2) = 11.2/22.4 = 0.5 моль M(Me) = 20/0.5 = 40 г/моль - Са (кальций) 49. Какой элемент имеет в атоме пять (и не более) электронов, для каждого из которых n =3 и l = 2? Чему равны для них значения магнитного квантового числа ml? Должны ли они иметь антипараллельные спины? Элемент (-ы) При n=3 и l=2 мы рассматриваем энергетический уровень M и оболочку d. Следовательно, 5 электронов находятся на 3d-оболочке. Такую электронную конфигурацию имеют Марганец и Хром. Возможные значения ml Далее, магнитное квантовое число ml может принимать n' = 2l+1 значений. При l=2 число возможных значений магнитного момента равно 5: ±2, ±1, 0. Ориентация спинов Орбитали c одинаковым орбитальным и главным квантовыми числами (в общем, одной оболочки) имеют вырожденное состояние по энергии. Но, несмотря на это, при заполнении таких орбиталей, вследствие правила Хунда, электроны заполняют вначале все орбитали одной оболочки без компенсации спина друг друга (каждый электрон заполняет отдельную орбиталь; спины параллельны) , а затем уже образуют системы из квазисвязанных пар, полностью заполняющих два свободных квантовых состояния одной орбитали, различающихся проекцией спина на направление движения (то есть, их спины антипараллельны) . Это правило обусловлено тем, что при уменьшении расстояния между электронами энергия их электростатического отталкивания растет. Потому электроны заполняют такие области, в которых область перекрытия зарядовой плотности (их электростатическое взаимодействие) , а значит, суммарная энергия взаимодействия, минимальны; при этом, проекции их спинов параллельны. Потому дополнительное отталкивание, а значит, и уменьшение энергии электростатического отталкивания, реализуется за счет принципа Паули и обменного взаимодействия. Поэтому, при количестве орбиталей, равным 5, и такому же количеству электронов на них, электроны не должны иметь антипараллельные спины. 70. В молекуле NH3 валентный угол равен 107°. Изобразите схему перекрывания орбиталей при образовании молекулы. 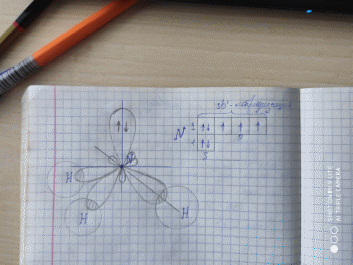 91. Сравните изменения энергии Гиббса реакций: а) СаО(к) + СО2(г) ⇄ СаСО3(к); б) SrО(к) + СО2(г) ⇄ SrСО3(к); в) ВаО(к) + СО2(г) ⇄ ВаСО3(к). Какой вывод можно сделать на этом основании об изменении основных свойств оксидов в ряду СаО− SrО−ВаО? а) Gx.p.= –1128,75 + 394,38 + 604,2 = –130,17 кДж/моль. б) Gx.p.= –1227,0 + 394,38 + 559,8 = –272.8 кДж/моль. в) Gx.p.= –1138,8 + 394,38 + 528,4 = –216,02 кДж/моль. Наиболее энергично будет проходить реакция образования SrСО3, так как энергия Гиббса в ходе нее уменьшается больше. 112. Если прямая реакция экзотермическая, а обратная – эндотермическая, какая из них характеризуется более высоким значением энергии активации? А какая более высоким значением константы скорости? Ответ мотивируйте. 1) Прямая. Для прямой экзотермической реакции (ΔH < 0) конечное состояние характеризуется более низким уровнем энергии, чем исходное. Для обратной эндотермический реакции (ΔH > 0) – более высоким уровнем энергии. Следовательно, прямая реакция характеризуется меньшим значением энергии активации, чем обратная. 2) При температурах >1000° - обратная При обычных – прямая. 133. Для осаждения в виде хлорида всего серебра, содержащегося в 100 мл раствора нитрата серебра, требуется 50 мл 0,2 н. соляной кислоты. Вычислить нормальность раствора нитрата серебра и массу образовавшегося осадка. n(HCl)=0,05л*0,2л/моль=0,01 моль, уравнение взаимодействия нитрата серебра и соляной кислоты: AgNO3+HCl=AgCl+HNO3 вещества реагируют между собой в одинаковых количествах, поэтому n(AgNO3)=0,01 моль, определим концентрацию раствора серебра: С=0,01моль/0,1л=0,1 моль/л, M(AgNO3)=143,5г/моль, m(AgCl)=0,01 моль*143,5г/моль=1,435г 154. Вычислить криоскопическую константу уксусной кислоты, если известно, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718°С. Температура кристаллизации уксусной кислоты 16,60°С. Концентрации растворенного вещества: delta t = К крио * m моляльная концентрация m = (4,25 / 178) / 0,100 = 0,2388 моль/кг растворителя 178 г/моль - молярная масса антрацена К крио = delta t / m = (16,65 - 15,718) / 0,2388 = 3,9 175. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия между: а) карбонатом магния и серной кислотой; б) гидроксидом алюминия и серной кислотой (в избытке). а) MgCO3 + H2SO4 = MgSO4 + H2O + CO2 MgCO3 + 2H(+) + SO4(2-) = Mg(2+) + SO4(2-) + H2O + CO2 MgCO3 + 2H(+) = Mg(2+) + H2O + CO2 б) 2Al (OH) 3+3H2SO4=Al2 (SO4) 3+6H2O 2Al (OH) 3+6H (+) + 3SO4 (2-) = 2Al (3+) + 3SO4 (2-) + 6H2O 2Al (OH) + 6H (+) = 2Al (3+) + 6H2O 196 Можно ли приготовить водный раствор сульфита алюминия? Какое вещество будет в осадке, если к водному раствору нитрата алюминия добавить сульфит калия? Составьте уравнения протекающих при этом реакций в молекулярном и ионно-молекулярном виде. 2Al(NO3)3 + 3K2SO3 + 3H2O → 2Al(OH)3 + 3SO2 + 6KNO3 2Al(OH)3 – осадок 217. Чем двойные соли отличаются от комплексных? В каком случае выпадает осадок Ni(OH)2, если к растворам солей (NH4)2Ni(SO4)2 и Ni(NH4)6(SO4)4 (к каждой отдельно) добавить раствор щелочи? Напишите уравнение диссоциации комплексного соединения и выражение общей константы нестойкости его комплексного иона. 1) Комплексные соли содержат комплексные ионы, а двойные соли содержат два разных катиона и одинаковый анион 2) (NH4)2Ni(SO4)2 + 4NaOH = Ni(OH)2 + 2Na2SO4 + 2NH3 + 2H2O Ni(NH4)6(SO4)4 + 8NaOH = Ni(OH)2 + 4Na2SO4 + 6NH3 + 6H2O 238. Используя таблицы окислительно-восстановительных потенциалов, напишите формулы продуктов приведенных окислительно-восстановительных реакций (ОВР), укажите окислитель и восстановитель. Возможны ли эти реакции при стандартных условиях? PbO2 + HCl = PbCl2 + … PbO2 + 4HCl→2H2O+ Cl2 + PbCl2 Pb+ 2e-→Pb- восстановление 2Cl - 2e- → 2Cl -окисление KMnO4 + NaI + H2SO4 = … 2KMnO4 + 10NaI + 8H2SO4 → 8H2O + K2SO4 + 2MnSO4 + 5I2 + 5Na2SO4 2Mn+10e-→2Mn- восстановление 10I-10e-→10I- окисление 259. Известно, что медь не вытесняет водород из раствора HCl. Однако, если прикоснуться к медной пластинке цинковой проволокой, на медной пластинке будет выделяться водород. Почему? Опишите работу возникающего при этом гальванического элемента. Медь не вытесняет водород из разбавленных кислот, потому что находится в электрохимическом ряду правее водорода. На самом деле цинк вытесняет водород, а медь служит катодом, на поверхности которого и происходит бурное выделение водорода. Цинк же является анодом. На катоде К (+)/Сu: 2H+ + 2e- → H20 На аноде А (-)/Zn: Zn0 – 2e → Zn2+ Уравнение реакции сокращённое ионно-молекулярное. Zn + 2H+ → H2↑ + Zn2 |
