ШПОР ХИМ. 1. Хим негі тусіні атом, молекула, атомды же молеку массалар, жй же крделі зат, химия эквивалент, моль
 Скачать 69.33 Kb. Скачать 69.33 Kb.
|
|
1.Хим-ң нег-і тусін-і:атом, молекула, атомдық ж/е молеку/қ массалар, жәй ж/е күрделі зат, химия-қ эквивалент, моль.Хим бізді қоршағ орт-ғы зат-ң қасиетін, құрлысын, құрамын бір-бірімен әрекеттесіп түрленуін зерттейді. Химияның зерттеу объектілері: хим-қ элемент ж\е оның қосылыстары. Хим-ң мақсаты: белгілі қасиеттері бар з-ды алу, өк процестерді қарқындату, хим-қ түрлендірулердің энергиясын қолдану, қорш орт-ны қорғау. Массаыс мен көлемі б/н зат-ң бәрі дене д.а. Зат-массасы тыныштықта б-н материяның түрі. Жай заттар бір элементтің атомынан түзілледі. Ол белгілі бір тығыз/мен , ерігіш/мен балқу ж/е қайнау темпера/н ж/е т.б.сипат/ды. Күрделі зат/р молекулалары әр түрлі хим-қ элементтердің атомдарынан тұрады. Хим-қ элемент деп ядро зарядтары бірдей болып келетін атомдардың белгілі бір түрін айтады. Атом-хим-қ элемент-ң электрбейтарапты ең кіші бөлшегі,ол оң заряд-н атомдық ядродан ж/е теріс заряд-н электрон-н тұрады.Молекула-ол сол зат-ң химия-қ қасиеті бар,ең кіші бөлшегі. Атомдық масса-ол массаның атомдық бірлігімен өрнектелген,химиялық элемент массасының орташа мәні. Молекулалық масса-масса-ң атомдық бірлігінде өрнектелген молек-ң массасы,ол молекула құралған, барлық атом-р масса-ң қосындысына тең. Химиялық эквивалент- хим/қ реак/ғы сутек атом/ң 1моль/н қосылыса н/е сутек атом/ң сон/ма санын алмастыра алат/н ,оның сондай санын айтады.Заттың 1эквивалнетінің массасын эквиваленттік масса д.а.Берілген тотығу-тотықсыздану реакцияларында 1электронға,ал алмасу реакцияларында 1протонға сәйкес келетін нақтылы бөлшекті эквивлент д.а.Қышқыл/ң экв/т(металл атомымен орын алмаса алатын сутек атомының саны) Эқыш= 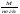  Негіздің экв/ті(негіз түзетін гидроксид ионының санына н\е металл валенттілігі)Энегіз= Негіздің экв/ті(негіз түзетін гидроксид ионының санына н\е металл валенттілігі)Энегіз=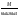 Тұздың экв/ті(тұздың молярлық массасының металдың атом санымен металл валенттілігі көбейтіндісінің қатынасына тең): Энегіз=М\пВОксид/ң экв/ті(оттек ж\е онымен қосылған элемент эквиваленттерінің қосындысына тең)Эокс=Ээлем+ЭоттекМоль-массасы 12-ге тең көміртегі атом/ң 0,012кг қанша атом/р болатын б/са ,берілген заттың да сонша құрылымдық бөлшегі болатын зат мөлшері. Тұздың экв/ті(тұздың молярлық массасының металдың атом санымен металл валенттілігі көбейтіндісінің қатынасына тең): Энегіз=М\пВОксид/ң экв/ті(оттек ж\е онымен қосылған элемент эквиваленттерінің қосындысына тең)Эокс=Ээлем+ЭоттекМоль-массасы 12-ге тең көміртегі атом/ң 0,012кг қанша атом/р болатын б/са ,берілген заттың да сонша құрылымдық бөлшегі болатын зат мөлшері.6.Атом құрылысының квант-механикалық моделі. 1933ж Нильс Бор Резерфордтың моделімен Планктың теориясын қолданып,атом моделінің құрылысын жасады.Атом құрылысы квант – механикалық теориясының ережелер:1.Электронның екі жақты табиғаты ( бөлшектік–корпускулалық және толқындық ) болады.Ол өзін бөлшек ретінде де , толқын ретінде де ұстай алады:бөлшек ретінде,электронның белгілі массасы мен заряды бар;мұнымен қатар қозғалыстағы электрон толқындық та қасиет көрсетеді,мәселен дифракцияға қабілеттілігімен сипатталады.2.Электрон үшін координат пен жылдамдықты бірден,бір сәтте дәл өлшеу мүмкін емес.Жылдамдықты неғұрлым дәл өлшенген сайын,соғұрлым координатта белгісіздік болады және керісінше.3.Атомдағы электрон белгілі траектория бойынша қозғалмайды,ядро маңындағы кеңістіктің кез келген бөлігінде бола алады,алайда оның атом кеңістігінің әртүрлі бөлігінде болу ықтималдылығы бірдей емес.Ядро айналасындағы электронның болуының ықтималдығы ең жоғары кеңістік атомдық орбиталь д.а. Электрондық бұлт туралы түсінік.Кванттық сандар Электронда теріс заряд болатындықтан,оның орбиталі зарядтың белгілі бір таралуын электрондық бұлт д.а. Электрон бұлты─атомдағы электронның кванттық механика тұрғысынан қарағандағы моделі.Орбиталь электрондық бұлттың формасын сипаттайды.Ядроның маңайындағы электрон бұлтының тығыздығы әртүрлі болады.Электронның болу мүмкіндігі дәлірек болатын кеңістікте электрон бұлтының тығыздығы да жоғары болады.Электрон бұлттары бір-бірінен өздерінің энергия мөлшері,пішіндері және кеңістікте орналасу бағыты арқылы ажыратылады.Э.Шредингер теңдеуі арқылы электрон қозғалысының ең маңызды сипаттамаларының бірі-оның толқындық функциясы анықталады.Әр элементтің атомы ядро зарядымен және саны соған тең электрондармен сипатталады,ал бұл электрондар микробөлшектер болғандықтан,олардың күйін төрт квант саны өрнектейді: Бас квант саны (n)-электронның энергиясы мен орбитальдың өлшемін анықтап,энергетикалық деңгейді сипаттайтын шама.n=1,2,3,4,5.Оның мәні жоғары болса,энергиясыда жоғары болады.Энергетикалық деңгей-бас квант санының бірдей мәні бар орбитальдардың жиынтығы.Орбитальдық квант саны (l)-энергетикалық деңгеидің деңгейшесінде орналасқан электронның энергиясын сипаттайтын ж\е электрондық бұлт пішінін анықтайтын шама.Энергетикалық деңгейше-бір энергетикалық деңгейде болатын ж\е бірдей формадағы орбитальдардың жиынтығы.l=0 шар тәрізді(s-деңгей),l=1гантель формалы(p-деңгей).Магнит квант саны (Ml)-сыртқы магнит өрісінің әсерінен орбитальдардың кеңістікте орналасуын және деңгейдегі орбиталдардың санын анықтайтын шама.-1,0,+1 бүтін сандар мәнін қабылдайды.Спин квант саны (Ms)-электронның өз өсінің айналасында айналуын сипаттап,тек қана екі мәнді қабылдай алатын шама.(+1/2және1/2) 2.Химиянын негізгі заңдары Стехиометрия – ол әрекеттесуші заттардың массалық немесе көлемдік қатынастары туралы ілім. Массаның сақталу заңы: химиялық реакцияларға түскен заттардың массасы, реакция нәтижесінде түзілген заттардың массасына тең. Кез келген түрлену барысында массалар өзгеріске тап болып, энергия бөлінеді немесе сіңіріледі. Масса мен энергия арасындағы мұндай өзара байланысты А.Эйнштейн 1905 жылы көрсетті. Заттардың құрам тұрақтылық заңы: 1801 жылы француз химигі Ж.Пруст металдардың оксидтері мен сульфидтерін талдау нәтижесінің негізінде құрамның тұрақтылық заңын тұжырымдады: қандай жолмен алынған болса да, таза химиялық қосылыстардың сапалық және сандық құрамы әрдайым тұрақты болады. Қандай әдісен болса да құрамы сандық және сапалық тұрақтылықта болатын қосылыстарды дальтонидтер деп атайды. Алу әдістері мен оның алу жағдайына тәуелділікте болып, құрамы айнымалы келетін қосылыстарды бертоллидтер д.а. Көлемдік қатынастар заңы: -Шарль Гей-Люссак,1802 жылы реакцияласушы және реакциядан шығатын газ-р-ң көлем-рі-ң өзара қатынасы кішкене бүтін сандар қатынасындай болады. Еселі қатынас заңы: (Дальтон 1803ж) Екі элемент бірімен бірі бірнеше қосылыс түзетін болса, ол қосылыстарда сол элементтердің біреуінің бірдей етіп алынған салмақ бөлігіне екіншісінің сай келетін салмақ бөліктерінің өзара қатынасы кішкене бүтін сандар қатынасындай болады. Авогадро заңы: (1811ж) Бірдей жағдайда алынған әртүрлі газдардың бірдей көлем-ріндегі молекулалардың саны да бірдей болады. Авогадро заңының аса маңызды 3 салдар туындайды: 1) кез келген заттың 1 молінде молекулалар саны бірдей; 2) кез келген газдың 1 молі қалыпты жағдайда (р-760мм.с.б.б.-1атм. Қысым және Т-273,16К) 22,414л көлемде болады. Бұл көлемді молярлық көлем деп атайды. 22,414 л/моль; 3) бірдей көлемдегі әр түрлі газдар массаларының бір-біріне қатынасы олардың молекулалық массаларының қатынасына тең. Эквиваленттер заңы (Рихтер, 1792-1800жж.). Әрекеттесуші заттар массасы олардың эквиваленттік массасына пропорционалды. Эквивалент деп берілген тотығу-тотықсыздану реакцияларында бір электронға, ал алмасу реакцияларында бір протонға сәйкес келетін нақтылы н/е шартты бөлшек. Молекула н/е молекуланың бөлігі эквивалент болады. 3.Бейорг-қ қосылыстардың негізгі кластары:қышқылдар,негіздер,тұздар,оксидтер. Оксидтер деп 2 элементтен тұратын ж\е оның біреуі міндетті түрде оттегі болатын күрделі зат.Ол2 бөлінеді:тұз түзбейтіндер:CO.SiO.N2O.NO,тұзтүзбейтіндер3бөлінеді:амфотерлік:ZnO,Al2O3,CR2O3,MnO2,Fe2O3,қышқылдық(бейметалдардың оксиді):B2O3,N2O5,Mn2O7,негіздік(активті металдың оксиді):CuO,MgO.Негіздер деп металл атомынан ж\е гидроксод тобынан тұратын күрделі зат.Ол 2бөлінеді:суда еритін(сілтілік металдардын гидроксидтері NaOH,KOH,CsOH,),ерімейтін:Cu(OH)2,Fe(OH)2.Қышқылдар деп бір н\е бірнеше сутегі атомынан ж\е қышқыл қалдығынан тұратын күрделі зат.Ол 2бөлінеді:оттекті:H2SO4,HNO3,оттексіз:HCl,HCN,H2S.Олар қатты ж\е сұйық түрде болады.Тұздар деп металл атомынан ж\е қышқыл қалдығынан тұратын күрделі зат.Ол 5бөлінеді:орташа(металл атомын қышқылқалдығы толық басқан кезде түзіледі):NaCl,Al2(SO4)3 қышқылды:(қышқыл молекуласындағы сутек атомдарының орнын қышқыл қалдықтары басады)KHSO4,Ca(H2PO4)2,негіздік(көпқышқылды гидроксид молекуласындағы гидроксотоптың орнын қышқылқалдығы басады):CuOHCl,Fe(OH)2Cl,қос(көпнегіздік қышқылдағы сутек атомдарының орнын екі әртүрлі металл атомдары басады):KAl(SO4)2,NaKCO3кешенді(диссосация кезінде кешенді иондарды бөледі):Na2[Zn(OH)4],[Ag(NH3)2]Cl. 4.Менделеевтің периодтық заңы мен элементтердің периодтық жүйесі,оның құрылымы. 1869ж Менделеев периодтық заңды ашты:жай заттпен элемент қосылыстарының қасиеттері мен пішіндері атом ядросының зарядына периодтық тәуелділікте болады.Кестеде 7 период,8топ бар.Период деп элементтер реттік нөмірінің өсу реті б\ша орналасқан элементтердің көлденең қатары.Топ деп элементтердің тік қатары,элементтерде электрондық құрылым ұқсас болады.Негізгі топшаларға кіші ж\е үлкен периодттардың элементтері кіреді.Қосымша топшаларға үлкен периодтардың элементтері кіреді.Топтардағы элементтердің металдық қасиеттері жоғарыдан төменге қарай күшейеді,ал бейметалдық қасиет әлсірейді.Топ нөмірі қосылыстағы элемент атомының жоғары тотығу дәрежесімен валенттік электрондар санын көрсетеді.Период нөмірі атомның энергетиклық қауызындағы энергетикалық деңгей санын көрсетеді.Әрбір периодта солдан оңға қарай элементтердің металдық қасиеттері әлсіреп,бейметалдық қасиет артады. 7.Орбитальдарды электрондармен толтыру реті.Энергияның кішіреуі принципі.Паули принципі.Хунд ережесі.Клечковский ережесі. Орбиталдардың электрондармен толтыру реті:орбиталдарды электрондармен толтырғанда K,L,M,N,O,P,Q Бойынша толтырылады.Деңгейшедегі электрондардың максималды саны 2(2l+1) өрнекпен анықталады.Атомдық орбитальдар кванттық ұяшық түрінде көрсетіледі, деңгейшелердің максималды сиымдылығы:s-2,p-6,d-10,f-14электрон.Энергияның кішірею принципі:атомдағы электронның ең тұрақты күйіне нң кіші энергия мәні бар күйі сәйкес келеді,сондықтан алдымен ең кіші мәндегі қабаттар толтырылады.Паули принципі:бір атомның ішінде барлық жағынан ұқсас екі электрон болуы мүмкін емес,яғыни атомдағы 2 электронның 4 квант санының төртеуі де бірдей болмайды.Хунд ережесі:берілген энергетикалық днңгнйшедегі электрондардың спин сандарының қосындысы максималды болуы шарт,бұл жағыдайда атом тұрақты күйде болады.Клечковский ережесі:электронның берілгн екі жағдайының қайсысында бас және орбиталь квант сандарының қосындысы(n+l)үлкен болса,соның энергиясы үлкен болады.Егер(n+l) қосынды мәні бірдей бірнеше деңгейшелер болса,онда алдымен бас квант санының кіші мәніндегі деңгейше тола бастайды. 8.Иондану энергиясы,электронға тартқыштық, электртерістілік. Иондану потенциалы. Негізгі күйдегі бейтарап атомнан бір электронды бөліп алу үшін жұмсалатын энергияның шамасын иондану энергиясы (І) д.а.Иондану нәтижесінде атомдар оң зарядталған ионға айналады.Иондану энергиясы периотарда солдан оңға қарай артады.Негізгі күйдегі бейтарапты атомға электронды қосқанда жұмсалатын немесе берілетін энергияны электронға тартқыштық( E) деп атайды.Иондану энергиясымен электронға тартқыштық оғшауланған атомдардың күйін сипаттайды.Атомдардың оқшауланбаған күйін электртерістілік шамасы сипаттайды.Электртерістілік-қосылыстағы басқа атомдармен салыстырғандағы электрондық тығыздылықты элемент атомдарының өзіне тарта білу қабілеттілігі: χ=1/2 (І+Е) Период бойынша элеметтер электртерістілігінің өсуі, ал топшаларда оның азаюы байқалады.Элементтің электртерістілік мәні неғұрлым жоғары болса,соғұрлым атом зарядталған ионға оңай айналады.Электртерістілік мәні ең жоғар элементті-фтор: χF=4,00 11.Химиялық байланыстың табиғаты.Валенттілік теориясы. Тотығу дәрежесі туралы түсінік. Молекулалардың, иондардың, радикалдардың,сондай-ақ кристалдардың түзілуіне әкелетін атомдардың әрекеттесу құбылысын химиялық байланыс деп атайды.Мұнда- әрекеттесуші атомдар жүйесінің потенциалды энертиясының азаюы жүреді.Егер электрондардың спиндері антипаралелді болса,онда атомдар жақындаған кездегі жүйенің потециалды энергиясының азаюы орын алады және r=r0 болғанда тартылу күші тербелу күшіне теңеледі . Осы тұста жұйеның энергиясы өзінің ең кіші мәнін қабылдайды және турақты химиялық байланыс түзіледі. Егер спиндер паралелді болса, онда өзара жақындап келе жатқан атомдардың кез келеген арақашықтығы кзіндегі жүйенің потенциалдық энергиясы жеке-жеке алынған екі атом энергиясының қосындысынан артық болады.Валентілік – атомның химиялық байланыс түзуге қабілеттілігі. Бір элементтің өзі коваленттік не болмаса иондық қосылыстар түзеді.Тотығу дәрежесі деп молекула қурамындағы атомдарды шартты түрде электртерістілігіне сай оң және ионға айналады деп есептегендегі атомның зарядын айтады. Ол “+”немесе “-” таңбаларымен алынған рим сандарымен белгіленеді. 13. КОВАЛЕНТТІК БАЙЛАНЫС Коваленттік байланыс деп екеуіне ортақ электрондық жұптар арқылы іске асатын хим/қ бай/сты айтады.Коваленттік бай/с қасиеттері бір біріне жақын атомдар арасында түзіледі және бұл атомдардың жұптаспаған электрондары болу керек. Коваленттік байланыстың екі түрі болады полюсті және полюссіз.Ковалентті полюссіз бай/с электртерістігі бірдей атомдардың арасындағы екеуіне ортақ электрон жұбы арқылы түзілетін бай/с.Ковалентті полюсті бай/с әр түрлі екі атом арасында түзіледі сонда электрондық бұлт электр терістілеу атомға қарай ығысады.Ковалентті бай/стардың қасиеттері 1 Қаныға алатындығы-Ковалентті бай/стардың шектеулі санын түзуіне атомның қатынасуға қабілеттілігі2 Бағытталғандығы--молекуланың кеңістіктегі құрылымын шарттастырады, электрондық бұлттардың қайта жабылуы тек орбитальдардың өзара белгілі бір бағытталу тұсында жүреді, бұл өз кезегінде электрондардың қайта жабылуындағы ең үлкен электрондық тығыздылығты қамтамасыз етеді Коваленті байланыс,атомдық қоздыру нәтйжесінде пайда болатын,жуптаспаған электрондар есебінен де түзіле алады.бул донорлы-акцепоторлық механизым–ковалентілік байланыс түзілуінің басқа да механизымының бар болуымен байланысты.Бул механизымның мәні – атомдардың біреуі бөлінген электрондық жубын, ал басқасы бос орбиталдың береді. Донорлы-акцепоторлық механизмі аммони ионнының түзілу сұлбасымен жақсы көрнектенді.Егер элемент алмасу механзімі бойынша да , донорлы-акцепторлы механизім бойынша да ковалентті байланыс түзетін болса, онда оның валентілігі жұпталған электрондар санынан үлкен және электрондық қабаттағы орбиталдарлдың жапы санымен анықталады.Оларға енетідер:
12. П және σ байланыстар . бай/с ұзындығы мен энергиясы Түзілетін электрондық бұлттағы симметриясымен орбитальдардың бүркесу тәсіліне қарай П және σ бай/сты ажыратады.П жәнеσ байланыс ол әрекеттесуші атомдардың центірін қосатын ось бойымен электрондық бұлттардың қайта жабылуы кезінде түзіледі.П байланыс ол атомдармен перпендикулярлық центірін қосатын осьтің бойымен электрондық бұлттардң бүйірден қайта жабылуы тұсында түзіледі.П байланыс ,p-d,d-d,f-f орбитальдарының қайта жабылуы кезінде түзіледі. σ байланыс s-p,p-p,d-s орбитальдарының қайта жабылуы кезінде түзіледі. .П жәнеσ байланыс түйіскенде қос байланыс түзіледі.Жай ж\е қос байланыстың ұзындығымен энергиясын салыстырғанда,үш байланыстың энергиясы жоғары,ал ұзындығы қысқа.Байланыс энергиясы деп хим-қ байланысты үзуге жұмсалатынэнергияны айтады.Байланыс ұзындығы-ол атом ядроларының арақашықтығы. 14. ИОНДЫҚ БАЙЛАНЫҚ Иондық байланыс иондардыің электорстатикалық тартылу күштері арқылы жүзеге асатын хим/қ бай/с.Иондық байланыс электртерістіліктері әртүрлі болатын атомдардың арасында ғана түзіледі.Коссельдің теориясы бойынша металмен бейметалдың атомдары әрекеттескенде, электрнейтрал қосылыс түзіледі ,яғни иондардың зарядтары қарама қарсы және олардың атомдарының электр терістіктерінде үлкен айырмашылық болуы керек.Иондық қосылыстарда бір атомның басқаға толық ауысуы болмайды.Иондылық өлшем деп қосылыстарды түзетін элеменнт атомдарының электртерістіліктері арасындағы айырманы айтады.∆х=2 болса иондық байланыс.∆х үлкен болған сайын полярлығыда үлкен болады. 15.Металдық байланыс. Металдық байланыс-электрстатикалық тартылу нәтижесінде металдар иондарының және жалпыланған электрондар арасындағы түзілетін химиялық байланыстс айтады.Металдық байланыс тек қана бірінші текті өткізгіштерде болады. Металдық байланыс металдағы атомнан электрондар тұрақты күйде бөлінгенде пайда болады.Электрондарын берген металл атомдары оң зарядталған иондарға түрленеді,ал олар тұрақты қозғалыстағы электронды өзіне тартуға ұмтылады.Бос электрондар металдың барлық атомдарын өзара берік байланыстырады да металл торының беріктігін қамтамасыз етеді. Металдық байланыста электрондарды ортақтастыруға барлық атомдар қатысады.Металдық байланыс энергиясы коваленттіктен 3-4 есе аз. 16.Сутектік байланыс.Оның түзілу механизмі Сутектік байланыс құрамына сутегі мен электртерістігі күшті элемент-O,N,S,F,кіретін молекулалар арасында пайда болады.Сутектік байланыс әртүрлі молекулалар арасында ж\е бір молекула ішіндегі әртүрлі топтар арасында пайда болады.Сутек атомының ішкі электрондық қауызы болмағандықтан,теріс полюстенген атомның электрондық қауызының ішіне еніп кете алады.Сутектік байланыс суда ғана емес,полимерлерде,белокта,сан алуан кристалдық заттарда түзіледі. 17. Тотығу-тотықсыздану реакциялары деп электрондардың бір бөлшектерден екіншіге ауысуымен байланысты жүретін реакцияларды айтады,яғни әрекеттесуші молекулалар құрамына енетін элемент атомдарының тотығу дәрежесінің өзгеру.Тотығу процесі– атомның электрондарды беріп тотығу дәрежесінің өсуі.Тотықсыздану процесі-атомның электронды қосып алып тотығу дәрежесінің кемуі.Тотығу-тотықсыздану реакциялары 4 бөлінеді:1)молекула ішілік-тотықтырғышпен тотықсыздандырғыштың ролін иондағы элемент атомдары атқарады.Бұл реакция температуралық қыздырумен альфа бөлшекпен атқылау кезінде жүреді.2)молекулааралық-жайж\е күрделі заттармен иондардың қатысуымен жүреді.Бір заттағы екі элемент атомы бірден тотығуға да тотықсыздануғада қатыса алады.3)дисмутация-элемент атомдарының тотығу дәрежесінің бірден жоғарылауымен төмендеуңі арқылы жүреді.4)конпропорциялану-реакцияда атомдардың тотығу дәрежесі теңеседі.Қасиеттеріне қарай элементтері 3 топқа бөлінеді1)тотықтырғыш а) қосылыстарда ең жоғары тотығу дәрежесін көрсететін элем атомы. б) F,O атомдары мен молекулалары 2. тотықсыздандырғыштара)s,p,d,f ұяшықтарының металдың бос атомдары б) қосылыстарда ең теріс тотықсыздану дәрежесін көрсететін элем атомдары 3. тотықтырғыш та,тотықсыздандырғыш та жатады.а)4-6 топшалардың бейметал молекулалары б) қосысылғыштар аралығында оң тотығу дәрежесін көрсететін элем атомдары в) асқын тотық қосылыстар Электрондық баланс әдісі реакцияға қатысқан және түзілген заттардағы элементтердің тотығу дәрежелерін салыстыруға негізделген. Мысалы 3+ 7+ 5+ 2+ KNO2+NaMn7+O4+H2SO4 KNO3+MnSO4+Na2SO4+H2O N3+-2e=N5+ 5 тотығу пр зат тот-сыз-ғыш Mn0+5e=Mn2+ 2 тотықсыздану пр зат тот-р-ғыш 5KNO2+2NaMnO4+H2SO4=5KNO3+2MnSO4+Na2SO4+H2O Ионды-электрондық әдіс тотықсыздандырғыштың тотығуының,тотықтырғыштың тотықсыздануының иондық теңдеулерін жеке-жеке құрып,содан соң оларды жаолпы иондық теңдеуге біріктіруге негізделген. Мысылы Na2CO3+HOH NaHCO3+NaOH 2Na++CO32-+HOH Na++HCO3-+Na++OH- CO32-+HOH HCO3-+OH- санын сол реакцияның молекулалығы д.а. 18.Электрохимиялық процестердің анықтамалары мен жіктелуі.Электродтық потенциалдар туралы түсінік.Стандартты электродтық потенциалдар.Металл электродының потенциалын есептейтін Нернст теңдеуі.Химиялық және электрлік түрдегі энергияның өзара бірінің- біріне айналуымен шұғылданатын ғылым саласын электрохимия,ал процестің өзін–электрохимиялық процесс д.а.Электрохимиялық процестердің түрлері: гальваникалық элемент және электролиз.Гальваникалық элемент дегеніміз – химиялық энергияны электр энергиясына айналдыратын қондырғы.Гальваникалық элемент өз тұздарының ерітіндісіне батырылған екі электродтан тұрады.Электролиттің ерітіндісі немесе балқымасы арқылы тұрақты ток өткенде электродтарда жүретін тотығу- тотықсыздану реакцияларын электролиз деп атайды.Электродтық потенциал дегеніміз—қос электрлі қабаттағы потенциалдар айырымын айтамыз.Металдың химиялық белсенділігін сипаттайтын шама – стандартты электродтық потенциал деп атайды. Нернст теңдеуі : 19..Гальваникалық элемент.Гальваникалық элементтің электр қозғаушы күші.Концентрациялық элемент. Гальваникалық элемент дегеніміз–химиялық энергияны электр энергиясына айналдыратын қондырғы.Гальваникалық элемент өз тұздарының ерітіндісіне батырылған екі электродтан тұрады. Гальваникалық элемент жұмыс істегенде электрод потенциалдарының ең максимальды айырмасы элементтің электр қозғаушы күші (Е) деп аталады.Концентрациялық элемент деп әртүрлі концентрациялардағы тұздардың ерітінділеріне батырылған екі бірдей электродтан тұратын жүйені айтады. 20.Газ электродтары.Сутектік және оттектік электрод/ң потенциал/н есептеу.Сутек электрондарының стандарты потенциалы ол 298К температурадағы сутек қысымы 1 атмосфера ж\е ерітіндідегі сутек иондарының белсенділігі бірге тең кездегі потенциалы.Иондану энергия/ң мәні үлкен болған/н асыл метал/р Au, Pt және т.б. ион/ры ерітін/ге беру арқылы потен/р айырма/н түзбейді.Ерітін/де бұл метал/ң иондарының болмауы асыл метал ерітінді шекара/да потенц/р айырмасы түзілуіне маңызды қызметті молекулалар ,атомдар және ортадағы иондарды іріктеп (таңдап) жұту арқылы жүргізіледі: стандартты сутектік электрод дег/з сутегі иондары/ң ( Н ) активтік концен/сы (1 моль/л-ге) тең күкірт қышқылына батырылған беті электролитттік жолмен кеуек платинамен қапталған платина электроды.Платина пластикасы (электроды ) арқылы атмосфералық қысыммен сутегі газы жіберіледі, сутегі молекулалары кеуек платинада адсорбцияланады ж/е онда жақсы ериді.Плати/ң катализ/ры ретінде әсер етуінің нәтиж/де сут/і молек/ры аздап атомды/ға ыдыратады. 21.Тотығу-тотығсыздану потенциалдары  мұндағы n-электрондар саны.F-Фарадей тұрақтысы. Электроттық потенциалдың пайда болу мәні :егер металл жолағын Me сол метал ионы бар ертіндіге енгізсе онда келесі құбылыс жүреді де мұндағы n-электрондар саны.F-Фарадей тұрақтысы. Электроттық потенциалдың пайда болу мәні :егер металл жолағын Me сол метал ионы бар ертіндіге енгізсе онда келесі құбылыс жүреді де металл мен ертінді арасында потенцалдар айырымы пайда болады,оны электроттық потенциалдар деп атайды.Бұл айырма металл табиғатына және ертіндідегі иондардың концентратциасына ,сол сиақты температураға тәуелді.Стандартты жағдайда жүретін реакциалар үшін,Гиббс энергиасы мен электодық потенциалы арасындағы байланыс теңдеуімен өрнектеледі: металл мен ертінді арасында потенцалдар айырымы пайда болады,оны электроттық потенциалдар деп атайды.Бұл айырма металл табиғатына және ертіндідегі иондардың концентратциасына ,сол сиақты температураға тәуелді.Стандартты жағдайда жүретін реакциалар үшін,Гиббс энергиасы мен электодық потенциалы арасындағы байланыс теңдеуімен өрнектеледі: Мұндағы Мұндағы  шамасын стандартты электродтық(тотығу-тотықсыздану)потенциалы деп атайды.Яғыни заттың тотыққан және тотықсызданған формалары бар ертіндіге инертті электрод батырылғанда пайда болатын потенциалды тотығу-тотықсыздану потенциалы деп атайды.Потенциалын есептейтін Нернст теңдеуі: шамасын стандартты электродтық(тотығу-тотықсыздану)потенциалы деп атайды.Яғыни заттың тотыққан және тотықсызданған формалары бар ертіндіге инертті электрод батырылғанда пайда болатын потенциалды тотығу-тотықсыздану потенциалы деп атайды.Потенциалын есептейтін Нернст теңдеуі:  22.Электро/қ процес/ң/ң кинетикасы.Электрод потенциалы өзгереді-бұл құбылысыты поляризация д/ді.  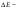 поляр. Дейді. поляр. Дейді.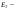 тепе-теңдік потенциалы.Поляризация құбылысы анодта да, катодта да, байқалуы мүмкін, сонд/н поляризац/ны анодтыққа тепе-теңдік потенциалы.Поляризация құбылысы анодта да, катодта да, байқалуы мүмкін, сонд/н поляризац/ны анодтыққа 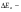 ж/е потенциалдыққа ж/е потенциалдыққа 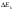 бөледі.Сондай-ақ ток өткендегі потенциалдық өзгеруін аса кернеулік д/а.Ток тығыздығына потенциал/ң графикалық тәуелдігі поляризаци-қ қисық д/ді. бөледі.Сондай-ақ ток өткендегі потенциалдық өзгеруін аса кернеулік д/а.Ток тығыздығына потенциал/ң графикалық тәуелдігі поляризаци-қ қисық д/ді.  i-ток тығыздығы, S-электрод/қ беттік аудан алаңы.а)Электрохимиялық поляризация(аса кернеулік) ол реакциан/ң электрохимиялық кезеңі баяулауымен байланысты потенциал/ң өзгеруі мұны, яғни баяулатылған разряд теориасын ұсынған орыс ғалымы А.Н.Фрумкин.Электрохимиялық аса кернеулікпен i-ток тығыздығы, S-электрод/қ беттік аудан алаңы.а)Электрохимиялық поляризация(аса кернеулік) ол реакциан/ң электрохимиялық кезеңі баяулауымен байланысты потенциал/ң өзгеруі мұны, яғни баяулатылған разряд теориасын ұсынған орыс ғалымы А.Н.Фрумкин.Электрохимиялық аса кернеулікпен  ж/е ток тығыздығы арасындағы байланысты Тафель теңдеуімен өрнектейді: ж/е ток тығыздығы арасындағы байланысты Тафель теңдеуімен өрнектейді: а,в-тұрақтыб) концентрациалық поляризация-электрод айналасындағы қабатта ток өткенде байланысты электродтың потенциалының өзгеруі: а,в-тұрақтыб) концентрациалық поляризация-электрод айналасындағы қабатта ток өткенде байланысты электродтың потенциалының өзгеруі:  i-ток тығыздыға, i-ток тығыздыға,  шекті ток. шекті ток. Ертінді көлеміндегі реагент/ң конц, D-диффузия коэфиценті. Ертінді көлеміндегі реагент/ң конц, D-диффузия коэфиценті.   диффузия қабат қалыңдығы Сұйықтықты алмастырмаған кезде ондағы молекулалар тек қана диффузиның арқасында қозғалып, электрод бетінің жанында жұқа қабатты түзеді. Бұл жұқа қабат диффузиялық қабат д.а. диффузия қабат қалыңдығы Сұйықтықты алмастырмаған кезде ондағы молекулалар тек қана диффузиның арқасында қозғалып, электрод бетінің жанында жұқа қабатты түзеді. Бұл жұқа қабат диффузиялық қабат д.а. 23.Электрод/ң ертіндісі н/е балқымасы арқылы тұрақты ток өткен кезде электродтарда жүретін тотығу-тотықсыздану реакциаларын электрлиз д.а.Тотықсыздану реакциасы жүретін электрод(катд) токтың сыртқы тізбегінің теріс полюсына, ал тотығу реакциасы жүретін электрод (анод)-оң полюсына қосылады.Натрий хлориді балқымасын электролиздегенде электродтарда өтетін реакциаларды қарастыр/қ.а) теріс заряд/н катодта натрий иондары металдық натрийге дейін тотықсызданады  б)оң зарядталған анодта хлорид-иондары газды хлорға дейін тотығады б)оң зарядталған анодта хлорид-иондары газды хлорға дейін тотығады  Электролиз процесінің жалпы теңдеуі: Электролиз процесінің жалпы теңдеуі:  Электролиз өзінен-өзі жүрмейтін реакция, өйткені электрлік ток түріндегі энергияны жұмсауды талап етеді.Электролит/ң сулы ертінді/ң электролизі күрделі сипатта өтеді, өйткені онда су диссоцияға ж/е электролизге түседі.Токтың қаншалықты пайдалы жұмсалғанын сандық мөлшер тұрғысынан сипаттау ток бойынша шығым д.а. Электролиз өзінен-өзі жүрмейтін реакция, өйткені электрлік ток түріндегі энергияны жұмсауды талап етеді.Электролит/ң сулы ертінді/ң электролизі күрделі сипатта өтеді, өйткені онда су диссоцияға ж/е электролизге түседі.Токтың қаншалықты пайдалы жұмсалғанын сандық мөлшер тұрғысынан сипаттау ток бойынша шығым д.а.  Ағылшын ғалымы М.Фарадей 1833 ж ұсынылған электролиз заңдары:1) электродтарда электрохим/қ түрленуге түскен заттың мөлшері: өткен электр тогының мөлшеріне тура пропорционал Ағылшын ғалымы М.Фарадей 1833 ж ұсынылған электролиз заңдары:1) электродтарда электрохим/қ түрленуге түскен заттың мөлшері: өткен электр тогының мөлшеріне тура пропорционал  Фарадей заңдарын біріктіру мынадай теңдеуге әкеледі: Фарадей заңдарын біріктіру мынадай теңдеуге әкеледі:  F-Фарадей тұрақ/сы F-96500 2)электр тоғының мөлшері тұрақты болған кезде электродтағы әрекеттескен заттардың массасы бір-біріне олардың эквиваленттерінің молярлық массасы ретінде қатысады.Электрохимиялық процестер таза металл алуда,металды қабатпен қаптауда,қалдықтан тазартуда қолданылады. F-Фарадей тұрақ/сы F-96500 2)электр тоғының мөлшері тұрақты болған кезде электродтағы әрекеттескен заттардың массасы бір-біріне олардың эквиваленттерінің молярлық массасы ретінде қатысады.Электрохимиялық процестер таза металл алуда,металды қабатпен қаптауда,қалдықтан тазартуда қолданылады.24.Қоршаған ортаның әсерінен металдың жаңа химиялық қосылыс түзе күйреуін – коррозия дейміз. Коррозияның күнде кездесетін мысалы- темірдің таттануы-темір ауадағы оттекпен тотығып, беті таттанады. Коррозия–металдарды қоршаушы ортаның әсерінен, өздігінен тотығу процесі. Коррозияның бір түрі –химиялық коррозия, ол қышқыл, сілті, тұздардың ерітінділерінің және түрлі газдардың (СО2, НСl т.б. ) тікелей әрекеті. Электрохимиялық коррозия- ол болу үшін электрохимиялық процесс өту керек, ондай процесс үшін екі электрод және элекродттар батырылған электролиттер болуы керек. Металл таза болса коррозияға ұшырамайды. Көптеген металдардың бетін азот қышқылы тәрізді тотықтырғышпен өңдегенде коррозия күрт баяулайды. Мұндай металл бетіндеқорғаушы қабат түзіп тоттануды азайтатын заттарды ПАССИВАТОРЛАР(ингибаторлар) дейді. Керісінше тездететін заттрады АКТИВАТОРЛАР дейді. Коррозиямен күрес – металл бұйымдарын бояу,оксидирлеу(металл бетіне осы металлдың оксидінің тыығыз қабатын алу),анодтау, электролиз арқылы металлмен қаптау, ол катодтық (белсенділігі төмендеу металл қабығы) және анодтық (белсенділеу металл қабығы) болады.,протекторлық қорғау,фосфаттандыру,Ингибаторларды қолдану, олар металл бетіне адсобцияланып оның потенциялын оңды етеді, осы арқылы жемірілу процесін баяулатады. ,электрмен қорғау 26.Металдардың физика-химиялық қасиеттері. Металдарды алудың негізгі әдістері Металдардың жалпы қасиеттеріне кристалл торларының ерекше құрылысы себепші болады. Металдардың барлығына тән қасиет - металдық жылтыр. Металдар сондай- ақ радиотолқынын да шағылыстыра алады. Металдар- электр мен жылуды жақсы өткізгіштер.Металдардың электрөткізгіштігі мен жылу өткізгіштігі Hg–нан Ag-ға қарай артады: Hg ,Pb,Fe,Zn,Mg.Al,Au,Cu,Ag Мыс пен алюминий электрді жақсы өткізетін металдар болғандықтан, оларды электрөткізгіштер ретінде пайдаланады.Металдар атомдарының химиялық реакция кезінде валенттік электрондар беріп, оң зарядты ионға айналуы олардың ең жалпы химиялық қасиеті болып табылады, яғни металдар реакция кезінде тотықсыздандырғыш болып келеді. Металдр электртерістігі күшті галогендермен, оттегімен, күкіртпен қуаттырақ әрекеттеседі. Бұл реакцияларда сәйкес келетін бейметалдар тотықтырғыш болып табылады. Металдар, сондай- ақ сутегі иондарымен де, басқа металдар иондарымен де тотыға алады.Li, K, Ca, Na, Al, Zn, Cr, Fe, Ni, Sn, Pb, H, Cu, Ag, Pt, Au Бұл қатар металдар кернеуінің электрохимиялық қатары деп аталады. Мұндай қатардағы ең актив элемент литий екен.Кернеудің электрохимиялық қатарындағы солға қарай тұрған металл оңға қарай орналасқан металл тұзының ерітіндіснен немесе балқымасынан металды ығыстырып шығара алады.Кернеудің электрохимиялық қатарына сондай -ақ сутегі де енеді. Бұл металдардың қайсысы қышқыл ерітіндісінің сутегіні ығыстыра алатынына қорытындыжасауға мүмкіндік береді. Металдады алу әдістеріАктивтігі жоғары металдар (Na,K, Ca, Mg) электролиз әдісімен алынады. Активігі аз металдарды оладың оксидінен көмірмен, көміртегі оксидімен неме алюминий оксидімен тотықсыздандырады, ал металл сульфидтерін алдымен өртейді. 27.Метал құймалары,қатты ерітінділер және интерметалдық қосылыстар. Металдар таза түрінде сирек пайданылады. Көбінесе металдардан түзілген,бірақ сол металдардың металдардың қасиеті сақталмайтын құймаларды қолданады. Құймаларды алу балқытылғанметалдардың бірінің бірінде еруіне негізделген.Балқыған металдарда кейбір бейметалдар да ериді, Құймалар құрамы және құрылысы бойынша ажыратылады.Солардың маңыздыларын қарастырып көрейік. 1,балқыманы салқындатқан кезде біртекті кристалдар түзіледі. Олардың кристал торларының түйіндерінде әртүрлі метал атомдары болады. Мұндай жағдайда қатты ерітінді түзіледі. 2. Балқыманы салқындатқан кезде жеке металдардың кішкене кристалдары бөлінеді. Мұндай жағдайда құйма металдардың қарапайым қоспасы ғана болады да қатты ерітінді түзілмейді. 3. Металдар өзара еріген кезде олардың атомдары өзара әрекеттесіп метал аралық қосылыс түзіледі. Балқыған металдарда бейметал еріген кезде химиялық реакция жүруі мүмкін. Металдардың құймасын араластырғанда түзілетін металдардың өзара химиялық қосылысы интерметаллидтер деп аталады. |
