полная версия шпор. 1) Идеальный газ. Уравнение состояния (уравнение взаимосвязи между параметрами состояния P, V, T). Охарактеризовать величины, входящие в состав урия состояния
 Скачать 0.8 Mb. Скачать 0.8 Mb.
|
При И. газов в виде струи наблюдается то же основное явление сжатия струи, что и при И. жидкостей. Его легко заметить, если наблюдать И. струи окрашенного газа или табачного дыма. Замечательно, что коэффициент сжатия струи (K) для газов весьма близок по величине к тому же коэффициенту для жидкостей. Так, по Вейсбаху, величины K: При течении по трубам законы И. для газов те же, что и для жидкостей; скорость И. замедляется и выражается уже формулой (14.) где d — диаметр трубки, l — длина трубки, а — величина, характеризующая трение воздуха о стенки трубки. По Вейсбаху, для стекла равно 0,02197, а по Д'Обюисону для металлических труб — 0,0238. Этот последний ученый нашел из целого ряда опытов эмпирическую формулу, дающую достаточно точно количество вытекающего по трубе в единицу времени газа, именно: , где p выражено в давлении ртутного столба. При И. газов из волосных трубок они следуют, как и жидкости, закону Пуазейля. И. газов из волосных трубок пользуются для определения внутреннего трения их. При И. газы образуют струи, представляющие все особенности жидких струй — реакцию (ракеты, отдача от выстрелов), удар струи и т. д. (см. Струя). При действии мгновенных сил И. газов происходит в виде вихря (при взрывах, при образовании фосфористого водорода и т. д.). Теория И. газов весьма важна для техники — газопроводного дела, устройства пневматической передачи, воздуходувных приборов, вентиляционных и дымовых труб; в науке она важна для теоретической метеорологии (ветры). Значительные математические трудности замедляют пока полную разработку вопросов об И. газов и паров. 22=47. 23) Второй закон термодинамики. Осн. формулировки. Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами. Этот закон устанавливает особенность превращения теплоты в работу в тепловых двигателях. Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая невозможность перехода всей внутренней энергии системы в полезную работу. Существуют несколько эквивалентных формулировок второго начала термодинамики: Вечный двигатель 2-го рода можно осуществить, если теплоту Q2 передать от холодного источника к горячему. Но для этого теплота самопроизвольно должна перейти от холодного тела к горячему, что невозможно. Отсюда следует 2-я формулировка (Клаузиуса):"Теплота не может самопроизвольно переходит от более холодного тела к более нагретому". Для работы теплового двигателя необходимы 2 источника – горячий и холодный. 3-я формулировка (Карно): "Там где есть разница температур, возможно совершение работы". Фор-ка Больцмана: «Все естественные процессы в природе идут в направлении равновесия с окружающей средой». ?28. Дифференциальные уравнения конвективного теплообмена На основании рассмотренного выше представления о процессах переноса теплоты при движении жидкости вдоль твердой поверхности получим уравнение, описывающее процесс теплоотдачи на границах тела. Так как у поверхности твердого тела имеется слой неподвижной жидкости, то для этого слоя можно использовать закон Фурье. Принимая, что ось Оу направлена перпендикулярно поверхности, запишем Однако Приравнивая эти уравнения получим Уравнение это называют дифференциальным уравнением теплоотдачи. Если в дифференциальное уравнение теплопроводности подставить конвективное изменение температуры, обусловленное течением жидкости: где wx, wy и wz – проекции скорости жидкости на координатные оси, то можно записать Иными словами говоря, если через изучаемый нами элементарный объём движется со скоростью w некое температурное поле, то дифференциальное уравнение теплопроводности следует накладывать на это поле. Для строго описания процессов конвективного теплообмена к дифференциальному уравнению (10.3) следует добавить уравнение (Навье-Стокса) движения вязкой жидкости, вытекающее из второго закона Ньютона, уравнение сплошности и неразрывности жидкости и учесть зависимость плотности жидкости от температуры. Такая система уравнений описывает большой класс явлений — процессы конвективного теплообмена между жидкостью и твердой стенкой. Эти уравнения должны быть дополнены условиями однозначности, характеризующими конкретные особенности той или иной рассматриваемой задачи. 31. Раб. тело, его назначение. Преимущества исп-я газообразных продуктов сгорания перед водяным паром. Рабочее тело – вещество, которое используется в тепловых машинах для преобразования теплоты в работу. В качестве рабочего тела используются газы и пары, т.к они обладают большим коэффициентом теплового расширения и могут при нагревании совершать большую работу, чем жидкие и твердые тела. Идеальный газ – газ при изучении свойств которого можно пренебречь силами взаимодействия между молекулами и объемом самих молекул. Пример: N2, O2, H2, исключение составляет водяной пар, который может встречаться в различных состояниях: 1) водяной пар является частью газовых смесей, которые получаются в результате сгорания топлива в различных агрегатах. Тогда порциальное давление пара мало, а t пара высока и он далек от состояния жидкости. Такой водяной пар может считаться идеальным газом. 2) водяной пар является рабочим телом в паровых двигателях или теплонасосом в различных то аппаратах. В этом случае пренебрегать силами сцепления между молекулами и V самих молекул нельзя, т.к его состояние близко к состоянию жидкости. Этот водяной пар называется реальным газом и он уже не подчиняется законам идеальных газов. 36. Закон Ньютона-Рихмана. q=α*Δt - Тепловой поток (выражается в Вт/м²) на границе тел пропорционален их разности температур. α-коэффициент теплопередачи (Вт/(м2*К)) Зависит от шероховатости поверхности Количество теплоты отдаваемой от рабочего тела к наружной поверхности стенки прямопропорциональна разности температур между рабочим телом и поверхностью стенки. Δt=tрт-tс, Δt=tс-tрт 37. Теоретический цикл теплового двигателя. Цикл Карно́ — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Цикл карно состоит из 2 изотерм и 2 адиабат. 1-2 – обратимое адиабатное расширение при s1=Const. Температура уменьшается от Т1 до Т2. 2-3 – изотермическое сжатие, отвод теплоты q2 к холодному источнику от рабочего тела. 3-4 – обратимое адиабатное сжатие при s2=Const. Температура повышается от Т3 до Т4. 4-1 – изотермическое расширение, подвод теплоты q1 к горячего источника к рабочему телу. 44. Токсичность продуктов сгорания Токсичными называют вещества, оказывающие негативные воздействия на организм человека и окружающую среду. Основными токсичными веществами являются оксиды азота (NOх), оксид углерода(СО), различные углеводороды(СН), сажа и соединения, содержащие свинец и серу. NO – при сгорании азотсодержащих полимеров образуются. Действует на кровь. NO2 - бурый газ. Раздражение слизистых. Оттёк лёгких. СО – мало растворим в воде. Получается при неполном сгорании органики. СО легко проникает через пористые материалы. Связь гемоглобина с СО прочнее, чем с О2. Вдыхание 5 % СО в составе воздушной смеси в течении 5-10 минут - смертельно. (СН) состоят из исходных или расплавленных молекул топлива, которые не принимали участия в сгорании. Особое влияние оказывают выбросы бензола, толуола, полициклических ароматических углеводородов(ПАУ) и в первую очередь бензпирена. ПАУ относятся к концерогенным веществам, они не выводятся из организма а со временем накапливаются и способствуют образованию злокачественных опухолей. Сажа-твердый продукт, состоящий в основном из углерода. Представляет собой механический загрязнитель носоглотки и легких. Свойство сажи-накапливать на своей поверхности канцерогенные вещества 50.Термодинамические основы получения холода. Согласно второму началу термодинамики, указанный выше перенос теплоты самопроизвольно не происходит, требуя затрат работы. В термодинамич. процессах подвод или отвод теплоты q описывается через изменение энтропии dS системы: dq = TdS, где Т - т-ра. Отсюда следует, что при подводе к телу теплоты его энтропия возрастает, а при отводе теплоты -уменьшается. В непрерывных холодильных процессах хладагент должен принять теплоту от охлаждаемого тела на ниж. температурном уровне, отдать теплоту на верх. уровне к.-л. теплоприемнику и вернуться в исходное состояние. Поэтому в установившемся процессе суммарная энтропия хладагента не изменяется (dS=0). Поскольку при передаче теплоты от охлаждаемого тела энтропия хладагента повышается, в любой холодильной установке должен проходить иной (компенсирующий) процесс, при к-ром энтропия хладагента уменьшается. В общем случае энтропия м. б. представлена как ф-ция т-ры и к.-л. другого параметра тела (напр., давление, фазовое состояние, степень намагниченности). Поэтому, если имеется изотермич. или близкий к нему процесс, в к-ром наблюдается значит. изменение энтропии при изменении иного параметра, то подобный процесс можно рассматривать как потенциальную основу для создания холодильных установок. К таким процессам относятся, напр., изотермич. процессы сжатия либо адсорбции газов, намагничивания парамагнетиков и сверхпроводников. При этом низкая т-ра достигается соотв. в адиабатич. процессах расширения и десорбции газов, размагничивания парамагнетиков и сверхпроводников (см. ниже). Перечисленные и иные процессы искусств. охлаждения в большинстве случаев осуществляются: 1) путем теплообмена между охлаждаемыми в-вами и хладагентами - испаряющимися низкокипящими жидкостями, т-ра к-рых за счет уменьшения энтальпии i понижается до т-ры кипения при давлении испарения; 2) изоэнтальпийным (i = const) расширением газов, предварительно сжатых в компрессорах, или жидкостей при их прохождении через сужение (вентиль, кран, пористая перегородка), т. е. их дросселированием (процесс протекает адиабатически без совершения внеш. работы) с использованием эффекта Джоуля - Томсона, или дроссельного эффекта,- отрицат. либо положит. изменения т-ры тела при отсутствии подвода к телу или отвода от него теплоты; 3) адиабатическим (изоэнтропийным, S = const) расширением газов с совершением внеш. работы в т. наз. детандерах - машинах, устроенных подобно поршневому компрессору или турбокомпрессору (см. Компрессорные машины); 4) сочетанием обоих методов расширения. 13) Классификация термодинамических процессов и их применение в термодинамических процессах. Цель анализа термодинамических процессов. Часто встречаются такие процессы изменения состояния газов, которые протекают в условиях, ограничивающих характер изменения их состояния. Изохорный процесс (процесс при постоянном объеме рабочего тела). Примером такого процесса может служить нагревание или охлаждение газа в закрытом сосуде. Уравнение процесса будет иметь вид V = const. Соотношения между параметрами газа в процессе будет определяться Р1/Т1 = Р2/Т2. В изохорных процессах теплота, сообщаемая газу, идет только на увеличение его внутренней энергии, а отвод теплоты возможен только за счет уменьшения внутренней энергии. q = = Cv (Т2 – Т1). 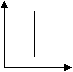 dq>0 dq>0Изобарный процесс (процесс при постоянном давлении рабочего тела). Уравнение процесса Р = const. В соответствии с законом Гей-Люссака для процесса можно написать V 1/Т1 = V 2/Т2. Теплота, сообщаемая идеальному газу в изобарном процессе, увеличивает его энтальпию. q = dh = CpdТ. Изобарный процесс – это процесс сгорания в цикле дизеля (ДВС), процесс сгорания и выхлопа в газотрубных установках (ГТУ) и воздушно-реактивных двигателях (ВРД).  dq>0 dq>0Изотермический процесс (процесс при постоянной температуре рабочего тела). Уравнение этого процесса для идеального газа выражает закон Бойля – Мариотта Т = const. График изотермического процесса в РV-диаграмме будет изображаться равнобокой гиперболой, называемой изотермой. dU=0. P*v=const/ 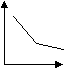 dq>0 dq>0Используется для описания подвода и отвода тепла в паросиловых установках и холодильниках. Адиабатный процесс (процесс при отсутствии теплообмена между рабочим телом и внешней средой). dq=0, т.к процесс проходит без подвода и отвода теплоты. Уравнение взаимосвязи между параметрами Р1/Р2 = (V2/V1)k, T1/T2 = (V2/V1)k-1, T1/T2 = (P1/P2)(k-1)/k, где к = 1,67 (для одноатомных газов), для двухатомных к = 1,4, для трех- и многоатомных к = 1,29. Адиабатный процесс – это процесс в цикле дизеля (ДВС), процессы сжатия и расширения, процессы истечения в газотрубных установках (ГТУ) и воздушно-реактивных двигателях (ВРД).  dU = CvdТ Цель анализа процессов – установление энергетической возможности и состояния рабочего тела в этих процессах. Политропный процесс (удельная теплоёмкость c газа остаётся неизменной). Предельными частными явлениями политропного процесса являются изотермический процесс и адиабатный процесс. В случае идеального газа изобарный процесс и изохорный процесс также являются политропическими. Для идеального газа уравнение политропы может быть записано в виде: pVn = const. Используется для описания процессов расширения и сжатия в расчетных циклах двс. 20. Теплопроводность — это молекулярный перенос теплоты между непосредственно соприкасающимися телами или частицами одного тела с различной температурой, при котором происходит обмен энергией движения структурных частиц (молекул, атомов, свободных электронов). При выводе дифференциального уравнения теплопроводности считаем, что тело однородно и изотропно (то есть физические свойства тела не зависят от выбранного в нём направления), физические параметры l, с (теплоемкость), и r (плотность) постоянны, внутренние источники теплоты равномерно распределены в теле. Под внутренними источниками теплоты понимаются тепловыделения, например, в тепловыделяющих элементах атомных реакторов, или при прохождении тока в электрических проводниках. Внутренние источники теплоты характеризуются величиной qv — количеством теплоты, которое выделяется в единице объема в единицу времени. Величину называют коэффициентом температуропроводности и обозначают буквой a. Существуют различные условия однозначности: геометрические — характеризующие форму и размеры тела, в котором протекает процесс теплопроводности; физические — характеризующие физические свойства тела; временные — характеризующие распределение температуры тела в начальный момент времени; граничные — характеризующие взаимодействие тела с окружающей средой. Граничные условия в свою очередь бывают трех родов: 1) первого рода, задается распределение температуры на поверхности тела в функции времени; 2) второго рода, задается плотность теплового потока для всей поверхности тела в функции времени; 3) третьего рода, задаются температура окружающей среды tж и закон теплоотдачи между поверхностью тела и окружающей средой — закон Ньютона—Рихмана: 26)основные виды теплообмена. Теория теплообмена представляет собой науку, которая изучает законы распространения и передачи теплоты м/у телами в пространстве. Теплообмен - самопроизвольный процесс переноса внутренней энергии от тел с большей температурой к телам с меньшей температурой. Различают три элементарных вида теплообмена: теплопроводность, конвекцию и тепловое излучение (радиация). Теплопроводность - это процесс переноса теплоты м/у непосредственно соприкасающимися телами или частями одного итого же тела. Она обусловлена тепловым движением и энергетическим взаимодействием структурных частиц (молекул, атомов, электронов). Конвекция наблюдается в жидкостях (в теории теплообмена под термином «жидкость» понимают любую среду, имеющую текучесть - собственно жидкости, газы, расплавленные металлы). Перенос теплоты в жидкостях происходит просто за счет перемешивания объемов с различной температурой. Тепловым излучением наз. явление переноса теплоты в виде электромагнитных волн или фотонов, возникающих в результате сложных молекулярных и атомных возмущений. При тепловом излучении происходит двойное превращение энергии: внутренняя энергия излучающего тела переходит в лучистую и обратно - лучистая энергия, поглощаясь телом, переходит во внутреннюю энергию. Элементарные виды теплообмена в отдельности на практике встречаются редко, а действуют, как правило, в каком либо сочетании. Различают следующие сложные виды теплообмена. Совместный процесс конвекции и теплопроводности называется конвективным теплообменом. Частный случай конвективного теплообмена, когда теплообмен происходит между жидкостью и поверхностью твердого тела называется конвективной теплоотдачей или просто теплоотдачей. Совокупность значений температуры для всех точек пространства в данный момент времени наз. температурным полем, t=f(x,y,z,τ). Уравнение явл. математическим выражением такого поля. При этом, если t-ра меняется во времени, поле называется нестационарным, а если не меняется —стационарным. Т-ра может быть функцией одной, двух и трех координат. Соответственно этому и температурное поле называется одно-, двух- и трехмерным. Наиболее простой вид имеет уравнение одномерного стационарного температурного поля: t = t(x). При любом температурном поле в теле всегда имеются точки с одинаковой t-рой. Геометрическое место таких точек образует изотермическую поверхность. Тепловой поток. Количество теплоты, переносимое ч/з какую-либо изотермическую пов-ть в ед. времени, наз. тепловым потоком Q, Вт. Тепловой поток, отнесенный к ед. площади изотермической пов-ти, наз. плотностью теплового потока q, Вт/м2. |
