1. Йодоформная проба при нагревании спирта с йодом в щелочной среде дает жёлтый осадок с характерным запахом йдоформа
 Скачать 60.91 Kb. Скачать 60.91 Kb.
|
|
Подлинность. 1).Йодоформная проба при нагревании спирта с йодом в щелочной среде дает жёлтый осадок с характерным запахом йдоформа: C2H5OH + 4I2 + 6NaOH CHI3 + 5NaI + HCOONa + 5H2O 2).Реакция образования сложного эфира с ледяной уксусной кислотой:  Образующийся этилацетат имеет своеобразный запах свежих яблок. Образующийся этилацетат имеет своеобразный запах свежих яблок.3). Цветная реакция с раствором дихромата калия. В присутствии серной кислоты происходит образование солей хрома (III), имеющих зеленое окрашивание, и появляется запах ацетальдегида: 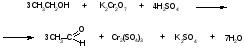 4). При окислении этанола перманганатом калия в сернокислой среде образуется также ацетальдегид. Если пробирку с реакционной смесью накрыть фильтровальной бумагой, смоченной раствором нитропруссида натрия и пиперидином, то выделяющийся ацетальдегид приведет к появлению синего пятна. Спирт этиловый может содержать примеси различных веществ, образовавшихся в процессе производства или хранения. Поэтому спирт этиловый подвергают проверке на содержание примесей восстанавливающих веществ, органических оснований, альдегидов, сивушных масел, дубильных и других экстрактивных веществ, метилового спирта, фурфурола. Примесь метанола можно обнаружить химическим методом, используя реакцию окисления перманганатом калия: 5CH3OH+2KMnO4 +3H3PO4 5HCOH + 2MnHPO4 + K2HPO4 + 8H2O Образовавшийся формальдегид открывают с помощью хромотроповой кислоты (реакция должна быть отрицательной). Восстанавливающие вещества обнаруживают по степени обесцвечивания 0,02% раствора перманганата калия (сравнение с эталоном). Количественное определение.
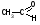 3C2H5OH + K2Cr2O7 + 8HNO3 3 + 2Cr(NO3)3 + 2KNO3 + 7H2O K2Cr2O7 + 6KI + 14HNO3 2Cr(NO3)3 + 3I2 + 8KNO3 + 7H2O I2 + Na2S2O3 2NaI + Na2S4O6 Спирт этиловый хранят в хорошо укупоренной таре, вдали от огня, в прохладном месте от 8 до 15С, учитывая летучесть спирта. Спирт этиловый при приеме внутрь вызывает наркотический эффект. Спирт этиловый—органический растворитель для получения настоек, экстрактов, а также в виде 50-70% растворов для наружного применения в качестве антисептического и раздражающего средства в виде обтираний и компрессов. 3.Глицерин. 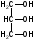 Глицерин-это трехатомный спирт. Глицерин - прозрачная, бесцветная сиропообразная жидкость без запаха, сладкого вкуса, нейтральной реакции, гигроскопичен, объемная доля 88–91%, Т. кип. 290C. Глицерин смешивается с водой и этанолом, но практически нерастворим в жирных маслах и очень мало растворим в эфире. Получение. Глицерин получают омылением жиров. Этот способ был предложен Шееле в 1779 г.: 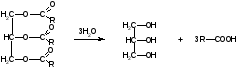 В присутствии щелочей или катализаторов образуются глицерол и высокомолекулярные жирные кислоты. Подлинность. 1).Подлинность глицерина устанавливают по образованию непредельного альдегида — акролеина под действием водоотнимающих веществ (например, гидросульфата калия): 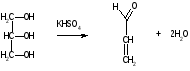 Акролеин имеет неприятный раздражающий запах. Выделяющийся акролеин можно обнаружить с помощью цветных реакций на альдегиды. Реактивами смачивают фильтровальную бумагу, которой накрывают пробирку с реакционной смесью. Такими реактивами могут быть раствор нитропруссида натрия в присутствии пиридина (синее окрашивание) или фуксинсернистая кислота (красное окрашивание), реактив Несслера (черное окрашивание). Образование акролеина происходит также при нагревании смеси глицерола с борной кислотой. 2). Реакция образования глицерата меди. Предварительно смешивают 5%-ный раствор сульфата меди с раствором гидроксида натрия. К выпавшему голубому осадку гидроксида меди прибавляют несколько капель глицерина. Осадок растворяется с образованием тёмно-синего раствора глицерата меди, не изменяющегося при кипячении: CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 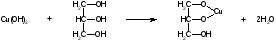 3). МФ рекомендует для установления подлинности глицерина цветную реакцию с бихроматом калия. При наслаивании его раствора на смесь глицерина с азотной кислотой, на границе слоев жидкостей появляется голубое кольцо, не диффундирующее в нижний слой. При оценке чистоты глицерина устанавливают кислотность и щёлочность, содержание воды, эфирное число, примеси акролеина и других восстанавливающих, а также легко обугливающихся органических веществ. Количественное определение. ФС рекомендует выполнять количественное определение глицерина путём его окисления иодной кислотой до образования глицериновой кислоты (выдерживают 10 мин в защищённом от света месте). Образовавшуюся иодноватую кислоту определяют методом иодометрии после добавления иодида калия и серной кислоты Методика количественного определения, рекомендуемая МФ, отличается тем, что образующуюся глицериновую кислоту титруют 0,1М раствором гидроксида натрия, используя рН-метр (до рН 8,1) и параллельно выполняя контрольный опыт. Для количественного определения глицерина можно использовать реакцию образования сложного эфира.Содержание глицерина рассчитывают либо по избытку уксусного ангидрида, либо по количеству титрованного раствора щелочи, израсходованного на гидролиз выделенного из реакционной смеси уксусно-глицеринового эфира. Глицерин хранят в хорошо укупоренной таре, в прохладном месте, учитывая способность глицерола поглощать пары воды, содержащиеся в воздухе. Глицерин в виде 84–88%-ной смеси с водой при наружном применении оказывает смягчающее действие. Глицерин входит в состав основ для приготовления мазей, суппозиториев и других лекарственных форм. Лекция №19 Тема: «Углеводы» План
1.Общая характеристика углеводов. К числу углеводов относят сахара и подобные им по химической структуре и свойствам соединения. Большинство углеводов представляют собой полиоксикарбонильные соединения, т.е. полимерные соединения, многие из которых отвечают формуле Cm(H2O)n. Углеводы подразделяют на две группы: мономеры (простые сахара) - моносахариды и полимерные продукты их поликонденсации (сложные сахара). Полисахариды при гидролизе распадаются на моносахариды. Углеводы, дающие при гидролизе две молекулы моносахарида, называются дисахаридами. Углеводы, при гидролизе которых образуется 2-10 моносахаридов, называют олигосахаридами. Большинство моносахаридов имеет состав CnH2nOn. Это кристаллические вещества, хорошо растворимые в воде, сладкие на вкус. В медицинской и фармацевтической практике наиболее широко используют глюкозу, сахар молочный, сахарозу, крахмал. ГФ содержит фармакопейные статьи на два препарата глюкозы: глюкоза и раствор глюкозы 5,10,25 или 40% для инъекций. Углеводы содержатся в растительном и животном сырье. Сахарозу получают из сахарной свеклы или сахарного тростника. Глюкоза находится в виноградном соке, в плодах и других органах различных растений. Глюкозу и фруктозу можно получить гидролизом сахарозы с участием спиртового раствора хлороводорода. Глюкоза выкристаллизовывается, а фруктоза остается в растворе. Молочный сахар (лактозу) получают из молочной сыворотки выпариванием с последующей перекристаллизацией из воды, а D-галактозу — гидролизом лактозы. Лекарственные вещества углеводов сходны по физическим свойствам. Они представляют собой бесцветные или белые кристаллические вещества без запаха, сладкого вкуса. Легко растворимы в воде, очень мало или трудно растворимы в этаноле, практически нерастворимы в эфире и хлороформе. Структура углеводов обусловливает особенности физических и химических свойств их растворов. От наличия нескольких асимметрических углеродных атомов в молекулах моносахаридов и дисахаридов зависят оптические свойства растворов. Эти свойства являются характерными константами для углеводов. При окислении D-глюкозы образуется D-глюконовая кислота, а при восстановлении — сорбит. Восстановительные свойства глюкозы, галактозы и лактозы связаны с наличием в молекуле полуацетального гидроксила. У сахарозы эти свойства проявляются в значительно меньшей степени, так как оба полуацетальных гидроксила находятся в связанном состоянии. При нагревании растворов дисахаридов в присутствии кислот происходит их гидролиз до моносахаридов. Сахароза гидролизуется с образованием глюкозы и фруктозы, а сахар молочный — до глюкозы и галактозы. Для качественного и количественного анализа используют главным образом восстановительные свойства углеводов и физические свойства их растворов. 2.Глюкоза.  Glucosum (глюкоза) - белый мелкокристаллический порошок без запаха, сладкого вкуса. Получение. Основным источником получения глюкозы в промышленности является крахмал, который гидролизуют в присутствии минеральных кислот: (C6H10O5)n + nH2O nC6H12O6 крахмал глюкоза Подлинность. Нагревают растворы глюкозы до кипения с реактивом Фелинга - образуется кирпично-красный осадок оксида меди (I). Лактоза в тех же условиях дает желтый осадок, переходящий в буровато-красный. При действии на глюкозу, сахарозу и лактозу аммиачным раствором нитрата серебра выделяется черный осадок серебра. Сахароза, в отличие от глюкозы, галактозы и лактозы, не восстанавливает реактив Фелинга, т.к. является невосстанавливающим дисахаридом (олигосахаридом). Для испытания подлинности к раствору сахарозы (1:2) последовательно прибавляют растворы нитрата кобальта и гидроксида натрия. Появляется фиолетовое окрашивание. Лактоза образует окрашенные продукты с аммиаком и алифатическими аминами. При нагревании на водяной бане (до 80°С) раствора лактозы в присутствии аммиака возникает красное окрашивание. Аналогичная окраска появляется при нагревании до кипения раствора лактозы с метиламина гидроксидом и гидроксидом натрия. Растворы глюкозы, галактозы и лактозы образуют с фенилгидразином выпадающие в осадок фенилгидразоны. При последующем нагревании на водяной бане получаются окрашенные в желтый цвет озазоны. Сахароза не дает положительной реакции с фенилгидразином. Озазоны имеют характерную температуру плавления. Глюкоза взаимодействует с тремя молекулами фенилгидразина: 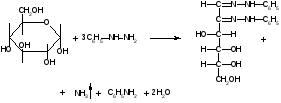 Под воздействием минеральных кислот или щавелевой кислоты моно- и дисахариды превращаются при нагревании в пробирке на пламени горелки в фурфурол или его производные (дисахариды вначале гидролизуются в моносахариды). Из глюкозы образуется оксиметилфурфурол, а из фруктозы — фурфурол. Фурфурол, являясь летучим соединением, взаимодействует с анилином или прокаином, нанесенным на фильтровальную бумагу, которой накрывают пробирку. Вначале образуются основания Шиффа, имеющие светло-желтую окраску, переходящую в малиново-фиолетовое окрашивание. Углеводы образуют со спиртовым раствором -нафтола и концентрированной серной кислотой соединения хиноидной структуры, окрашенные в красно-фиолетовый цвет. В основе реакции также лежит процесс образования фурфурола или оксиметилфурфурола, которые конденсируются с -нафтолом в триарилметановое хиноидное соединение. К этой же группе следует отнести цветные реакции, которые дают моно- и дисахариды с другими фенолами. При нагревании с несколькими кристаллами резорцина и разведенной хлороводородной кислотой молочный сахар образует желтое, а сахароза — розовое окрашивание. При смешении кристаллов глюкозы и тимола после добавления концентрированной серной кислоты появляется темно-красное окрашивание. Цветную реакцию с 0,5%-ным раствором хлорида трифенилтетразолия в присутствии раствора гидроксида натрия при нагревании дают глюкоза, галактоза и другие восстанавливающие сахара. Выпадает красный осадок трифенилформазана: 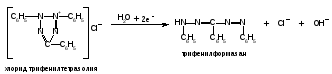 При добавлении раствора сульфата меди и подщелачивании глюкоза образует комплексное соединение фиолетово-синего цвета. Этой реакцией одновременно доказывается наличие как гидроксильных, так и альдегидной групп, восстанавливающих медь (II) до оксида меди (I) при стоянии. Присутствие гидроксильных групп можно также доказать реакцией ацетилирования (происходит образование пентаацетатов со стабильной температурой плавления). Сахароза и высшие олигосахариды, содержащие её в молекуле, со щелочным раствором диазоурацила дают цветную реакцию (синее окрашивание). Показателем качества углеводов является удельное вращение растворов, характеризующее их оптическую активность Для установления удельного вращения глюкозу и галактозу предварительно сушат при 100–105 C до постоянной массы. Измерение угла вращения глюкозы и сахара молочного производят с помощью поляриметра после предварительного прибавления к испытуемому раствору двух капель раствора аммиака. Под действием кислот или фермента инвертазы сахароза гидролизуется. Образующуюся смесь D-глюкозы и D-фруктозы называют инвертным сахаром. Количественное определение. а)Содержание глюкозы определяют иодометрическим методом, основанном на окислении альдегидной группы щелочными растворами иода до образования натриевой соли глюконовой кислоты: 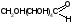 + I2 + 3NaOH = CH2OH(CHOH)4COONa + 2NaI + 2H2O + I2 + 3NaOH = CH2OH(CHOH)4COONa + 2NaI + 2H2Oб) Рефрактометрический метод. Х= (n - n0) : F, где n - показатель преломления исследуемого раствора; n0 - показатель преломления воды; F – фактор пересчета (табличные данные), индивидуальный для каждого вещества; Х- процентная концентрация исследуемого раствора. в)Поляриметрический метод определения сахаров основан на измерении угла вращения поляризованного света. Угол вращения в градусах, измеряемый на поляриметре, и удельное вращение 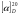 связаны между собой уравнением: связаны между собой уравнением: 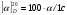 . Зная удельное вращение, длину трубки l, измерив угол вращения, можно вычислить массовую долю с (%) по формуле: . Зная удельное вращение, длину трубки l, измерив угол вращения, можно вычислить массовую долю с (%) по формуле: 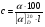 г) ГЖХ-метод определения глюкозы используют после превращения её в летучие соединения (ацетаты сорбита или нитрил глюконовой кислоты). Хранение. Хранят лекарственные препараты углеводов в хорошо укупоренной таре при комнатной температуре. Глюкоза в водных растворах при хранении окисляется. Следует также учитывать гигроскопичность глюкозы. Применение. Применяют глюкозу при различных заболеваниях сердца, печени, шоке, коллапсе в качестве источника легко усвояемого организмом питания, улучшающего функции различных органов. Основные пути метаболизма D-глюкозы — гликолиз и аэробное окисление до углекислоты, воды и АТФ. Назначают глюкозу внутрь (по 0,5–1,0 г), внутривенно до 20–50 мл 40%-ного раствора. Сахарозу и сахар молочный используют в фармацевтической практике в качестве наполнителей при приготовлении таблеток и порошков. Из сахарозы готовят сиропы, которые применяют как корригирующее средство. В фармацевтической практике применяют также крахмал (Amylum). Он представляет собой смесь полисахаридов с общей формулой (C6H10O5)x. Молекула крахмала включает остатки -D-глюкопиранозы, отличающиеся друг от друга степенью полимеризации и характером связей. Полисахариды, входящие в состав крахмала, можно разделить на две фракции: α- и β-амилозу (линейный полисахарид) и амилопектин (разветвлённый полисахарид). Получают крахмал из пшеницы, кукурузы, картофеля. Он представляет собой белый нежный порошок без запаха и вкуса, нерастворимый в холодной воде (в горячей образует клейстер), спирте, эфире. Крахмал используют в качестве наполнителя при изготовлении таблеток. |
