физика 14 неделя. 1. Опишите модели атома Томсона и Резерфорда
 Скачать 22.87 Kb. Скачать 22.87 Kb.
|
|
1. Опишите модели атома Томсона и Резерфорда. Планета́рная моде́ль а́тома, или модель атома Резерфо́рда, — исторически важная модель строения атома, предложенная Эрнестом Резерфордом в классической статье[1], опубликованной в 1911 г. на основании анализа и статистической обработки результатов экспериментов по рассеиванию альфа-частиц в тонкой золотой фольге, выполненных Гейгером и Марсденом в 1909 г. В этой модели Резерфорд описывает строение атома состоящим из крохотного положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого вращаются электроны, — подобно тому, как планеты движутся вокруг Солнца. Планетарная модель атома соответствует современным представлениям о строении атома с уточнениями, что движение электронов не может быть описано законами классической механики и имеет квантовомеханическое описание. Исторически планетарная модель Резерфорда пришла на смену одной из моделей Томсона «пудинга с изюмом», которая предполагает, что отрицательно заряженные электроны размещены на круговых орбитах внутри положительно заряженного атома с распределённым по всему его объёму положительным зарядом, подобно изюминкам в пудинге[2]. На самом деле в своих опытах Резерфорд фактически подтвердил состоятельность другой модели Томсона, предполагающей планетарное строение атома. 2. Сформулируйте постулаты Бора. Получите выражение для энергий стационарных состояний атома водорода и радиусов орбит электронов, соответствующих этим состояниям. I постулат Бора (постулат стационарных состояний): электрон в атоме может находиться только в особых (квантовых) состояниях, каждому из которых соответствует определенная энергия. Когда электрон находится в стационарном состоянии, вращаясь по орбите, он не излучает. Стационарные состояния можно пронумеровать, причем каждое состояние обладает своей фиксированной энергией. II постулат Бора (правило частот): при переходе атома из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергий электрона в данных состояниях. Состояние атома, которому соответствует наименьшая энергия, называется основным, а состояния с большей энергией - возбужденными. В основном состоянии электрон может находиться неограниченно долго, а в остальных состояниях не более 10-8 с. II постулат Бора позволил объяснить линейчатую структуру атомных спектров. III постулат Бора (правило квантования орбит): стационарные электронные орбиты находятся из условия  3. Запишите формулу для расчета частот электромагнитного излучения атома водорода. 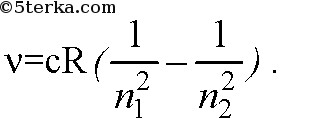 4. В чем заключается явление внешнего фотоэлектрического эффекта? Внешним фотоэффектом называется явление испускания или явление эмиссии электронов с поверхности вещества под действием света. Внешний фотоэффект наблюдается в твердых телах (металлах, полупроводниках, диэлектриках), а также в газах на отдельных атомах и молекулах (фотоионизация). |
