1. Переваривание белков. Характеристика протеолитических ферментов желудка. Роль соляной кислоты в переваривании белков
 Скачать 1.74 Mb. Скачать 1.74 Mb.
|
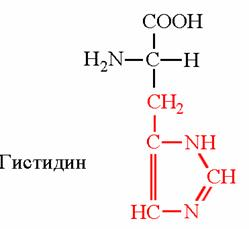
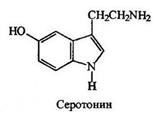
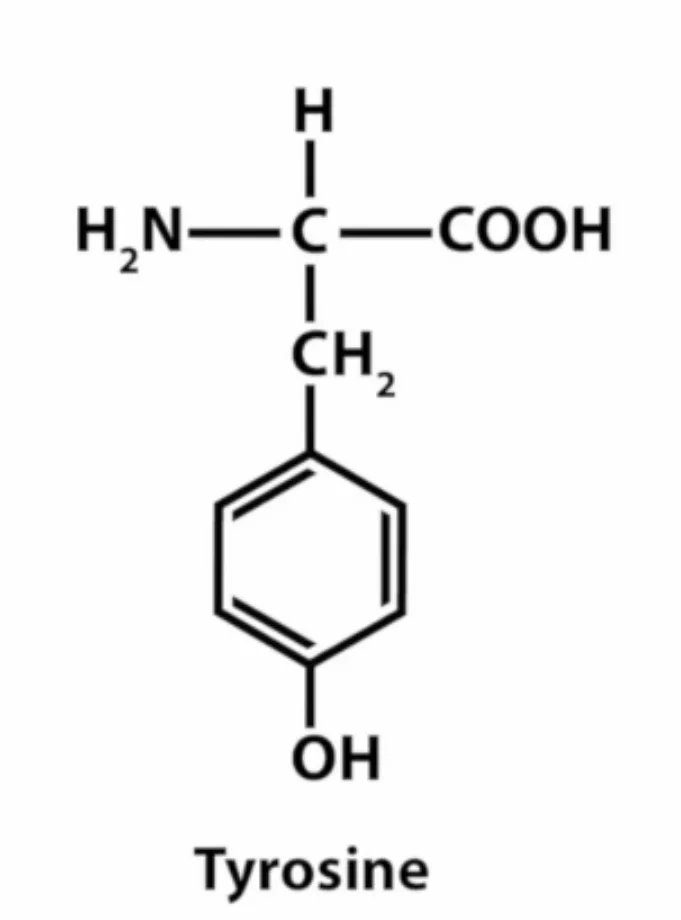
1.Переваривание белков. Характеристика протеолитических ферментов желудка. Роль соляной кислоты в переваривании белков.Главным источником белков являются продукты животного и растительного происхождения. Белки пищи, за редким исключением, не усваиваются организмом, если они не будет расщеплены до свободных аминокислот. В желудке белки пищи денатурируются и гидролизуются с образованием олигопептидов Протеолитические ферменты (ферменты класса гидролаз) катализируют гидролиз пептидных связей. Выделяют экзопептидазы(катализируют разрыв коцевой связи с освобождением 1АК) и эндопептазы (катализируют разрыв пептидных связей внутри пептидной цепочки). Протеолитические ферменты желудочного сока: пепсин, реннин, гастриксин Пепсин (Эндопептаза) вырабатывается в клетках слизистой желудка в неактивной форме, в виде пепсиногена, а активирование фермента происходит под действием желудочного сока. У пепсиногена отщепляется 42 аминокислотных остатка с N-конца молекулы. Рассматривая строение, необходимо выделить, что оба состояния фермента начинается на С-конце с аминокислоты АЛА, и имеют 3 дисульфидные связи. Пепсин отличается высокой устойчивостью в сильнокислой среде и характеризуется низким значением изоэлектрической точки (меньше 1) -> среда желудка для него оптимальна Переваривание белков в желудке. Для этого имеется: -активный фермент пепсин - оптимальная pH среды, которая создается соляной кислотой Соляная кислота также переводин неактивную форму пепсиногена в активную –пепсина, способствует набуханию белков (увеличение поверхности соприкосновения фермента с субстратом), в её присутствие происходит частичная денатурация и гидролиз белков. Кроме того она стимулирует выработку секретина, активизирует просекрин в кишечнике, что ускоряет всасывание железа и оказывает бактерицидное свойство. А вот так она появляется: В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, секретирующие ионы Н+. Источником ионов Н+ является угольная кислота, образуемая ферментом карбоангидразой. При ее диссоциациии , кроме ионов водорода, образуются карбонат-ионы НСО3–. Они по градиенту концентрации движутся в кровь в обмен на ионы Сl– Гастриксин Гастриксин по своим функциям близок к пепсину, его количество в желудочном соке составляет 20-50% от количества пепсина. Синтезируется главными клетками желудка в виде прогастриксина (профермент) и активируется соляной кислотой. Оптимум рН гастриксина соответствует 3,2-3,5 и значение этот фермент имеет при питании молочно-растительной пищей, слабее стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. Гастриксин является эндопептидазой и гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот. 2. Протеолитические ферменты. Схема активации.Протеолитические ферменты (протеазы) — белки, пептид-гидролазы, ферменты класса гидролаз, расщепляющие пептидные связи между аминокислотами в белках и пептидах. Протеолитические ферменты играют важнейшую роль в переваривании белков пищи в желудке и кишечнике человека. Большинство протеолитических ферментов органов пищеварения продуцируется в виде проферментов. Физиологический смысл этого заключается в том, чтобы акт продукции фермента (профермента) был отделен от акта его активации — превращения в фермент и, таким образом, белки тканей, продуцирующих ферменты, не подвергались воздействию этих самых ферментов. Схема активации протеолитических ферментов поджелудочной железы.  Трипсин Синтезируемый поджелудочной железой трипсиноген в ДПК подвергается частичному протеолизу под действием фермента энтеропептидазы, секретируемой клетками кишечного эпителия. От профермента отделяется гексапептид (Вал-Асп-Асп-Асп-Асп-Лиз), что приводит к формированию активного центра трипсина. 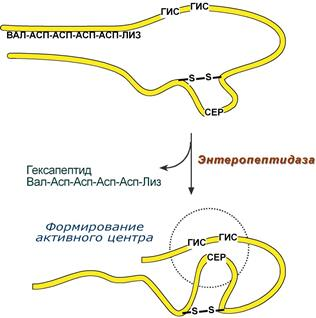 Схема активации трипсина Трипсин специфичен к пептидным связям, образованным с участием карбоксильных групп лизина и аргинина, может осуществлять аутокатализ, т.е. превращение последующих молекул трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока – химотрипсиноген, проэластазу, прокарбоксипептидазу. Параллельно трипсин участвует в переваривании пищевых липидов, активируя фермент переваривания фосфолипидов – фосфолипазу А2, и колипазу панкреатической липазы, отвечающей за гидролиз триацилглицеролов. Химотрипсин Образуется из химотрипсиногена при участии трипсина, который расщепляет пептидную связь между аргинином-15 и изолейцином-16 с образованием уже активных промежуточных форм π-химотрипсина и δ-химотрипсина, которые аутолизисом удаляют два дипептида из собственных цепей. Три образованных фрагмента удерживаются друг с другом посредством дисульфидных связей, формируя стабильный α-химотрипсин. Фермент специфичен к пептидным связям, образованных с участием карбоксильных групп ароматических аминокислот – фенилаланина, тирозина и триптофана. Эластаза Активируется в просвете кишечника трипсином из проэластазы. Гидролизует связи, образованные карбоксильными группами малых аминокислот – аланина, пролина, глицина. Карбоксипептидазы Карбоксипептидазы являются экзопептидазами, они гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз – карбоксипептидазы А и карбоксипептидазы В. Карбоксипептидазы А отщепляют с С-конца остатки алифатических и ароматических аминокислот, карбоксипептидазы В – остатки основных аминокислот – лизина и аргинина. Аминопептидазы Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Представителями аминопептидаз являются аланин-аминопептидаза и лейцин-аминопептидаза, обладающие широкой специфичностью. Например, лейцин-аминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин. Дипептидазы Дипептидазы гидролизуют дипептиды, в изобилии образующиеся в кишечнике при работе других ферментов. Лизосомы энтероцитов Малое количество дипептидов и пептидов пиноцитозом попадают в энтероциты и здесь гидролизуются лизосомальными протеазами. 3. Специфичность действия протеаз. Защита клеток желудочно-кишечного тракта от действия протеаз.В кишечном соке содержится более 20 ферментов, гидролизующих углеводы (мальтаза, трегалаза, инвертаза, лактаза, а- и γ-амилазы), белки и их фрагменты (аминопептидазы, трипептидазы, дипептидазы, энтерокиназа), липиды (моноглицеридлипаза, карбоксиэстераза), нуклеазы, фосфатазы и другие гидролазы. Состав кишечного сока меняется в зависимости от пищи. Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три). Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина. Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме. Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Наиболее известна лейцинаминопептидаза - Zn2+- или Мn2+-содержащий фермент, несмотря на название, обладающий широкой специфичностью по отношению к N-концевым аминокислотам. Дипептидазы расщепляют дипептиды на аминокислоты, но не действуют на трипептиды. В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот. Защита клеток от действия протеаз Клетки поджелудочной железы защищены от действия пищеварительных ферментов тем, что: эти ферменты образуются в виде неактивных предшественников в клетках поджелудочной железы и активируются только после секреции в просвет кишечника. Таким образом, место синтеза и место действия этих ферментов пространственно разделены. в клетках поджелудочной железы присутствует белок-ингибитор трипсина, образующий с активной формой фермента (в случае преждевременной активации) прочный комплекс. В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами и тем самым защищают клетку от их действия. Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. 4. Всасывание продуктов гидролиза белка (транспорт аминокислот в клетку)Образовавшиеся аминокислоты быстро всасывается в кишечнике. Они осуществляют транспорт через воротную систему печени, и по лимфатическим сосудам. Максимальная концентрация аминокислот в крови достигается через 30-50 минут после приема белковой пищи. Всасывание L- аминокислот - процесс требующий затраты энергии. АК переносится через кишечную стенку от слизистой её поверхности в кровь (9.4 рисунок). Перенос через суточную кайму осуществляется целым рядом переносчиков, многие из которых действует при участии Na+зависимых механизмов симпорта. О наличии транспортных систем, обеспечивающих перенос аминокислот как через внешнюю плазматическую мембрану, так и через внутриклеточные мембраны, говорит различная скорость проникновения аминокислот через мембраны клеток. Известно 5 специфических транспортных систем, каждая из которых функционирует для переноса определенной группы близких по строению АК: Нейтральных, с короткой боковой цепью (аланин, серин, треонин) Нейтральных, с длинной или разветвленной боковой цепью (валин, лейцин, изолейцин) С катионными радикалами (лизин, аргинин) С анионными радикалами (глутаминовая и аспарагиновая кислоты) Имикислот (пролин, оксипролин) К Na+зависимым относят переносчиков 1 и 5 группы + переносчик метионина. Независимые от Na+ переносчики специфичны для некоторых нейтральных АК (фенилаланин, лейцин) и АК с катионными радикалами (лизин). АК конкурируют между собой за специфические участки связывания (всасывание лейцина уменьшает всасывание изолейцина и валина). γ-глатамильный цикл – специфическая транспортная система для некоторых нейтральных аминокислот, функционирующие в кишечнике, почках и в мозге. В этой системе 6 ферментов, 1 - в клеточной мембране, остальные - в цитозоле. γ-глутамилтрансфераза (фермент) играет ключевую роль в транспорте АК. Этот фермент гликопротеин и катализирует перенос γ-глутамильный группы от глутатиона на транспортируемую АК и и последующий перенос комплексов в клетку. Глутатион представляет собой трипептид – γ-глутамилцистеинглицин, находящийся во всех тканях животных. (Схема А) 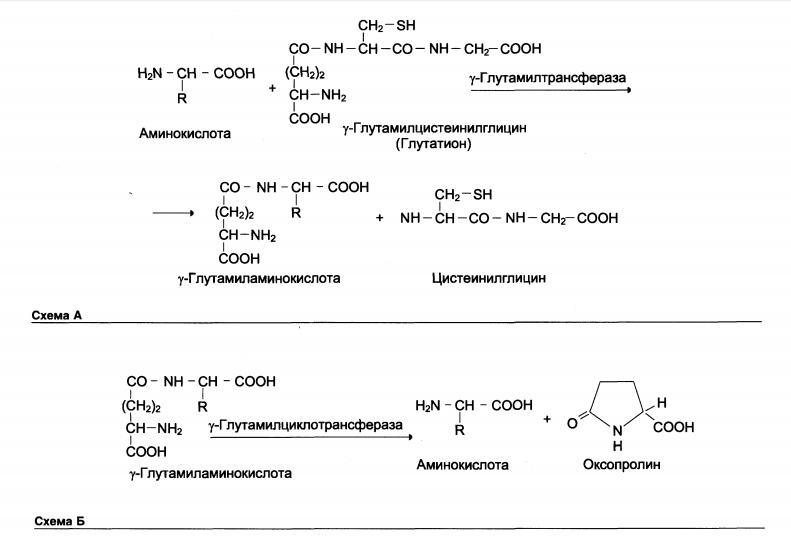 Аминокислота связано с γ-глутамильным остатком, оказывается внутри клетки. Далее происходит отщепление этого остатка под действием γ-глутамилтрансферазы (фермента) смари схему Б. Дипептид цистинилглицин расщепляются под действием пептидазы на 2 АК – цистеин и глицин. В результате этих трёх реакций происходит перенос 1 молекулы АК в клетку (или внутриклеточную структуру). Следующий 3 реакции обеспечивает регенерацию глутатиона, благодаря чему цикл повторяется многократно. Для транспорта в клетку 1 молекулы АК с участием γ-глутамильного цикла затрачивается 3 молекулы АТФ. 5.Тканевой распад белков. Маркеры «стареющих» белков (убиквитин, гликозилирование, десиалирование). Роль убиквитина и процессов гликозилирования в «мечении» старых белков в клетке. Роль шаперонов.Основные причины распада тканевых белков: 1. Старение клеток или их повреждение внешними факторами (токсические вещества, излучения). Состарившиеся и поврежденные клетки разрушаются путем апоптоза/фагоцитируются; все их компоненты деполимеризуются в лизосомах. 2. Денатурация белков, которая происходит непрерывно с определенной скоростью. Денатурированные белки — более доступные субстраты для протеолитических ферментов. 3. Частичный протеолиз белков в ходе посттрансляционной достройки. При превращении проферментов и предшественников др белков в функционально активные белки отщепляемая часть пептидной цепи гидролизует-ся до амк. 4. Переваривание белков пищеварительных соков. Со всеми пищеварительными секретами у человека за сутки выделяется в кишечник около 50г белков, в основном ферментов. Все эти белки тоже перевариваются, а амк всасываются. 5. Регуляция концентрации белков путем индукции и репрессии. Этот механизм регуляции немыслим без его дополнения механизмом разрушения соответствующих белков (ферментов, гормонов) в условиях, когда необходимость в них отпала. Маркеры «стареющих» белков (убиквитин, гликозилирование, деталирование) Убиквитин-зависимая система протеолиза проводит поиск потенциальной мишени для протеолитической деградации среди внутриклеточных белков. Белки несут специфические сигналы деградации по аналогии с сигнальными последовательностями, которые направляют вновь синтезируемые белки к определенным микрокомпартментам клетки. Сигналы протеолитической деградации более сложные и разнообразные, тк с их помощью не только маркируются белки, удаляемые с помощью протеолиза, но и определяется время удаления и скорость их протеолитического расщепления. Для распознавания и декодирования таких сигналов в клетках эукариот имеется убиквитин-конъюгирующая система. Как в ядре, так и в цитоплазме эта система отделена пространственно и функционально от протеолитических ферментов, организованных в протеасомы. Распознанные данной системой белки-субстраты маркируются путем ковалентного присоединения к ним молекул стабильного 76- звенного белка - убиквитина. Убиквитин соединяется C-концом с боковыми остатками лизина в субстрате. Наличие такой метки в белке является первичным сигналом сортировки, направляющей образовавшиеся конъюгаты к протеасомам. В большинстве случаев к субстрату присоединяется несколько молекул убиквитина, которые организованы в виде бусинок на нитке. Молекулы белков, содержащие убиквитин являются для протеасом предпочтительными субстратами. Для белков крови: десиалирование- отщепление углевод.компонентов Роль убиквитина и процессов гликозилирования в «мечении» старых белков в клетке. · Присоединение убиквитина может оказывать различное воздействие на белки-мишени: оно влияет на внутриклеточную локализацию, оказывает воздействие на их активность, способствует или препятствует белок-белковым взаимодействиям. · Протеолитическая деградация белков, помеченных полиубиквитиновыми цепями (в них последующие убиквитиновые звенья присоединяются к боковым аминогруппам предыдущей молекулы убиквитина), с помощью протеасомы 26S. · Регулирует пролиферацию, развитие и дифференцировку клеток, реакцию на стресс и патогены, репарацию ДНК. Роль шаперонов: Шапероны-белки, способные связываться с белками, находящимися в неустойчивом, склонном к агргации состоянии. В процессе синтеза полипептидных цепей, транспорта их через мембраны, при сборке олигомерных белков возникают промежуточные нестабильные конформации, склонные к агрегации. На вновь синтезированном полипептиде имеется множество гидрофобных радикалов, которые в трёхмерной структуре спрятаны внутри молекулы. Поэтому на время формирования нативной конформации реакционноспособные аминокислотные остатки одних белков должны быть отделены от таких же групп других белков. 6.Внутриклеточные протеазы. Лизосомальные ферменты. КлассификацияПо месту атаки молекулы субстрата протеолитические ферменты делятся на эндопептидазы и экзопептидазы: 1) Эндопептидазы, или протеиназы, расщепляют пептидную связь внутри пептидной цепи. Они «узнают» и связывают короткие пептидные последовательности субстратов и относительно специфично гидролизуют связи между определенными аминокислотными остатками. 2) Экзопептидазы гидролизуют пептиды с конца цепи: аминопептидазы — с N-конца, карбоксипептидазы — с С-конца. Наконец, дипептидазы расщепляют только дипептиды. 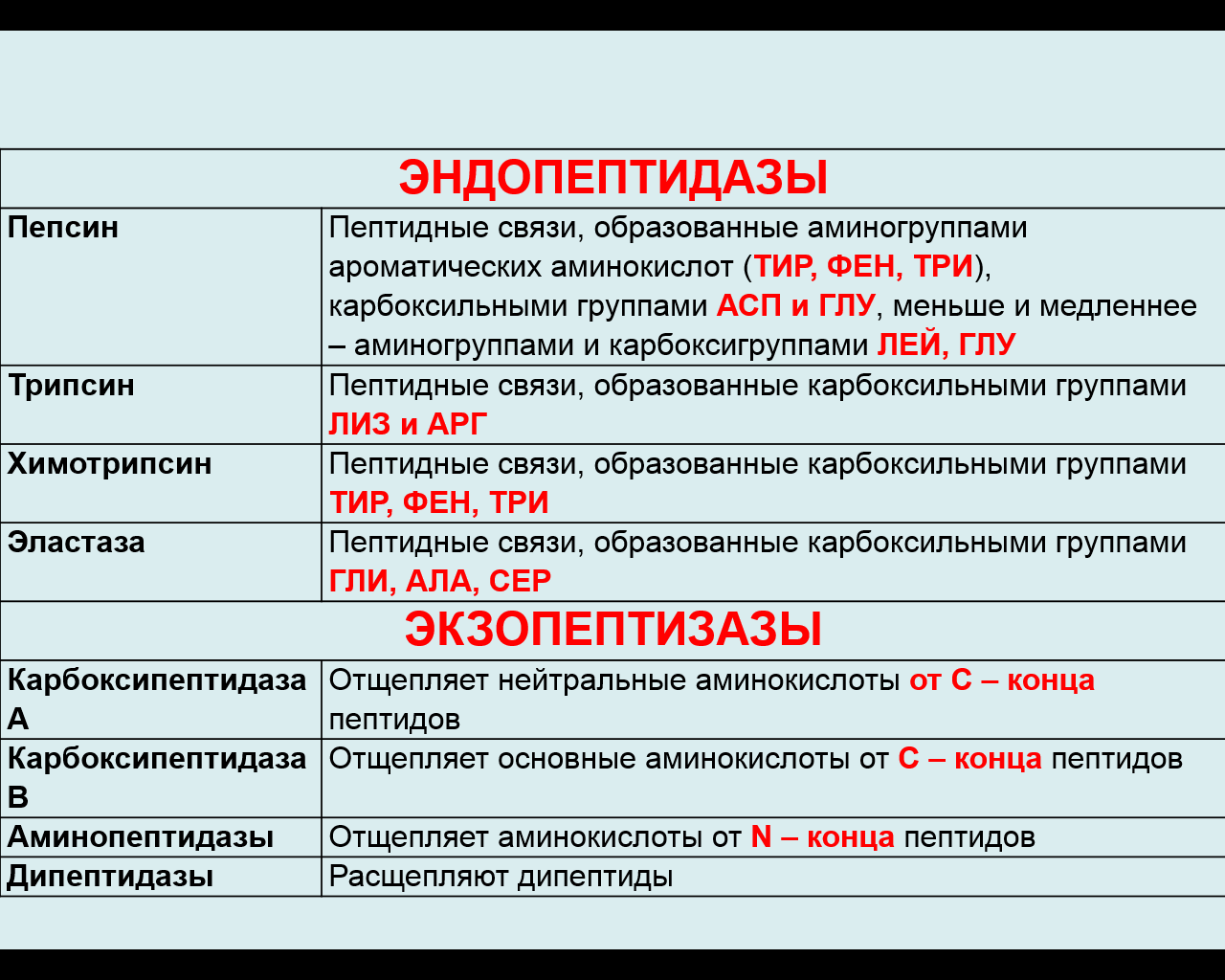  Лизосомальные ферменты Ферменты, содержащиеся в лизосомах, относятся к классу гидролаз. Они ускоряют реакции расщепления органических соединений при участии воды. В зависимости от характера субстрата, подвергающегося гидролизу, гидролазы делятся на подклассы: 1) Эстеразы, ускоряющие реакции гидролиза сложных эфиров спиртов с органическими и неорганическими кислотами. Важнейшими подподклассами эстераз являются гидролазы эфиров карбоновых кислот и фосфатазы. В качестве представителя первого подподкласса рассмотрим липазу. Липаза ускоряет гидролиз внешних, т.е. а-сложноэфирных, связей в молекулах триацилглицеринов (жиров). Фосфатазы катализируют гидролиз фосфорных эфиров. Особенно широко распространены фосфатазы, действующие на сложные эфиры фосфорной кислоты углеводов, например глюкозо-1-фосфотаза. 2) Пептид – гидролазы, ускоряющие реакции гидролиза белков, пептидов и других соединений, содержащих пептидные связи. Специфичность протеолитических ферментов определяется природой аминокислотных боковых групп, находящихся по соседству с гидролизуемой связью. Также важной характеристикой специфичности пептидаз является положение гидролизуемой связи; по этому признаку различают две главные группы пептидаз. Экзопептидазы – это ферменты подгруппы 3.4.11 – 15, для действия которых требуется либо свободная концевая аминогруппа (аминопептидазы), либо свободная концевая карбоксильная группа (карбоксипептидазы). Катепсины - протеолитические ферменты из группы эндопептидаз. Локализованы в лизосомах клеток животных. Осуществляют внутриклеточное переваривание белков. Обладают широкой специфичностью, оптимум активности – при слабокислом значении рН. 3) Нуклеазы, ускоряющие реакции расщепления фосфодиэфирных связей в полинуклеотидной цепи нуклеиновых кислот с образованием моно - и олигонуклеотидов. Нуклеазы могу расщеплять РНК (рибонуклеазы) и ДНК (дезоксирибонуклеазы) либо те и другие (т.е. неспецифичные нуклеазы). Нуклеазы широко распространены в природе и играют важную роль в распаде и синтезе нуклеиновых кислот. Нуклеазы характеризуется широкой и перекрывающейся специфичностью; классификация этих ферментов весьма трудна и противоречива. 4) Гликозидазы, ускоряющие реакции гидролиза гликозидов, в том числе углеводов. В зависимости от того, на какой пространственный изомер (а или в) действует фермент, его относят к а- или в-гликозидазам. Таким образом, гликозидазы обладают ярко выраженной пространственной специфичностью, которая определяется конфигурацией каждой – СНОН-групп. Кроме гликозидов субстратами, на которые распространяется действие тех или иных гликозидаз, являются олиго - и полисахариды. Ферменты этой большой и важной группы расщепляют в основном субстраты, в молекуле которых не содержится заряженных групп. В этих субстратах доминирующую роль играет расположение гидроксильных групп и атомов водорода. Как правило, гликозидазы проявляют высокую степень специфичности по отношению к определенному моносахаридному кольцу; однако присоединенная агликоновая группа также может оказывать более или менее заметное влияние. В некоторых случаях (например, у нуклеозидаз) это влияние агликона бывает выражено сильнее, чем влияние моносахаридного компонента. Инозиназа, например, гидролизует гипоксантинрибозид, но не действует на ксантинрибозид. 5) Гидролазы, действующие на С – N-связи, отличающиеся от пептидных, т.е. ускоряют гидролиз амидов кислот. Из них важную роль в организме играют уреаза, аспарагиназа и глутаминаза. Уреаза ускоряет гидролиз мочевины до NH3 и СО2. Аспарагиназа и глутаминаза ускоряют гидролиз амидов дикарбоновых аминокислот – аспарагиновой и глутаминовой. К гидролазам, действующим на С – N-связи, отличающиеся от пептидных, кроме амидаз относятся ферменты, катализирующие гидролиз С - N-связей в линейных амидинах. К их числу принадлежит аргиназа. 7. Пул аминокислот в клетке. Возможные пути использования аминокислот в клетке. Пополнение пула аминокислот за счет эндогенного распада дефектных тканевых белков.Аминокислоты в клетке составляют динамичный пул, который непрерывно пополняется и так же непрерывно расходуется. Существуют три источника аминокислот для пополнения этого пула – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот. Реакции превращения аминокислот в клетке условно можно разделить на три части, в зависимости от реагирующей группы: · с участием аминогруппы - здесь подразумевается удаление от аминокислоты аминогруппы тем или иным способом, в результате чего остается углеводородный скелет, · по боковой цепи (радикалу) - происходит использование углеродного скелета для синтеза глюкозы, жиров, или для образования энергии АТФ, · по карбоксильной группе - связано с отщеплением карбоксильной группы. Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 3565 мг/дл. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг. Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Многие клетки, за исключением высокоспециализированных (например, эритроцитов), используют аминокислоты для синтеза белков, а также большого количества других веществ: фосфолипидов мембран, гема, пуриновых и пиримидиновых нуклеотидов, биогенных аминов (катехоламинов, гистамина) и других соединений. Главный путь использования аминокислот – синтез специфических для организма белков: структурных, сократительных, белков-ферментов, гормонов белковой природы взамен распадающихся. Скорость обновления тканевых белков достаточно высока. Так период полураспада белков печени составляет около 9 суток, белков мышечной ткани около 120 суток. Другой важнейший путь использования аминокислот – синтез различных биологически активных веществ. Даже если исключить из этой группы белки-ферменты и гормоны белковой природы, перенеся их в группу белков, останется достаточно многочисленная группа веществ: гормонов-полипептидов, гормонов - производных аминокислот и ряд других соединений, выполняющих в организме преимущественно регуляторные функции. Часть аминокислот (и поступивших из пищеварительной системы, и образовавшихся при распаде тканевых белков) используется в качестве источника энергии. Некоторое количество аминокислот может превращаться в углеводы, в липиды. Хотя последнее наиболее вероятно при поступлении в организм избыточного количества белка. Еще один очень важный путь использования аминокислот – синтез заменимых аминокислот. Динамическое состояние белков организма человека Этот постоянный процесс синтеза и распада позволяет клеткам быстро регулировать количество важных белков в соответствии с текущими потребностями. Практически все клетки способны синтезировать белки. Скорость обновления белка в организме характеризуется периодом полужизни белка. Высокая интенсивность белкового обмена в организме связана с тем, что многие белки (гормоны, ферменты) относительно недолговечны. Структурные белки, наоборот, являются долгоживущими. Поскольку аминокислоты практически не депонируются в организме, избыток аминокислот, не используемый для синтеза белка или других веществ, подвергается распаду. Высвободившийся при этом азот превращается в мочевину и выделяется с мочой. Углеродные скелеты аминокислот используются для синтеза углеводов или липидов, а также для получения энергии. 8. Общие пути катаболизма аминокислот. Катаболические превращения аминокислот по α-NH2 группе, по α-СООН группе и по углеродному «скелету».Р-ии превращения амк в клетке условно можно разделить на 3 части, в зависимости от реагирующей группы: с участием аминогруппы - здесь подразумевается удаление от амк, в р-те чего остается углеводородный скелет. Превращение амк с участием NH2-группы сводится к ее отщеплению от углеродного скелета в р-ии дезаминирования. Типы дезаминирования 1) внутримолекулярное – с образованием ненасыщенной ЖК: 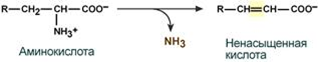 2) восстановительное с образованием насыщенной ЖК: 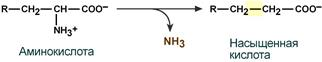 3) гидролитическое – с образованием карбоновой гидроксикислоты: 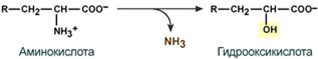 4) окислительное с образованием кетокислот: 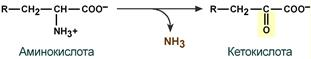 У чел-ка окислительное дезаминирование является основным путем катаболизма амк. Не все амк подвергаются окислительному дезаминированию. Гистидин теряет аминогруппу с использованием внутримолекулярного дезаминирования. Треонин и серин либо дегидратируются с последующим отщеплением аммиака (прямое неокислительное дезаминирование), либо подвергаются прямому расщеплению до глицина и ацетальдегида (треонин) или до глицина и гидроксиметила (серин). по карбоксильной группе - связано с отщеплением карбоксильной группы Синтез биогенных аминов (нейромедиаторов) из амк связан с вовлечением в метаболизм α-карбоксильной группы амк или, проще говоря, ее удалением. Гистамин Р-ия образования гистамина активно идет в тучных клетках легких, кожи, печени, базофилах и эозинофилах. В них гистамин синтезируется и накапливается в секреторных гранулах. 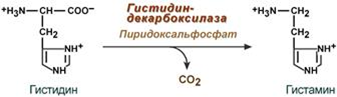 В кровь гистамин выделяется при повреждении ткани, при ударе, при электрическом раздражении. В клинической практике секреция гистамина обычно связана с аллергиями – при повторном попадании антигена в ранее сенсибилизированный организм развивается аллергическая реакция. Серотонин Серотонин синтезируется в тучных клетках кожи, легких, печени, в селезенке, ЦНС. 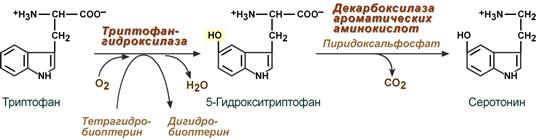 Гамма-аминомасляная кислота Синтез γ-аминомасляной кислоты (ГАМК) происходит ТОЛЬКО в ЦНС в подкорковых образованиях головного мозга. 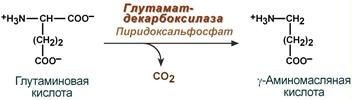 Дофамин Синтез дофамина происходит в нейронах промежуточного и среднего мозга. 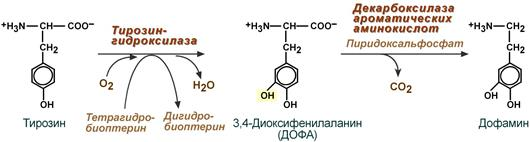 по боковой цепи (радикалу) - происходит использование углеродного скелета для синтеза глюкозы, жиров, или для образования энергии АТФ 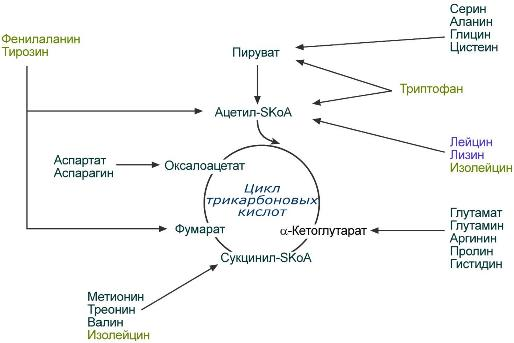 9 вопрос . Декарбоксилирование аминокислот. Ферменты. Кофакторы. Продукты. Декарбоксилирование АК - процесс отщепления карбоксильной группы, которая находится в a-положении аминокислоты, с образованием аминов и СО2. Общая схема процесса декарбоксилирования аминокислот может быть представлена в следующем виде: R-CH(NH2)-COOH --> R-CH2-NH2 + CO2 В природе встречаются разные типы декарбоксилирования аминокислот. В организме человека происходит только окислительное декарбоксилирование. Осуществляют ферменты - декарбоксилазы. Их простетическая группа представлена пиридоксальфосфатом - это активная форма витамина В6 (т.е. он является коферментом) : В реакциях декарбоксилирования участвует альдегидная группа пиридоксальфосфата: 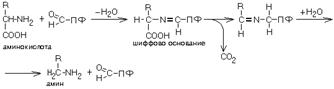 Аминокислота соединяется с активным центром фермента, в состав которого входит альдегидная группа ПФ. Образуются Шиффовы основания (альдимины и кетимины). В результате СООН-группа становится лабильной и отщепляется в виде СО2. Далее происходит гидролиз до соответствующего амина. Эта реакция необратима. Отнятие СО2 происходит без окисления. Механизм реакции декарбоксилирования аминокислот сводится к образованию пиридоксальфосфат-субстратного комплекса в активном центре фермента (представленного, как и в реакциях трансаминирования, шиффовым основанием пиридоксальфосфата и аминокислоты) 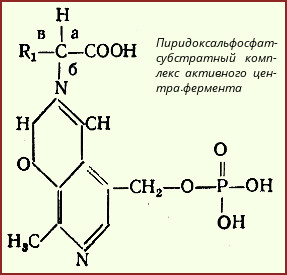 В значительных количествах декарбоксилазы аминокислот находятся в надпочечниках, в ЦНС. Субстратная специфичность декарбоксилаз очень разная. 1. ГЛУТАМАТДЕКАРБОКСИЛАЗА - высокоспецифичный фермент. Работает в клетках серого вещества головного мозга. Катализирует реакцию превращения глутаминовой кислоты в гамма-аминомасляную кислоту (ГАМК). 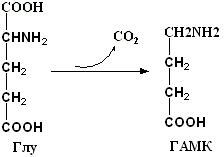 2. ОРНИТИН-ДЕКАРБОКСИЛАЗА - высокоспецифичный фермент,первый фермент на пути образования путресцина и остальных полиаминов, это регуляторный фермент процесса. Катализирует превращение орнитина в путресцин: 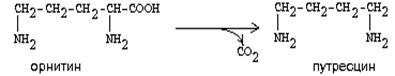 Образующийся ПУТРЕСЦИН (диаминобутан) является трупным ядом. В результате присоединения остатков пропиламина из путресцина могут образоваться СПЕРМИН и СПЕРМИДИН  ***Спермин и спермидин относятся к группе биогенных полиаминов. Введение полиаминов в организм снижает температуру тела и кровяное давление. Полиамины принимают участие в процессах пролиферации клеток и роста тканей, а также в регуляции биосинтеза белка. Они являются ингибиторами некоторых ферментов, в том числе протеинкиназ. Период полужизни орнитиндекарбоксилазы - 10 минут. Добавление в культуру клеток самих полиаминов приводит к индукции биосинтеза другого белка - ингибитора орнитиндекарбоксилазы. При раковых заболеваниях обнаружено резкое увеличение секреции полиаминов и повышение их экскреции с мочой. 3. ГИСТИДИНДЕКАРБОКСИЛАЗА Этот фермент имеет абсолютную субстратную специфичность - превращает гистидин в гистамин: 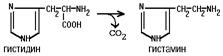 *** Гистамин является медиатором и содержится в нервных клетках и в тучных клетках. Обладают сильным сосудорасширяющим действием. Особенно много его выделяется в очаге воспаления. Гистамин играет важную роль в проявлении аллергических реакций. Известно 2 типа рецепторов к гистамину:H1 и H2. Эффекты гистамина: - расширение капилляров и повышение сосудистой проницаемости; - понижение артериального давления; - повышение тонуса (спазм) гладких мышц - в том числе гладкой мускулатуры бронхов; - усиление секреции желудочного сока; Некоторые из этих эффектов позволяют гистамину принимать участие в формировании аллергических проявлений. Например, лекарственный препарат циметидин и его аналоги блокируют Н2-рецепторы и таким образом понижают секрецию желудочного сока. Применяются при лечении язвенной болезни желудка. 4. ДЕКАРБОКСИЛАЗА АРОМАТИЧЕСКИХ АМИНОКИСЛОТ Имеет широкую субстратную специфичность. Превращает несколько разных аминокислот: а) триптофан - в триптамин б) 5-окситриптофан - в триптамин (серотонин) в) 3,4-диоксифенилаланин - в дофамин г) гистидин - в гистамин 10 вопрос. Биогенные амины (гистамин, ГАМК, серотонин, катехоламины). Токсические амины. Обезвреживание биогенных аминов.Биогенные амины – образуются при декарбоксилирование аминокислот ферментами декарбоксилазы. В результате декарбоксилирования аминокислот образуются: 1) биогенные амины (гистамин, дофамин, тирамин, g–аминомасляная кислота - ГАМК и др). Декарбоксилирование аминокислот с образованием биогенных аминов наиболее активно происходит в печени, мозге 2) продукты «гниения белков в кишечнике», которые являются результатом декарбоксилирование аминокислот под действием микрофлоры кишечника. Из аминокислот образуются токсические продукты, например:  Выполняют функции гормонов и нейромедиаторов. В организме биогенные амины подвергаются реакции окислительного дезаминирования с образованием альдегидов и аммиака. К биогенным аминам относятся: 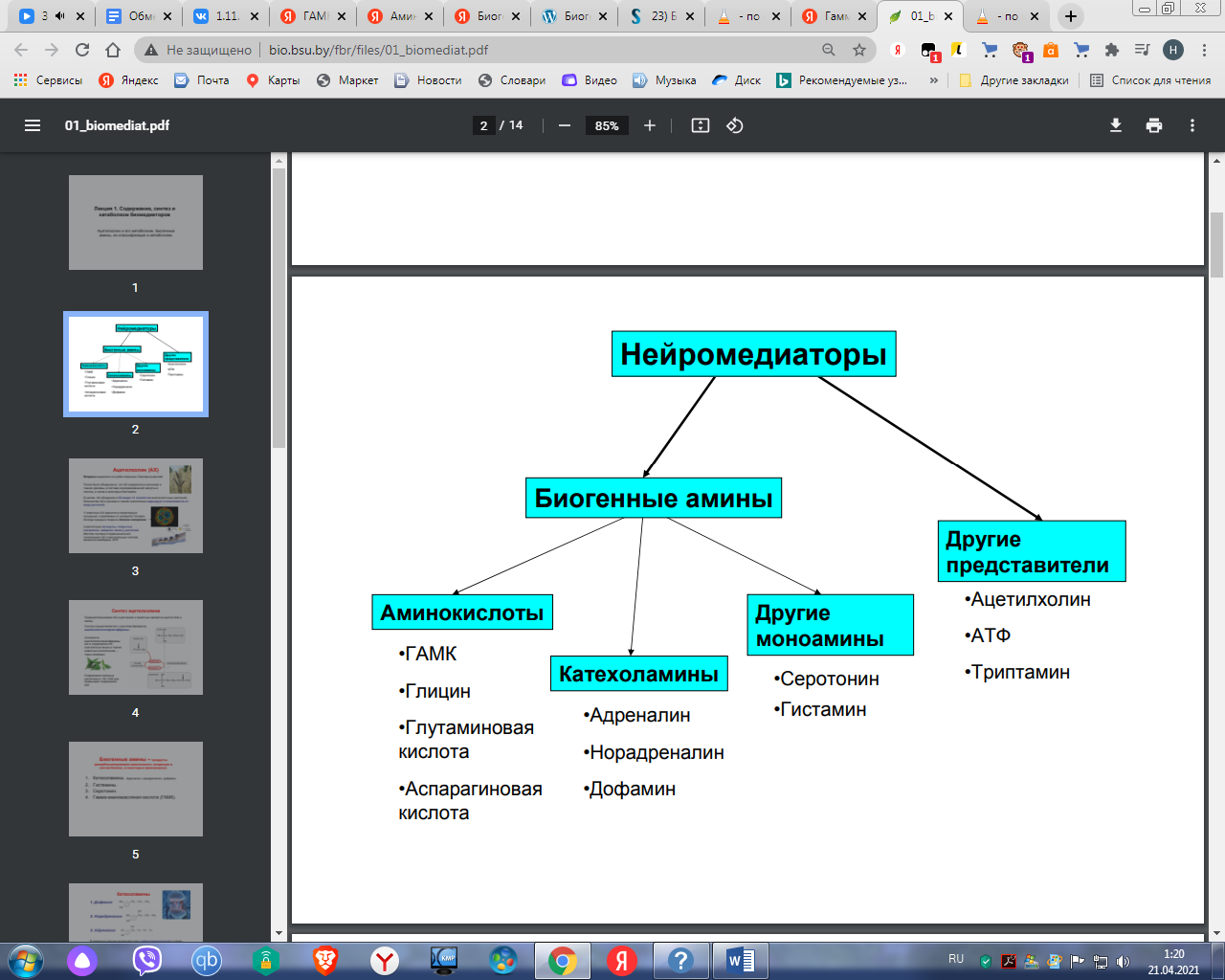 Катехоламины – это вещества, которые синтезируются из аминокислоты тирозина.Синтезируются преимущественно в мозговом слое надпочечников и в нервных окончаниях симпатической нервной системы. Главная роль катехоламинов– помочь организму приспособиться к острым и хроническим стрессам. При образовании катехоламинов и меланина (в меланоцитах) промежуточным продуктом служит диоксифенилаланин (ДОФА). Однако гидроксилирование тирозина в клетках различных типов катализируется различными ферментами: - Тиразиназа ( Cu-зависимый фермент) - Тирозингидроксилаза (1) - ДОФА – декарбоксилаза (2) - дофамингидроксилаза (3) - фенилэтаноламин-N-метилтрансфераза (4) дофамин и норадреналин служат медиаторами в синаптической передаче нервных импульсов, а адреналин – гормон широкого спектра действия, регулирующий энергетический обмен. Одна из функций катехоламинов – регуляция деятельности ССС. В нервных клетках декарбоксилирование глутамата (отщепление а-карбоксильной группы) приводит к образованию γ-Аминомасляной кислоты(ГАМК), которая служит основным тормозным медиатором высших отделов мозга. Содержание ГАМК в головном мозге в десятки раз выше других нейромедиаторов. Она увеличивает проницаемость постсинаптических мембран для ионов К+, что вызывает торможение нервного импульса, повышает дыхательную активность нервной ткани, улучшает кровоснабжение головного мозга. Гистамин - биогенный амин, содержащийся главным образом в базофильных лейкоцитах и тучных клетках. Накопление гистамина в организме может привести к патологическим явлениям. Гистамин высвобождается из клеток при анафилактических и аллергических реакциях, поэтому он является медиатором гиперчувствительности немедленного типа. Уровень гистамина в пище свыше 50 мг/кг считается токсичным. Клиническое применение: повышенное поступление гистамина может вызвать: -«гистаминовая» мигрень (синдром Хортона) -эрозия желудка -головная боль и другие симптомы. Гистамин образуется путем декарбоксилирования гистидина в тучных клетках соединительной ткани + 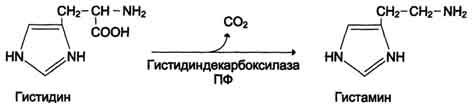 Реакция синтеза гистамина Реакция синтеза гистаминаСеротонин - это биогенный амин, один из основных нейромедиаторов. Серотонин «руководит» очень многими функциями в организме: -при снижении серотонина повышается чувствительность болевой системы организма (даже самое слабое раздражение отзывается сильной болью) -участвует в регуляции сосудистого тонуса -снижение уровня серотонина в мозгу приводит к депрессивным состояниям и к тяжелым формам мигрени («Гормон удовольствия»). 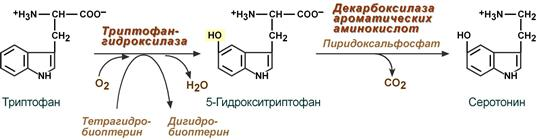 Реакции синтеза серотонина Реакции синтеза серотонинаГамма-аминомасляная кислота(ГАМК)- является главным тормозящим нейротрансмиттером. Он мягок, уравновешен и не очень физически скоординирован. Его основная работа заключается в регулировании возбуждающих сигналов, посылаемых другими нейротрансмиттерами. Он позволяет мышцам и кровеносным сосудам расслабиться,а телу-нормально спать. Без его присутствия тело было бы под угрозой смерти от судорог ! Функции аминов: Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.). Избыточное накопление их может вызывать различные патологические отклонения. В связи с этим большое значение приобретают механизмы инактивации биогенных аминов. 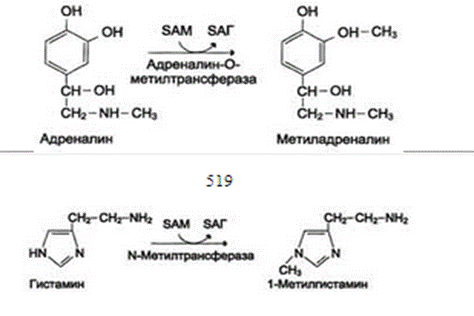 2) окислением ферментами моноаминооксидазами (МАО)с коферментом FAD - таким путем чаще происходит инактивация дофамина, норадреналина, серотонина, ГАМК. При этом происходит окислительное дезаминирование биогенных аминов с образованием альдегидов, а затем соответствующих кислот, которые выводятся почками. 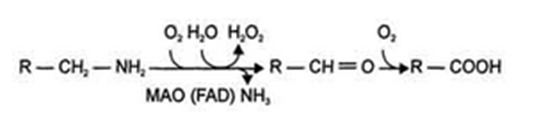
11. Трансаминирование (переаминирование). Химизм процесса, характеристика трансаминаз, роль витамина В6 в трансаминировании.Трансаминирование подразумевают р-ии межмолекулярного переноса аминогруппы от амк на альфа-кетокислоту без промежуточного образования аммиака. Р-ии трансаминирования явл-ся обратимыми и универсальными для всех живых организмов. Эти р-ии протекают при участии специфических ферментов, аминотрансферазы или трансаминазы. 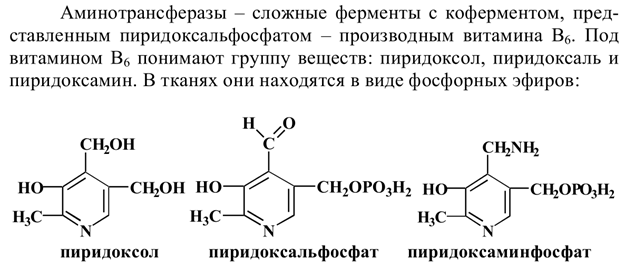 Аминотрансферазы обладают субстратной специфичностью к разным амк. В тканях чел-ка более 10 разных аминотрансфераз. 12. Биологическое значение реакций трансаминирования. Коллекторная функция α-кетоглутарата в процессе трансаминирования.Реакции трансаминирования играют большую роль в обмене АК. Поскольку этот процесс необратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза АК. Трансаминирование – заключительный этап синтеза заменимых АК из соответствующих a-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансаминирование – первая стадия дезаминирования большинства АК, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество АК в клетке не меняется. Трансаминирование играет огромную роль в оптимизации смеси аминокислот, поступающих из кишечника во внутреннюю среду организма. Природные белки при расщеплении в кишечнике дают смесь аминокислот, в которых соотношение отдельных аминокислот может быть очень далеким от потребности наших клеток. В организме синтезируются ряд кетокислот, которые в результате трансаминирования могут превращаться в заменимые аминокислоты. За счет этого синтеза и происходит оптимизация смеси аминокислот. При трансаминировании происходит перераспределение аминного азота, поступающего из кишечника. |