Ответы на экзамен по химии. 1. Предмет органической химии. Теории строения Бутлерова
 Скачать 6.68 Mb. Скачать 6.68 Mb.
|
|
1. Предмет органической химии. Теории строения Бутлерова. Органическая химия – раздел химии, изучающий соединения углерода, их структуру, свойства, методы синтеза. Органическими называют соединения углерода с другими элементами. Наибольшее количество соединений углерод образует с так называемыми элементами-органогенами: H, N, O, S, P. Способность углерода соединяться с большинством элементов и образовывать молекулы различного состава и строения обусловливает многообразие органических соединений. Органические соединения играют ключевую роль в существовании живых организмов. Предмет органической химии включает следующие цели, экспериментальные методы и теоретические представления: Выделение индивидуальных веществ из растительного, животного или ископаемого сырья; Синтез и очистка соединений; Определение структуры веществ; Изучение механизмов химических реакций; Выявление зависимостей между структурой органических веществ и их свойствами. Основные положения теории химического строения органических соединений были сформулированы профессором Казанского университета А. М. Бутлеровым в 1861 г. 1. Атомы в молекулах соединяются в строго определенном порядке в соответствии с валентностью элементов. 2. Свойства веществ зависят не только от их количественного и качественного состава, но и от того, в каком порядке соединены атомы в молекулах, т.е. от химического строения. 3. Атомы в молекулах взаимно влияют друг на друга. 4. Свойства веществ определяются их строением, и, наоборот, зная строение, можно прогнозировать свойства. 5. Химическое строение веществ может быть установлено химическими методами. 2. Классификация органических соединений по строению углеродного скелета Органические соединения наиболее часто классифицируются по двум критериям – по строению углеродного скелета молекулы или по наличию в молекуле органического соединения функциональной группы. 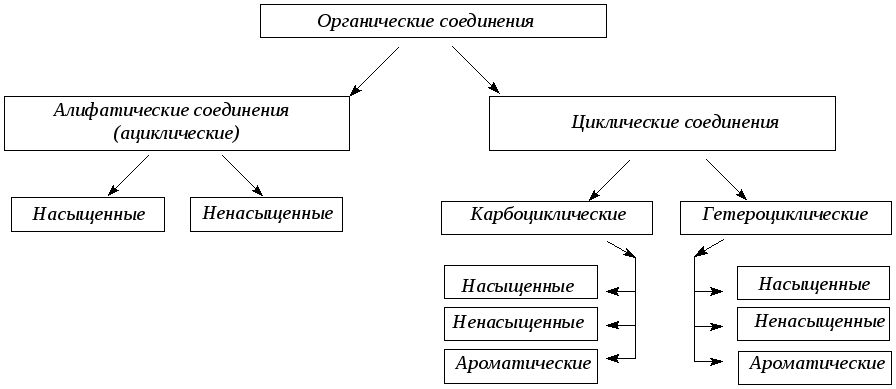 Классификацию органических молекул по строению углеродного скелета можно представить в виде схемы: Классификацию органических молекул по строению углеродного скелета можно представить в виде схемы:Ациклические соединения – это соединения с незамкнутой углеродной цепью. Их основу составляют алифатические соединения (от греческого aleiphatos – масло, жир, смола) – углеводороды и их производные, углеродные атомы которых связаны между собой в открытые неразветвленные или разветвленные цепи. Циклические соединения – это соединения, содержащие замкнутую цепь. Карбоциклические соединения в составе цикла содержат только атомы углерода, гетероциклические в составе цикла, кроме атомов углерода, содержат один или несколько гетероатомов (атомы N, O, S и др.). Классы органических соединений 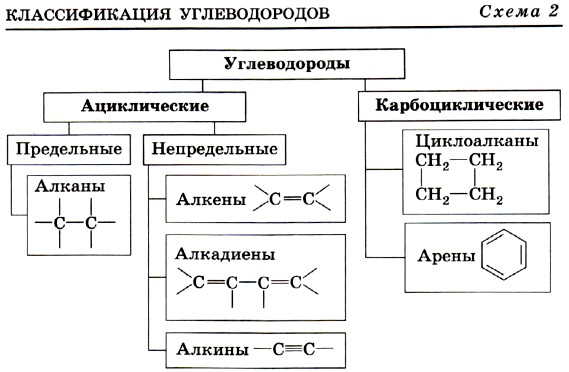 Все свободные валентности атомов углерода в цепочке могут быть затрачены на образование связей с атомами водорода. Поскольку в состав таких веществ входят только два элемента, их называют общим термином углеводороды. Классификация углеводородов представлена на схеме 2. Все свободные валентности атомов углерода в цепочке могут быть затрачены на образование связей с атомами водорода. Поскольку в состав таких веществ входят только два элемента, их называют общим термином углеводороды. Классификация углеводородов представлена на схеме 2.  Рассмотрим основные классы углеводородов. Рассмотрим основные классы углеводородов.Орбитали всех атомов углерода в молекулах алканов находятся в состоянии sр3-гибридизации и образуют только σ-связи друг с другом и атомами водорода. Все орбитали атомов углерода, не задействованные в образовании связей С–С, участвуют в образовании связей с атомами водорода. Таким образом, валентные возможности атомов углерода до предела насыщены водородными атомами, поэтому алканы относятся к предельным, или насыщенным, углеводородам. Алканы, как и другие ациклические углеводороды, могут иметь неразветвлённую (нормальную) и разветвлённую цепь атомов углерода: К ненасыщенным соединениям относятся сразу несколько классов углеводородов. 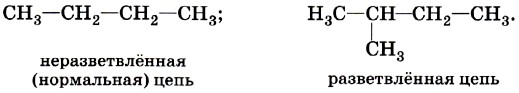  Очевидно, что в молекулах алкенов содержится не менее двух атомов углерода. Простейшим алкеном является этилен, имеющий формулу СН2=СН2. Принадлежность углеводородов к классу алкенов отражается в их названии с помощью суффикса -ен. Очевидно, что в молекулах алкенов содержится не менее двух атомов углерода. Простейшим алкеном является этилен, имеющий формулу СН2=СН2. Принадлежность углеводородов к классу алкенов отражается в их названии с помощью суффикса -ен. Как вы думаете, какое минимальное число атомов углерода может содержаться в молекуле алкадиена? Если допустить, что один атом углерода может образовывать с двумя соседями две двойные связи, то в простейшем диеновом углеводороде должно содержаться как минимум три углеродных атома:  Сам термин «алка + ди 4- ен» указывает на наличие в молекуле углеводорода двух двойных связей. Сам термин «алка + ди 4- ен» указывает на наличие в молекуле углеводорода двух двойных связей.Наличие тройной связи в молекуле отражается суффиксом -ин в названии вещества. Простейшим алкином является этин СН≡СН, называемый также ацетиленом. Таким образом, углеводороды, молекулы которых содержат кроме одинарных также и кратные (двойные или тройные) связи, относятся к непредельным (ненасыщенным) углеводородам.  Углеводороды могут содержать замкнутую цепочку углеродных атомов. В этом случае вещество относится к группе циклических углеводородов (см. схему 1). Углеводороды могут содержать замкнутую цепочку углеродных атомов. В этом случае вещество относится к группе циклических углеводородов (см. схему 1).Циклические углеводороды, содержащие в молекуле цикл из шести атомов углерода с чередующимися двойными и одинарными связями (так называемую систему сопряжённых π-связей), называются аренами. Их относят также к группе ароматических соединений. Вы уже знаете, что помимо углерода и водорода в состав органических соединений могут входить атомы других элементов, в первую очередь кислорода, азота, галогенов. Классификация органических соединений в зависимости от природы гетероатома приведена на схеме 3. 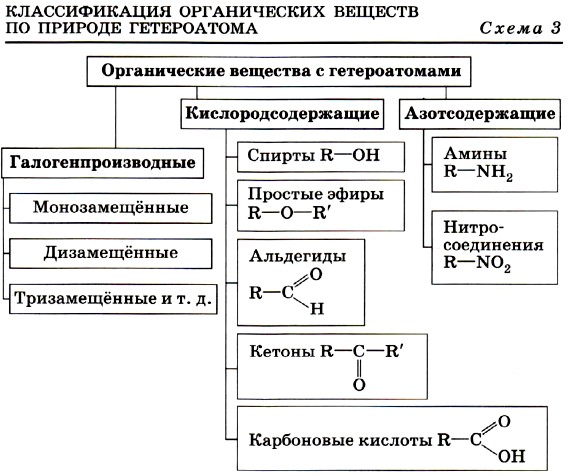  Необходимо отметить, что галогенпроизводные углеводородов могут вовсе не содержать в молекуле атомов водорода. Необходимо отметить, что галогенпроизводные углеводородов могут вовсе не содержать в молекуле атомов водорода. По числу атомов галогена в молекуле различают моно-, ди-, три- и т. д. галогенпроизводные: По числу атомов галогена в молекуле различают моно-, ди-, три- и т. д. галогенпроизводные:Кислород в органических веществах, в отличие от водорода и галогенов, всегда двухвалентен, следовательно, образует две химические связи с другими атомами. Валентность атома азота также всегда больше единицы. Именно поэтому кислород и азот входят в состав органических веществ не как отдельные атомы, а в виде группы атомов. Такая группа называется функциональной. Именно она определяет важнейшие физические и химические свойства вещества в целом, а также его принадлежность к тому или иному классу веществ.  Гидроксилъная группа (–ОН) является функциональной группой одного из важнейших классов органических соединений – спиртов. Эта группа может заменять атом водорода в соединениях с самым различным типом углеродного скелета, поэтому спирты могут быть предельными, непредельными, циклическими и т. д. То же самое относится и к органическим веществам других классов, содержащих иные функциональные группы. 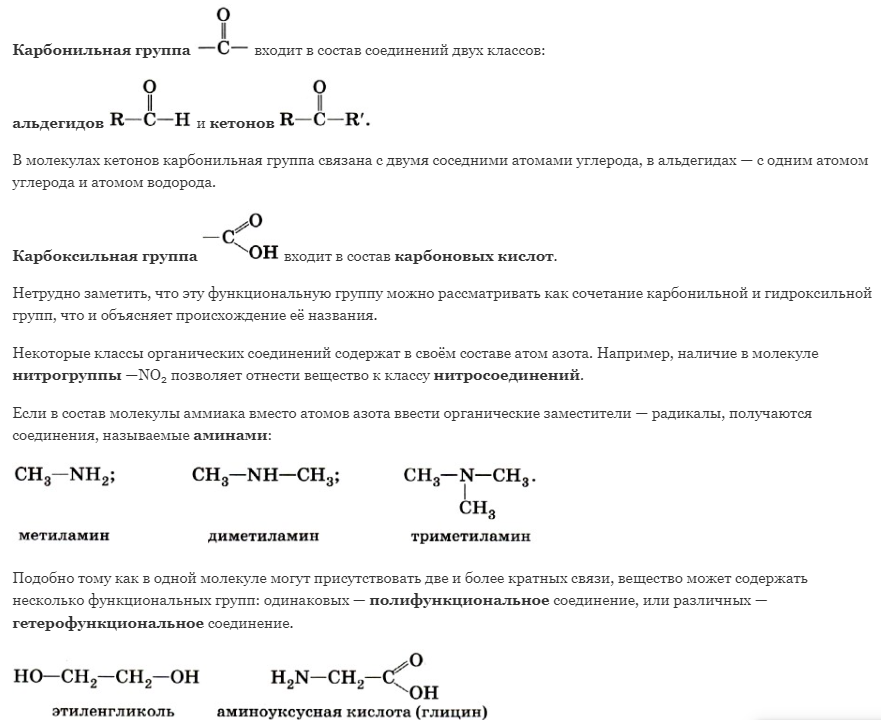 Простые эфиры можно рассматривать как продукты замещения атома водорода в гидроксильной группе спиртов на углеводородный радикал. Простые эфиры можно рассматривать как продукты замещения атома водорода в гидроксильной группе спиртов на углеводородный радикал.В таблице 2 приведены основные классы органических веществ и примеры соединений этих классов. 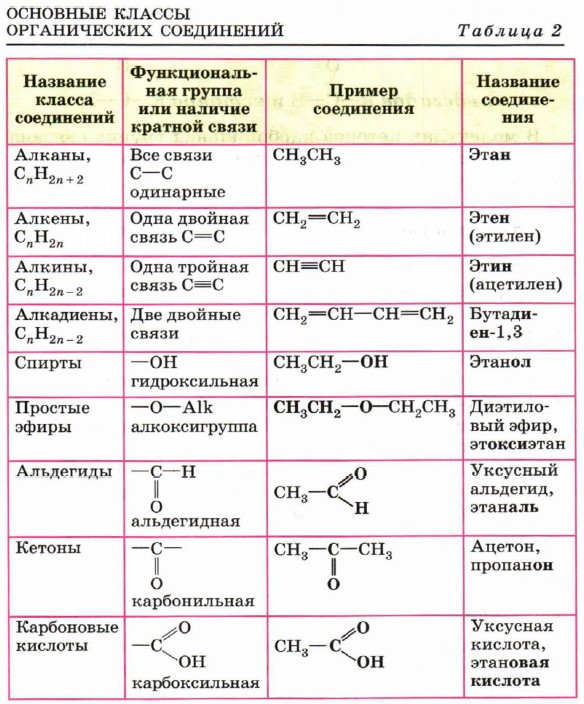 Вам уже известно, что атомы кислорода, азота, серы могут входить не только в состав функциональных групп, но и быть частью замкнутой цепочки атомов – цикла. Такие соединения называются гетероциклическими или гетероциклами. Ниже приведены формулы и названия некоторых наиболее важных гетероциклических соединений: 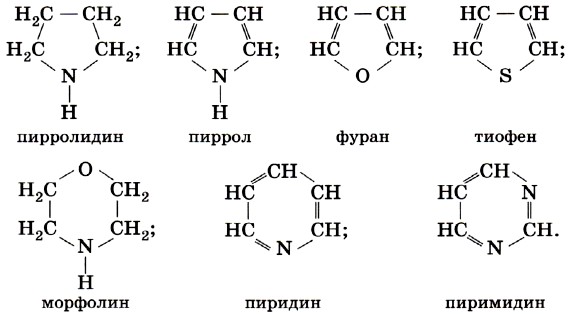 Гетероциклические соединения играют важную роль в биохимических процессах: они входят в состав многих природных и биологически активных веществ – белков, нуклеиновых кислот, витаминов, лекарственных средств. Некоторые гетероциклы, например, пиррол, фуран, тиофен, пиридин, пиримидин, как и арены, содержат сопряжённую систему π-связей и, следовательно, могут быть отнесены к ароматическим соединениям. Приведённый обзор типов и классов органических соединений позволил вам ещё раз убедиться в том, как велико разнообразие органических веществ. Запомнить названия такого количества соединений просто невозможно. Этого делать и не придётся. Названия веществ можно не запоминать, а составлять на основании их химического строения по определённым правилам. Эти правила регламентирует особая система названий – номенклатура, с которой вы и познакомитесь при изучении следующего параграфа. 3. Систематическая номенклатура органических соединений В настоящее время для наименования органических соединений применяются три типа номенклатуры: тривиальная, рациональная и систематическая номенклатура – номенклатура IUPAC (ИЮПАК) – International Union of Pure and Applied Chemistry (Международного союза теоретической и прикладной химии). Тривиальная (историческая) номенклатура – первая номенклатура, возникшая в начале развития органической химии, когда не существовало классификации и теории строения органических соединений. Органическим соединениям давали случайные названия по источнику получения (щавелевая кислота, яблочная кислота, ванилин), цвету или запаху (ароматические соединения), реже – по химическим свойствам (парафины). Многие такие названия часто применяются до сих пор. Например, мочевина, толуол, ксилол, индиго, уксусная кислота, масляная кислота, валериановая кислота, гликоль, аланин и многие другие. Рациональная номенклатура – по этой номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда. Все остальные соединения рассматриваются как производные этого соединения, образованные замещением в нем атомов водорода углеводородными или иными радикалами (например, триметилуксусный альдегид, метиламин, хлоруксусная кислота, метиловый спирт). В настоящее время такая номенклатура применяется только в тех случаях, когда она дает особенно наглядное представление о соединении. Систематическая номенклатура – номенклатура IUPAC – международная единая химическая номенклатура. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений и пытается решить главную проблему номенклатуры: название каждого органического соединения должно содержать правильные названия функций (заместителей) и основного скелета углеводорода и должно быть таким, чтобы по названию можно было написать единственно правильную структурную формулу. Процесс создания международной номенклатуры был начат в 1892 г. (Женевская номенклатура), продолжен в 1930 г. (Льежская номенклатура), с 1947 г. дальнейшее развитие связано с деятельностью комиссии ИЮПАК по номенклатуре органических соединений. Публиковавшиеся в разные годы правила ИЮПАК собраны в 1979 г. в “голубой книге” [Nomenclature of Organic Chemistry, Section A, B, C, D, E, F and H, Oxford Pergamon Press, 1979]. Своей задачей комиссия ИЮПАК считает не создание новой, единой системы номенклатуры, а упорядочение, “кодификацию”, имеющейся практики. Результатом этого является сосуществование в правилах ИЮПАК нескольких номенклатурных систем, а, следовательно, и нескольких допустимых названий для одного и того же вещества. Правила ИЮПАК опираются на следующие системы: заместительную, радикало-функциональную, аддитивную (соединительную), заменительную номенклатуру и т.д. В заместительной номенклатуре основой названия служит один углеводородный фрагмент, а другие рассматриваются как заместители водорода (например, (C6H5)3CH – трифенилметан). В радикало-функциональной номенклатуре в основе названия лежит название характеристической функциональной группы, определяющей химический класс соединения, к которому присоединяют наименование органического радикала, например: C2H5OH – этиловый спирт; C2H5Cl – этилхлорид; CH3–O–C2H5 – метилэтиловый эфир; CH3–CO–CH = CH2 – метилвинилкетон. В соединительной номенклатуре название составляют из нескольких равноправных частей (например, C6H5–C6H5 бифенил) или добавляя обозначения присоединенных атомов к названию основной структуры (например, 1,2,3,4-тетрагидронафталин, гидрокоричная кислота, этиленоксид, стиролдихлорид). Заменительную номенклатуру применяют при наличии неуглеродных атомов (гетероатомов) в молекулярной цепи: корни латинских названий этих атомов с окончанием “а” (а-номенклатура) присоединяют к названиям всей структуры, которая получилась бы, если бы вместо гетероатомов был углерод (например, CH3–O–CH2–CH2–NH–CH2–CH2–S–CH3 2-окса-8-тиа-5-азанонан). Система ИЮПАК является общепризнанной в мире, и лишь адаптируется соответственно грамматике языка страны. Полный набор правил применения системы ИЮПАК ко многим менее обычным типам молекул длинен и сложен. Здесь представлено лишь основное содержание системы, но это позволяет осуществлять наименование соединений, для которых применяется система. 4. Изомерия органических соединений Изомерия – существование разных веществ с одинаковой молекулярной формулой. Данное явление обусловлено тем, что одни и те же атомы могут по-разному соединяться друг с другом. Все изомеры делят на два больших класса – структурные изомеры и пространственные изомеры (стереоизомеры). Структурными называют изомеры, отвечающие различным структурным формулам органических соединений (с разным порядком соединения атомов). Стереоизомерами называют соединения, имеющие одинаковый состав и одинаковый порядок соединения атомов, но отличающиеся расположением атомов в пространстве. Структурные изомеры. В соответствии с приведенной выше классификацией органических соединений по типам среди структурных изомеров выделяют три группы: 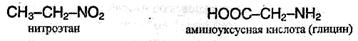 1) соединения, содержащие различные функциональные группы и относящиеся к различным классам органических соединений, например: 1) соединения, содержащие различные функциональные группы и относящиеся к различным классам органических соединений, например: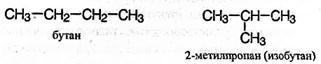 2) соединения, отличающиеся углеродными скелетами: 2) соединения, отличающиеся углеродными скелетами: 3) соединения, отличающиеся положением заместителя или кратной связи в молекуле: 3) соединения, отличающиеся положением заместителя или кратной связи в молекуле:Пространственные изомеры (стереоизомеры). Стереоизомеры можно разделить на два типа: геометрические изомеры и оптические изомеры. Геометрическая изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах часто возможно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от этой плоскости. Если изменение ориентации этих заместителей относительно плоскости возможно только за счет разрыва одной из химических связей, то говорят о наличии г 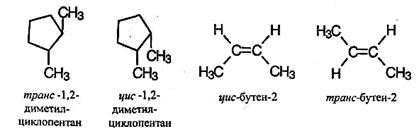 еометрических изомеров. еометрических изомеров. Геометрические изомеры могут существенно отличаться своими физическими и химическими свойствами. Оптическими изомерами называют молекулы, зеркальные изображения которых не совместимы друг с другом. Их можно разделить на два типа: энантиомеры и диастереомеры. Стереоизомеры, имеющие зеркальную конфигурацию асимметрических (хиральных) центров, называютэнантиомерами илиоптическими антиподами. Энантиомерия характерна для молекул, имеющих один асимметрический (хиральный) атом углерода, т.е. атом, связанный с четырьмя различными атомами или группами атомов. Молекулы энантиомеров относятся друг к другу как предмет и несовместимое с ним зеркальное отображение. Энантиомеры имеют одинаковые физические и химические свойства, но отличаются знаком вращения поляризованного света. 5. Классификация органических реакций и их компонентов 1. Классификация органических реакций: а) по характеру изменения связей в реагирующих веществах; б) по конечному результату (или по направлению) реакции. 2. Кислотно-основные взаимодействия. Органических реакций очень много, однако, используя различные критерии, их можно классифицировать. В результате всё многообразие реакций можно свести к небольшому числу типов реакций. Взаимодействующие в органической реакции вещества подразделяют на реагент и субстрат. При этом считается, что реагент атакует субстрат. Субстратом, как правило, считают молекулу, которая предоставляет атом углерода для новой связи. Классификация органических реакций: 1. по характеру изменения связей в реагирующих веществах реакции подразделяют на радикальные и ионные. а) Радикальные реакции протекают с участием радикалов (R.) - частиц с неспаренным электроном и образуемых в результате гомолитического разрыва ковалентной связи, например, CI:CI → ·CI + ·CI. Для радикалов характерна высокая реакционная активность, реакции с их участием протекают с очень большой скоростью. Примеры радикальных реагентов: ·CI, ·Br, ·J, ·NO2, ·OH, ·R(алкил) и др. б) Ионные реакции протекают с участием ионов, образуемых в результате гетеролитического разрыва ковалентной связи: Е: N → Е+ +: N-. Электрофилы (электро+фил - любящий электрон) (Е): Br+, Cl+, H+, R+, NO2 + и нейтральные молекулы с электронодефицитным центром - SO3, BF3, соли алюминия, цинка, железа (III) и др. Электрофил представляет незаполненные, вакантные орбитали для образования ковалентной связи. Нуклеофилы (нуклеос+фил - любящий протон) (N): Hal-, OH-, RO-, RS-, RCOO-, R-, CN- и нейтральные молекулы с неподеленной электронной парой, например, H2O: ROH, NH3, RNH2 и др. За счет пары электронов нуклеофил способен образовывать новую ковалентную связь. 2. по конечному результату (или по направлению) реакции подразделяют: а) реакции присоединения - символ А (анг. -addition). Присоединение реагента к субстрату происходит по π-связям или по σ-связям циклических структур (размыкание цикла), в результате реакций образуются новые ковалентные σ-связи. Реакции присоединения могут быть электрофильными (АЕ):  Реакции присоединения водорода называют гидрированием, воды - гидратацией, галогенов - галогенированием (хлорирование, бромирование и т.д.), галогеноводородов - гидрогалогенированием и др. Реакции присоединения водорода называют гидрированием, воды - гидратацией, галогенов - галогенированием (хлорирование, бромирование и т.д.), галогеноводородов - гидрогалогенированием и др. б) реакции замещения - символ S (анг. -substitution). Замещение происходит по σ-связям субстрата, в результате реакций образуются новые ковалентные σ-связи. Реакции замещения могут быть электрофильными (SЕ): нуклеофильными (SN):  Н3Сδ+-Оδ- H + Нδ+-Clδ- → Н3С-Cl + HОН, радикальными (SR): Н3С-H + Cl-Cl → Н3С-Cl + HCl. в) реакции отщепления или элиминирования - символ Е (анг. - elimiation). Отщепление происходит по σ-связям субстрата. В результате α, ß-отщепления образуются новые π-связи, в результате α, γ- или α, δ-отщепления образуются новые ковалентные σ-связи циклических соединений.  замещения (символы SN1 и SN2), мономолекулярного и бимолекулярного отщепления (символы Е1 и Е2) и др. Кислотно-основные взаимодействия В настоящее время существуют две основных теории кислот и оснований: теория Брёнстеда-Лоури (1923 г.) и теория Льюиса (1926 г.). Кислоты Брёнстеда – это соединения, способные отдавать протон (доноры протона). Основания Брёнстеда – это соединения, способные присоединять протон (акцепторы протона). Для взаимодействия с протоном основание должно иметь свободную пару электронов или электроны π-связи.  Кислоты и основания образуют сопряженные кислотно-основные пары: Кислоты и основания образуют сопряженные кислотно-основные пары:В зависимости от природы элемента, с которым связан протон, различают четыре основных типа органических кислот Брёнстеда: O-H-кислоты - карбоновые кислоты, спирты, фенолы; S-H-кислоты - тиолы; N-H-кислоты - амины, амиды, имиды; C-H-кислоты - углеводороды и их производные. Мерой силы кислоты является константа кислотности (ионизации) Ка или рКа. Чем больше Ка (или меньше рКа), тем сильнее кислота. В зависимости от природы атома, к неподеленной паре электронов которого присоединяется протон, основания Брёнстеда делят на три основных типа: N (аммониевые) основания - амины, нитрилы, азотсодержащие гетероциклические соединения; О (оксониевые) основания - спирты, простые эфиры, альдегиды, кетоны, карбоновые кислоты и их функциональные производные; S (сульфониевые) основания - тиолы, сульфиды. Особый тип оснований Бренстеда представляют π-основания, в которых центром основности являются электроны π-связи (алкены, арены). При прочих равных условиях для элементов одного периода с ростом электроотрицательности атома кислотность соединений увеличивается, так как высокая электроотрицательность атома при кислотном центре стабилизирует образующийся при отщеплении протона анион. Так, кислотность уменьшается в ряду: OH-кислоты> NH-кислоты> CH-кислоты Для элементов одной подгруппы с возрастанием заряда ядра и поляризуемости атома кислотность соединений увеличивается: OH-кислоты Введение заместителя в углеводородный радикал влияет на силу кислоты. Электроноакцепторные (ЭА) заместители увеличивают, а электронодонорные (ЭД) - уменьшают кислотность, поскольку электроноакцепторные заместители стабилизируют сопряженное основание (анион), а электронодонорные заместители - дестабилизируют. Основность уменьшается в ряду: N-основания> О-основания> S-основания (NOS) Введение электронодонорных заместителей увеличивает, а введение электроакцепторных - понижает основность. Дж. Льюисом была предложена более общая теория кислот и оснований. Основания Льюиса – это доноры пары электронов (спирты, алкоголят-анионы, простые эфиры, амины и т.д.) Кислоты Льюиса – это акцепторы пары электронов, т.е. соединения, имеющие вакантную орбиталь (ион водорода и катионы металлов: H+, Ag+, Na+, Fe2+; галогениды элементов второго и третьего периодов BF3, AlCl3, FeCl3, ZnCl2; галогены; соединения олова и серы: SnCl4, SO3). Кислотно-основное взаимодействие по Льюису - это доноро-акцепторное взаимодействие и любую гетеролитическую реакцию можно представить, как взаимодействие кислоты и основания Льюиса. 6. Классификация кислородсодержащих органических соединений. Классификация кислородсодержащих органических соединений 1. Спирты – это кислородсодержащие органические соединения, содержащие в своем составе гидроксильную группу. 2. Альдегиды характеризуются наличием альдегидной группы: 3. Кетоны содержат карбоксильную группу, связанную с двумя радикалами. 4. Карбоновые кислоты отличает от других кислородсодержащих органических соединений карбоксильная группа. 5. Эфиры: а) простые R-O-R` б) сложные 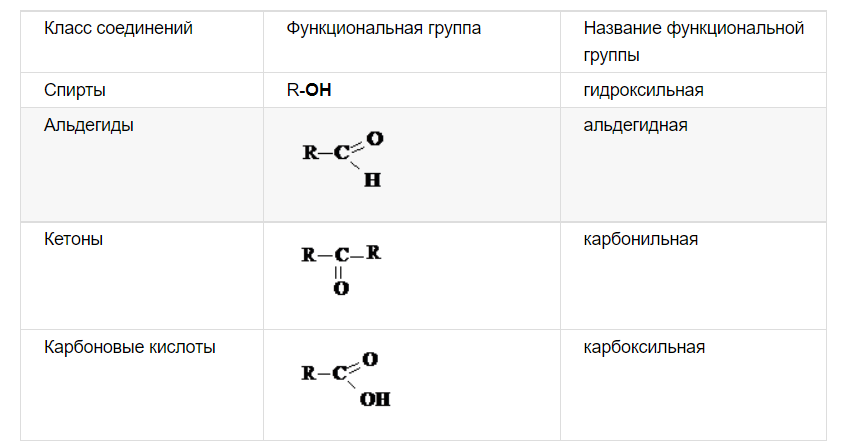 Химические свойства этих соединений определяются наличием в их молекулах различных функциональных групп. Химические свойства этих соединений определяются наличием в их молекулах различных функциональных групп. 7. Классификация, номенклатура спиртов. Основные физико-химические свойства. Важнейшие представители спиртов, биологическая роль и применение. 7. Классификация, номенклатура спиртов. Основные физико-химические свойства. Важнейшие представители спиртов, биологическая роль и применение.        Применение спиртов Способность спиртов участвовать в разнообразных химических реакциях позволяет их использовать для получения всевозможных органических соединений: альдегидов, кетонов, карбоновых кислот простых и сложных эфиров, применяемых в качестве органических растворителей, при производстве полимеров, красителей и лекарственных препаратов. Метанол СН3ОН используют как растворитель, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол, в последнее время метанол рассматривают как перспективное моторное топливо. Большие объемы метанола используют при добыче и транспорте природного газа. Метанол – наиболее токсичное соединение среди всех спиртов, смертельная доза при приеме внутрь – 100 мл. Этанол С2Н5ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых кислот, используемых в качестве растворителей. Кроме того, этанол – основной компонент всех спиртных напитков, его широко применяют и в медицине как дезинфицирующее средство. Бутанол используют как растворитель жиров и смол, кроме того, он служит сырьем для получения душистых веществ (бутилацетата, бутилсалицилата и др.). В шампунях он используется как компонент, повышающий прозрачность растворов. Бензиловый спирт С6Н5–CH2–OH в свободном состоянии (и в виде сложных эфиров) содержится в эфирных маслах жасмина и гиацинта. Он обладает антисептическими (обеззараживающими) свойствами, в косметике он используется как консервант кремов, лосьонов, зубных эликсиров, а в парфюмерии - как душистое вещество. Фенетиловый спирт С6Н5–CH2–CH2–OH обладает запахом розы, содержится в розовом масле, его используют в парфюмерии. Этиленгликоль HOCH2–CH2OH используют в производстве пластмасс и как антифриз (добавка, снижающая температуру замерзания водных растворов), кроме того, при изготовлении текстильных и типографских красок. Диэтиленгликоль HOCH2–CH2OCH2–CH2OH используют для заполнения тормозных гидравлических приспособлений, а также в текстильной промышленности при отделке и крашении тканей. Глицерин HOCH2–CH(OH)–CH2OH применяют для получения полиэфирных глифталевых смол, кроме того, он является компонентом многих косметических препаратов. Нитроглицерин (рис. 6) – основной компонент динамита, применяемого в горном деле и железнодорожном строительстве в качестве взрывчатого вещества. Пентаэритрит (HOCH2)4С применяют для получения полиэфиров (пентафталевые смолы), в качестве отвердителя синтетических смол, как пластификатор поливинилхлорида, а также в производстве взрывчатого вещества тетранитропентаэритрита. Многоатомные спирты ксилит НОСН2–(СНОH)3–CН2ОН и сорбит НОСН2– (СНОН)4–СН2OН имеют сладкий вкус, их используют вместо сахара в производстве кондитерских изделий для больных диабетом и людей, страдающих от ожирения. Сорбит содержится в ягодах рябины и вишни. Биологическая роль спиртов Основным спиртом, используемых в медицинских целях, является этанол. Этанол (этиловый спирт, винный спирт, спирт пищевой) - прозрачная, бесцветная, летучая жидкость, может смешиваться с водой и органическими растворителями, значительно менее ядовит, чем метанол, широко применяется в медицине и косметике в качестве растворителя для биологически активных веществ (эфирных масел, смол, йода и т.д.). Получают этанол в результате брожения веществ, содержащих сахар и крахмал. Процесс брожения происходит за счет ферментов дрожжей. После брожения спирт выделяют путем перегонки. Затем производится очистка от нежелательных веществ-примесей (ректификация). Этанол поступает в аптеки в основном крепостью 96°. Другие смеси этанола с водой содержат 90, 80, 70, 40% спирта. Почти чистый спирт (с очень незначительными примесями воды) называют абсолютным спиртом. Фармакологическое действие – антисептическое, дезинфицирующее, местнораздражающее. Коагулирует белки. Активен в отношении грамположительных и грамотрицательных бактерий и вирусов. Наибольший антисептический эффект на коже и слизистых достигается при использовании 70% растворов. Обладает дубящим действием на кожу и слизистые оболочки. При нанесении алкоголя на кожу или слизистые оболочки вначале ощущается холод, а затем жжение и появляется гиперемия. Чувство холода быстро сменяется жжением, а затем угнетением, что ведет к уменьшению болезненности и ослаблению чувствительности. На слизистые оболочки алкоголь действует сильнее, чем на кожу. В слабых концентрациях (2—3%) он вызывает гиперемию слизистой оболочки ротовой полости и саливацию, а в желудке—гиперемию, умеренное жжение, усиление секреции желез. Переваривающая сила желудочного сока при слабых концентрациях алкоголя (1—2%) усиливается, а при больших концентрациях (20—30%) резко ослабевает. Усиление секреции желудочного сока наиболее значительно при 5—10%-ной концентрации алкоголя; при 20%-ной концентрации одновременно с понижением секреции увеличивается отделение слизи. Двигательные функции желудка и кишечника существенно не изменяются, и только от больших доз алкоголя может наступить замедление перистальтики. В концентрированных растворах (70—90%) алкоголь вызывает сильное раздражение с выделением большого количества слизи, причем вполне возможно омертвение поверхностных слоев слизистой оболочки. При продолжительном употреблении алкоголя развивается гастроэнтерит с нарушением секреторной и моторной деятельности и резким ослаблением процессов пищеварения. 2. Этиловый спирт в фармацевтической промышленности А) Использование этанола в качестве экстрагента. Изготовление лекарственных препаратов связано с применением различных жидкостей, необходимых для растворения или извлечения фармакологически активных веществ. В зависимости от назначения эти жидкие вещества могут быть растворителями или экстрагентами. Из органических растворителей наиболее часто применяется этанол при получении настоек, экстрактов и концентратов из лекарственного растительного сырья. Одновременно выполняет роль консерванта. Если же экстрагент не удовлетворяет указанным требованиям, то смеси с другими веществами, например, спирт с водой, спирт с эфиром или с глицерином. Но необходимо помнить, что при смешивании воды и спирта наблюдается явлении контракции, заключающееся в уменьшении объема смеси против арифметической суммы исходных веществ: 50 л спирта + 50 л воды = 96,4 л смеси (чтобы получилось 100 л 54% об. спирта нужно взять 54 л спирта и 49,679 л воды). Поэтому разработаны таблицы для разведения спирта (приложение к ГФ Х). Спирт как экстрагент: 1)является хорошим растворителем многих соединений, которые не извлекаются водой, например, жиры, алкалоиды, хлорофилл, глюкозиды, эфирные масла, смолы и др.; 2)обладает антисептическими свойствами (в спиртоводных растворах более 20% не развиваются микроорганизмы и плесени); 3)чем крепче спирт, тем менее возможны в его средах гидролитические процессы. Спирт инактивирует ферменты; 4)достаточно летуч, поэтому спиртовые извлечения легко сгущаются и высушиваются до порошкообразных веществ. Для сохранения термолабильных веществ выпаривание и сушка проводятся под вакуумом; 5)значительно труднее, чем вода, проникает через стенки клеток, отнимая воду у белков и слизистых веществ, превращая их в осадки, закупоривающие поры клеток и тем самым ухудшающие диффузию. Чем ниже концентрация спирта, тем легче он проникает внутрь клеток. Итак, спирт-экстрагент имеет более широкий диапазон извлечения БАВ, чем вода, причем его извлекающая способность зависит от концентрации. При экстрагировании этанолом в концентрации не менее 70% получают вытяжки, свободные от биополимеров (белков, слизей, пектинов). Б) Использование спирта как неводного растворителя. Все неводные растворители должны обладать различной растворяющей способностью, антигидролизными, стабилизирующими и бактерицидными свойствами. Одноатомные и многоатомные спирты применяются в качестве неводных растворителей во многих странах мира. Они смешиваются с водой, менее вязкий, чем масла, и обладают способностью растворять многие лекарственные субстанции. Из одноатомных спиртов наибольшее распространение получил этиловый спирт. Его часто применяют в качестве компонента многих растворов для инъекций. В качестве со растворителя в смеси с водой он применяется для получения иңекционных растворов гидрокортизона, ряда сердечных препаратов: дигитоксина (50% спирта), мефеназина (25% спирта), дигоксина (10% спирта) и др. Этиловый спирт используется как со растворитель и консервант в концентрации от 2 до 30% при изготовлении растворов сердечных глюкозидов: конваллятоксина, целанида, зризимина и строфантина К. Этиловый спирт включен в состав смешанных растворителей (используемых для приготовления иңекционных растворов) в Международную фармакопею 2-го издания и фармакопеи ряда зарубежных стран. Этанол может применяться в качестве так называемого промежуточного растворителя. Этот технологический прием используется для приготовления растворов некоторых противоопухолевых препаратов, нерастворимых ни в воде, ни в маслах. С этой целью препараты растворяют в минимальном количестве этилового спирта, смешивают с оливковым маслом (получается эмульсия), затем спирт отгоняется под вакуумом и образуется масляный раствор. Так же этиловый спирт используется в качестве вспомогательного вещества в мягких лекарственных формах, являясь гидрофильным растворителем. В) Использование этанола в качестве вспомогательного вещества в производстве таблеток. Для достижения необходимой силы сцепления при сравнительно небольших давлениях к таблетируемым веществам добавляют связывающие вещества. Заполняя межчастичное пространство, они увеличивают контактную поверхность частиц. Спирт используется для гранулирования гигроскопичных порошков, чаще всего тогда, когда в состав массы для таблетирования входят сухие экстракты из лекарственного растительного сырья – эти вещества с водой и водными растворами образуют клейкую оплывающую, плохо гранулируемую массу. Концентрация применяемого спирта обычно тем выше, чем более гигроскопичен порошок. В состав таблеток, получаемых формированием увлажненных масс (тритурационные) входят лекарственные и вспомогательные вещества. Порошкообразную смесь увлажняют этиловым спиртом (40-95%), он берется в точно определенном количестве до получения пластичной, но не вязкой массы. Г) Использование этанола в качестве консерванта. Одна из причин снижения качества лекарственных средств – их микробная контаминация в процессе производства или применения, которая может привести к снижению терапевтического эффекта препаратов или развитию у больного различных заболеваний. Для этого в лекарственные препараты вводятся консерванты. Консерванты являются ингибиторами роста тех микроорганизмов, которые попадают в лекарственные препараты. Они позволяют сохранить стерильность лекарственных препаратов или предельно допустимое число непатогенных микроорганизмов в нестерильных лекарственных препаратах. Так как этанол активен в отношении грамположительных и грамотрицательных бактерий и вирусов, обладает антисептическим свойством и является бактерицидной средой, его часто применяют как антимикробный консервант. В эмульсиях в количестве 10-20% от водной фазы, в галеновых и новогаленовых препаратах – до 20%. При необходимости расширения спектра антимикробного действия возможно применение комбинации консервантов, но в более низких концентрациях Трехатомный спирт - глицерин - широко используется в медицине и фармации. По консистенции глицерин похож на сироп, почти без запаха, гигроскопичен, имеет сладкий привкус, растворим во всех других веществах, содержащих ОН-группу, нерастворим в эфире, бензине, хлороформе, в жирных и эфирных маслах. В торговлю поступает 86 - 88%-ный глицерин и обезвоженный 98%-ный глицерин. В разбавленном виде глицерин входит в состав кремов для кожи, туалетной воды для лица, зубных паст, мыла для бритья, геля для рук. Разбавленный в соответствующей пропорции, он смягчает кожу, делает ее эластичной, заменяя естественный фактор влажности кожи. В чистом виде в препаратах для ухода за кожей не применяется, поскольку пересушивает ее. 8. Классификация, номенклатура фенолов. Важнейшие представители фенолов, биологическая роль и применение 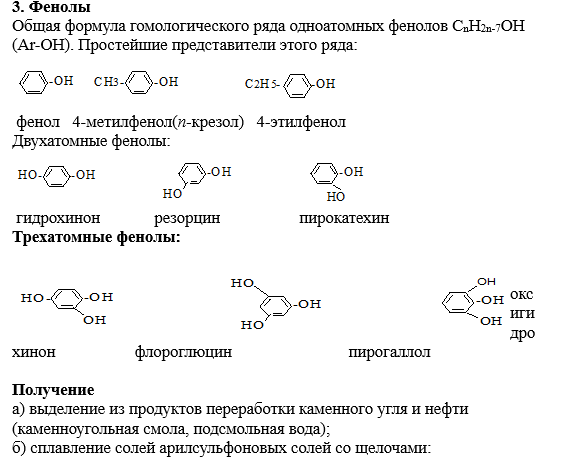        9. Классификация, номенклатура оксосоединений (альдегиды, кетоны). Основные физико-химические свойства. Важнейшие представители оксосоединений, биологическая роль и применение 9. Классификация, номенклатура оксосоединений (альдегиды, кетоны). Основные физико-химические свойства. Важнейшие представители оксосоединений, биологическая роль и применение        10. Классификация, номенклатура карбоновых кислот. Основные физико-химические свойства. Важнейшие представители карбоновых кислот, распространение в природе, биологическая роль и применение в зоотехнической практике.   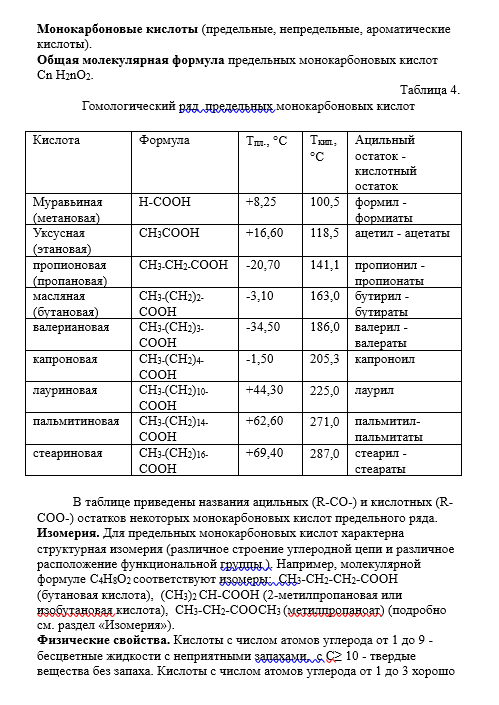                11. Строение, физико-химические свойства и функциональная роль липидов 12.Простые липиды: воски, церамиды, триацилглицеролы (нейтральные жиры) и жирные кислоты.   |
