Доклад. 1. Рассчитайте навеску натрия хлорида (Мr 58,44), чтобы на титрование пошло 25мл 0,1 мольл раствора серебра нитрата (К1,01). Для решения задачи необходимо написать уравнение реакции, указать вариант аргентометрии (соответствующий индикатор).
 Скачать 253.95 Kb. Скачать 253.95 Kb.
|
|
1. Рассчитайте навеску натрия хлорида (Мr 58,44), чтобы на титрование пошло 25мл 0,1 моль/л раствора серебра нитрата (К=1,01). Для решения задачи необходимо написать уравнение реакции, указать вариант аргентометрии (соответствующий индикатор). Рассчитать Fэ, Мэ, титр по определяемому веществу (титр соответствия). NaCl + AgNO3 = AgCl + NaNO3 Аргентометрия по Мору, индикатор - 5% раствор хромата калия. 2AgNO3 + K2CrO4 = Ag2CrO4 + 2KNO3 Fэ = 1 Mэ(NaCl) = 58,44 г/моль T(AgNO3/ NaCl ) = 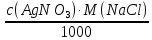 = = 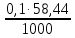 = 0,005844 г/мл = 0,005844 г/млa(NaCl) = T(AgNO3/ NaCl )·K·V(AgNO3) = 0,005844·1,01·25 = 0,1476 г 2. Рассчитать объём 0,1 моль/л раствора АgNO3 (К=1,03), который пойдёт на титрование навески натрия бромида (Мr 102,90) массой 0,1964г. Для решения задачи необходимо написать уравнение реакции, указать вариант аргентометрии (соответствующий индикатор). Рассчитать Fэ, Мэ, титр по определяемому веществу (титр соответствия). NaBr + AgNO3 = AgBr + NaNO3 Аргентометрия по Мору, индикатор - 5% раствор хромата калия. 2AgNO3 + K2CrO4 = Ag2CrO4 + 2KNO3 Fэ = 1 Mэ(NaBr) = 102,90 г/моль T(AgNO3/ NaBr ) = 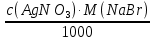 = = 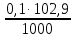 = 0,01029 г/мл = 0,01029 г/млV(AgNO3) = 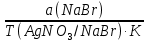 = = 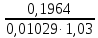 = 18,53 мл = 18,53 мл3. Приведите уравнение реакции количественного определения натрия тетрабората (Мr 381,37) методом нейтрализации (укажите индикатор). Рассчитайте Мэ, титр по определяемому веществу, навеску натрия тетрабората, что бы на её титрование пошло 20мл 0,1моль/л раствора хлороводородной кислоты. Na2B4O7 + 2HCl + 5H2O = 4H3BO3 + 2NaCl индикатор - 0,1% раствор метилового оранжевого Fэ = 1/2 Mэ(Na2B4O7) = 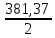 = 190,7 г/моль = 190,7 г/мольT(HCl /Na2B4O7) = 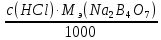 = = 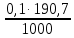 = 0,01907 г/мл = 0,01907 г/млa(NaCl) = T(HCl /Na2B4O7)·V(HCl) = 0,01907·20 = 0,3814 г 4. Приведите реакции количественного определения кислоты борной (Мr 61,83) методом нейтрализации в растворе глицерина. Почему используют глицерин при титровании 0,1моль/л раствором натрия гидроксида (выбор индикатора)? Рассчитайте Fэ, Мэ, и титр по определяемому веществу. Исходя из полученных данных рассчитайте объём титранта, который пойдёт на титрование навески кислоты борной массой 0,2104г. 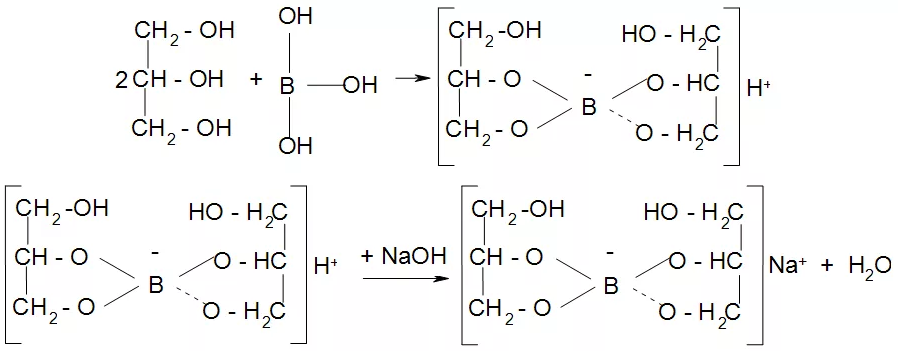 При прямом титровании кислоты борной щелочью образуется метаборат натрия, который в водных растворах сильно гидролизуется: H3BO3 + NaOH = NaBO2 + 2H2O NaBO2 + 2H2O = H3BO3 + NaOH В результате гидролиза щелочная реакция наступает до точки эквивалентности. Поэтому для количественного определения используют способность кислоты борной образовывать с глицерином сильную одноосновную диглицериноборную кислоту, которую можно с достаточной точностью оттитровать щелочью, используя в качестве индикатора фенолфталеин/ Количественное определение кислоты борной проводят в смеси свежепрокипяченной воды (свободной от углекислого газа) и нейтрализованного (по фенолфталеину) глицерина при комнатной температуре. Для контроля полноты образования натриевой соли диглицериноборной кислоты к концу титрования добавляют дополнительную порцию глицерина. Сохранение при этом розовой окраски свидетельствует о достижении эквивалентной точки. Если окраска исчезает, вновь добавляют глицерин и титрование продолжают. Добавление глицерина продолжают до тех пор, пока розовая окраска не перестанет исчезать. Fэ = 1 Mэ(H3BO3) = 61,83 г/моль T(NaOH / H3BO3 ) = 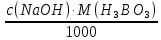 = =  = 0,006183 г/мл = 0,006183 г/млV(NaOH) = 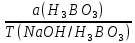 = = 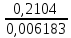 = 34,03 мл = 34,03 мл5. Рассчитать объём 0,05 моль/л трилона Б (К=98), который пойдёт на титрование аликвоты 25 мл (Vа), если навеску магния оксида массой 0,5042 обработали соответствующим образом (каким?) и довели водой до метки в мерной колбе вместимостью 250мл (W). Для решения задачи необходимо написать уравнение реакции комплексообразования, что бы рассчитать Fэ, Mэ (Mr MgO=40,31) и титр по определяемому веществу (титр соответствия). Точную навеску субстанции растворяют в 40 мл 1 М раствора хлористоводородной кислоты и доводят объем раствора водой до 250,0 мл. MgO + 2HCl = MgCl2 + H2O 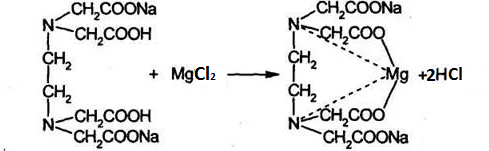 Сокращенно MgCl2 + Na2H2Y = MgNa2Y +2HCl f(MgO) = 1 Мэ(MgO) = 40,31 г/моль T(Na2H2Y / MgO) = 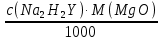 = = 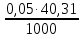 = 0,002016 г/мл = 0,002016 г/млVтеор = 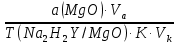 = = 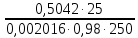 = 25,52 мл = 25,52 млK не может равняться 98, скорее всего это опечатка и значение - 0,98 6. Сделайте вывод о качестве анализируемого препарата магния сульфата (MgSO4, 7H2O, Мr=246,48)по результатам титрования 0,05 моль/л раствором трилона Б. Масса навески анализируемого препората 0,15г. На титрование пошло 12,3мл титранта. По требовонию ГФХ содержание магния сульфата должно быть не менее 99% и не более102%. Напишите уравнение реакции, условия титрования, индикатор, рассчитайте Fэ, Мэ, и титр по определяемому веществу. На основании полученных данных постройте расчётную формулу - % содержание магния сульфата в анализируемом препарате. 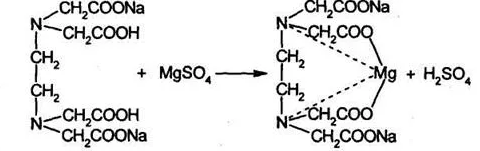 Сокращенно MgSO4 + Na2H2Y = MgNa2Y + H2SO4 f(MgSO4) = 1 Мэ(MgSO4·7H2O) = 246,48 г/моль T(Na2H2Y /MgSO4·7H2O) = 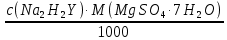 = = 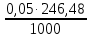 = 0,01232 г/мл = 0,01232 г/млX% = 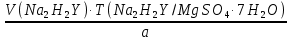 ·100 = ·100 = 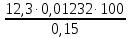 = 101,024% = 101,024%Препарат MgSO4·7H2O соответствует требованиям ГФХ по показателю "Количественное содержание, не менее 99% и не более 102%) 7. Рассчитайте содержание меди сульфата (СuSO4 5H2O, Мr249,68) в анализируемом образце (%), если на титрование навески массой 0,5244г пошло 20,8мл 0,1моль/л раствора натрия тиосульфата (К=1,01). Приведите уравнение реакции количественного определения меди сульфата методом заместительной иодометрии, рассчитайте Fэ, Мэ,и титр по определяемому веществу. 2CuSO4 + 4KI = 2CuI + I2 + 2K2SO4 I2 + 2Na2S2O3 = 2NaI + Na2S4O6 f(CuSO4) = 1 Мэ(CuSO4·5H2O) = 249,68 г/моль T(Na2S2O3/CuSO4·5H2O) = 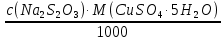 = = 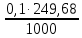 = 0,02497 г/мл = 0,02497 г/млX% = 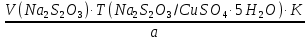 ·100 = ·100 = 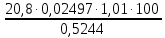 = 100,03% = 100,03% |
