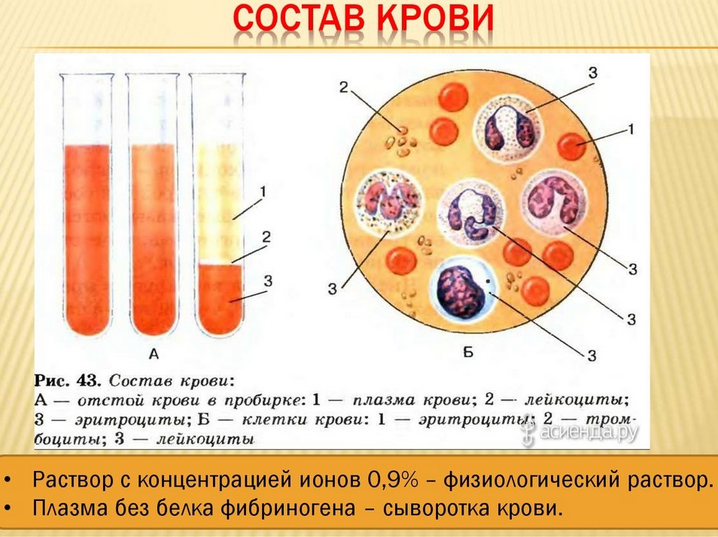
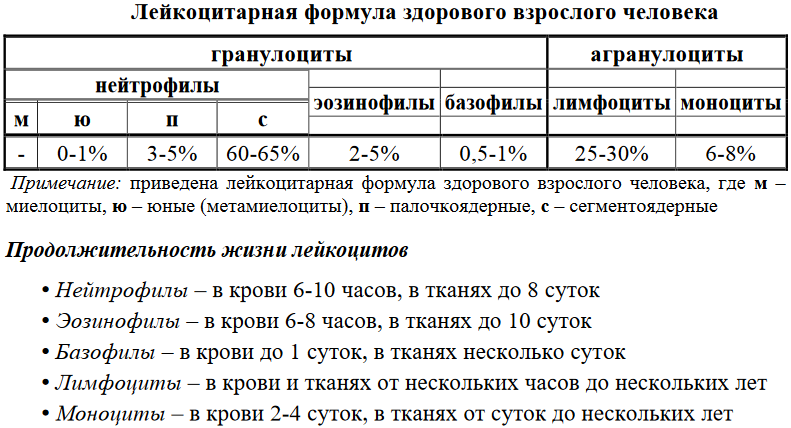
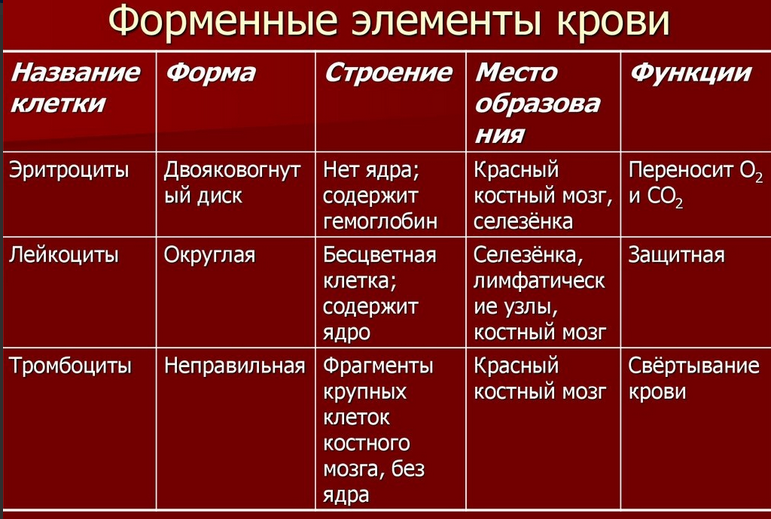
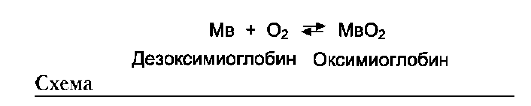
1. Состав и основные функции крови
 Скачать 3.07 Mb. Скачать 3.07 Mb.
|
|
| |
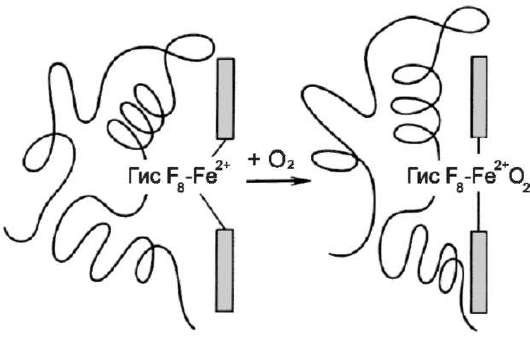
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух β-цепей, радикалам Гис122 и концевым α-аминогруппам двух α-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
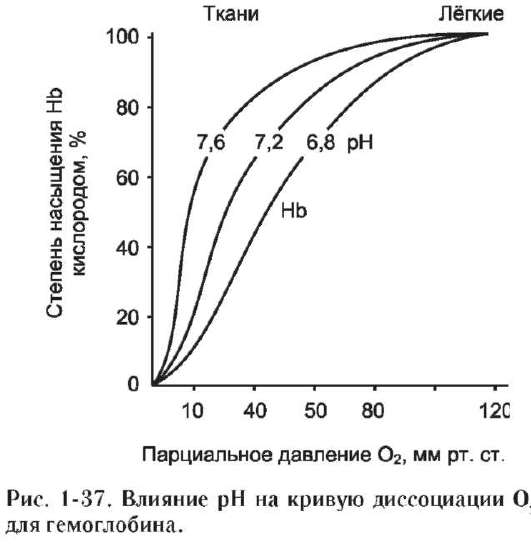
Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём (рис. 1-36, А). Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2+ + Н2О ↔ Н2СО3 ↔ Н+ + НСО3- сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом (рис. 1-36, Б).
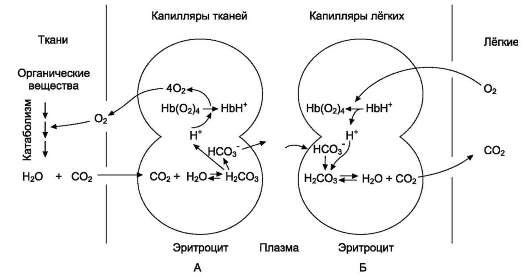
Рис. 1-36. Перенос H+ и СО2 с кровью. Эффект Бора. А - влияние концентрации СО2 и Н+ на высвобождение О2 из комплекса с гемоглобином в тканях (эффект Бора); Б - оксигенирование дезоксигемоглобина в лёгких, образование и выделение СО2.
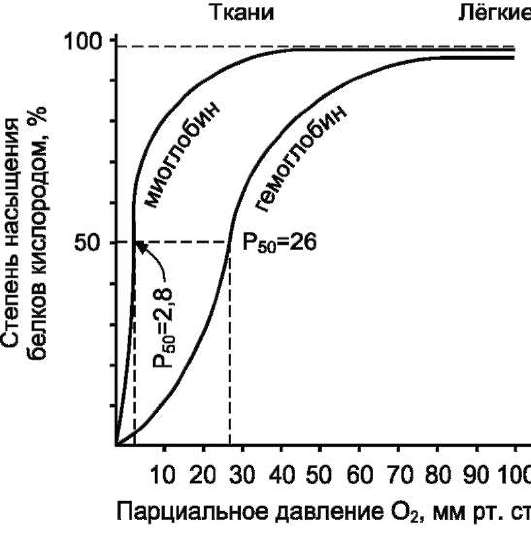
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани (рис. 1-37).
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3-. Небольшое количество СО2 (около 15-20%) может переноситься в лёгкие, обратимо присоединяясь к неионизиро-ванным концевым α-аминогруппам. R-NH2+ + СО2 = R-NH-СОО- + Н+, в результате образуется карбогемоглобин, где R - полипептидная цепь гемоглобина. Присоединение СО2 к гемоглобину также снижает его сродство к О2.
2,3-Бифосфоглицерат - аллостерический регулятор сродства гемоглобина к О2
2,3-Бифосфоглицерат (БФГ) - вещество, синтезируемое в эритроцитах из промежуточного продукта окисления глюкозы 1,3-бифос-фоглицерата.

Регуляция с помощью 2,3-Бифосфоглицерата сродства гемоглобина к О2.
В нормальных условиях 2,3-бифосфоглицера присутствует в эритроцитах примерно в той ж концентрации, что и гемоглобин. БФГ, присо-единяясь к гемоглобину, также может менят его сродство к О2.
В центре тетрамерной молекулы гемоглобин есть полость, образованная аминокислотными остатками всех четырёх протомеров. Центральная полость - место присоединения БФГ.
Размеры центральной полости могут меняться отщепление О2 от оксигемоглобина вызывае его конформационные изменения, которы способствуют образованию дополнительны ионных связей между димерами α1β1 и α2β2 В результате пространственная структура дезокси гемоглобина становится более жёсткой, напряжён ной, а центральная полость расширяется.
Поверхность полости ограничена остатками аминокислот, в числе которых имеются положительно заряженные радикалы Лиз82, Гис143 β-цепей и положительно заряженные α-аминогруппы N-концевого валина β-цепей. В расширенную полость дезоксигемоглобина БФГ, имеющий сильный отрицательный заряд, присоединяется с помощью ионных связей, образующихся с положительно заряженными функциональными группами двух β-цепей гемоглобина. Присоединение БФГ ещё сильнее стабилизирует жёсткую структуру дез-оксигемоглобина и снижает сродство белка к О2 (рис. 1-38).
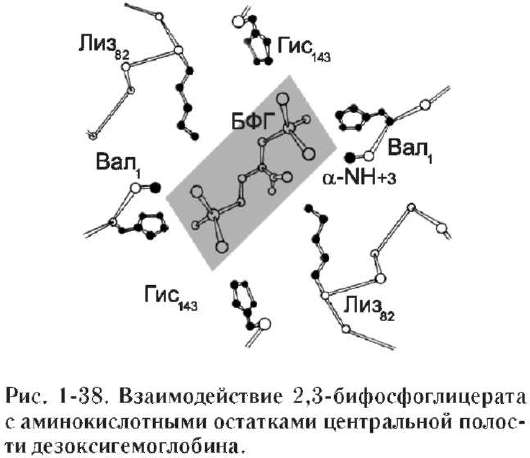
Присоединение БФГ к дезоксигемоглобину происходит в участке, ином по сравнению с гемом, где происходит связывание О2. Такой лиганд называется «аллостерический», а центр, где связывается аллостерический лиганд, - «аллостерический центр» (от греч. «аллос» - другой, иной, «стерос» - пространственный).
В лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина. Разрыв ионных связей между димерами α1β1 и α2β2 приводит к «расслаблению» белковой молекулы, уменьшению центральной полости и вытеснению БФГ.
ткани
Нв(О2)4 + БФГ ↔ Нв-БФГ + 4О2
лёгкие
Изменение концентрации БФГ как механизм адаптации организма к гипоксии.
Концентрация БФГ в эритроцитах людей, живущих в определённых климатических условиях, - величи на постоянная. Однако в период адаптации к высокогорью, когда человек поднимается на высоту более 4000 м над уровнем моря, концентрация БФГ уже через 2 дня возрастает почти в 2 раза (от 4,5 до 7,0 мМ). Это снижает сродство гемоглобина к О2 и увеличивает количество О2, транспортируемого в ткани (рис. 1-39).
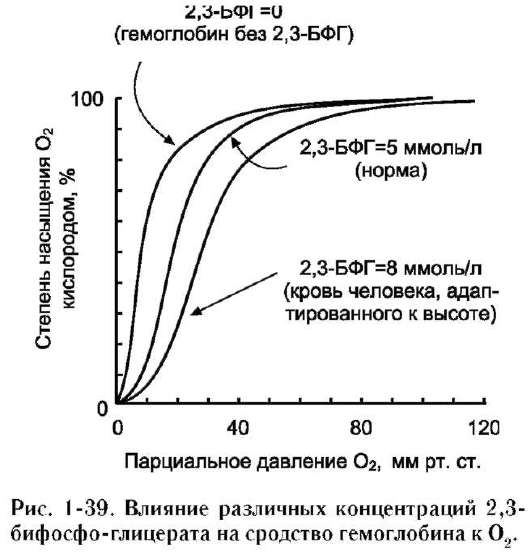
Такую же адаптацию наблюдают у больных с заболеваниями лёгких, при которых развивается общая гипоксия тканей. Так, у больных с тяжёлой обструктивной эмфиземой лёгких парциальное давление в них снижается от 100 до 50 мм рт. ст. Но при этом в эритроцитах усиливается выработка БФГ, и его концентрация повышается с 4,5 до 7,0 мМ, что существенно увеличивает доставку О2 в ткани.
Клиническое значение концентрации БФГ в консервированной крови
В крови, консервированной в некоторых средах, например цитрат-декстрозной, за 10 дней концентрация БФГ снижается с 4,5 до 0,5 мМ. Гемоглобин такой крови имеет очень высокое сродство к О2. Если кровь со сниженной концентрацией БФГ переливать тяжелобольным, возникает опасность развития гипоксии тканей. Введённые с кровью эритроциты за 24 ч могут восстановить лишь половину нормальной концентрации БФГ. Добавлением в кровь БФГ нельзя восстановить
нормальную концентрацию его в эритроцитах, так как, имея высокий отрицательный заряд, БФГ не может проникать через мембраны эритроцитов. Поэтому в настоящее время в кровь добавляют вещества, способные проникать через мембрану эритроцитов и поддерживать в них нормальную концентрацию БФГ.
Гемоглобинопатии.
Серповидноклеточная анемия - тяжёлое наследственное заболевание, обусловленное точечной мутацией гена, кодирующего структуру β-цепи гемоглобина (см. раздел 4). В результате в эритроцитах больных присутствует HbS, β-цепи которого в шестом положении вместо гидрофильной глутаминовой кислоты содержат гидрофобную аминокислоту валин. Появление гидрофобной аминокислоты недалеко от начала молекулы способствует возникновению нового центра связывания, поэтому при низком парциальном давлении кислорода тетрамеры дезокси-HbS ассоциируют, образуя длинные микротрубчатые образования, которые полимеризуются внутри эритроцитов. Полимеризация приводит к нарушению структуры эритроцитов, они приобретают серповидную форму и легко разрушаются. При этом заболевании отмечают анемию, прогрессирующую слабость, отставание в развитии и желтуху.
Носители гена серповидноклеточной анемии чаще всего встречаются среди африканского населения, так как они приобретают некоторое преимущество при заболевании малярией, часто встречающейся в странах с тропическим климатом. Причина сохранения гена серповид-ноклеточной анемии в популяции связана с тем, что в эритроцитах гетерозигот хуже развивается малярийный плазмодий, часть жизненного цикла которого проходит в эритроцитах человека. В связи с этим гетерозиготные носители дефектного гена выживали при эпидемиях малярии, однако четверть их потомства погибала от серповидно-клеточной анемии.
Талассемии - наследственные заболевания, обусловленные отсутствием или снижением скорости синтеза α- или β-цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. Это приводит к нарушению основной функции гемоглобина - транспорту кислорода к тканям. Нарушение эритропоэза и ускоренный гемолиз эритроцитов и клеток-предшественников при талассемиях приводит к анемии.
При β-талассемии не синтезируются β-цепи гемоглобина. Это вызывает образование нестабильных тетрамеров, содержащих только α-цепи. При этом заболевании в костном мозге из-за преципитации нестабильных α-цепей усиливается разрушение эритробластов, а ускорение разрушения эритроцитов в циркулирующей крови приводит к внутрисосудистому гемолизу. Как известно, для образования фетального гемоглобина β-цепи не требуются (см. раздел 4), поэтому клинически β-талассемия не проявляется до рождения, после чего происходит переключение синтеза HbF на HbA.
В случае α-талассемии недостаток образования α-глобиновых цепей приводит к нарушению образования HbF у плода. Избыточные γ-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии. При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с γ- на β-ген синтезируют β-тетрамеры или HbH, который, подобно гемоглобину Барта, имеет слишком высокое сродство к кислороду, менее стабилен, чем HbA и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Наследственный сфероцитоз. Причиной этой патологии чаще всего является дефект белков цитоскелета эритроцитов - спектрина или анкирина, которые обеспечивают поддержание двояковогнутой формы клетки и эластичности мембраны. Эритроциты приобретают шарообразную форму, что приводит к уменьшению площади их поверхности и снижению скорости газообмена. Потеря эластичности клеточной мембраны приводит к повышению хрупкости и травматичности клеток и, как следствие, к ускорению их разрушения в сосудистом русле и селезёнке. Заболевание сопровождается анемией и желтухой. Удаление селезёнки (спленэктомия) при наследственном сфероцитозе улучшает состояние больных, так как предотвращает разрушение сфероцитов в селезёнке.
Мегалобластная (макроцитарная) анемия развивается при дефиците фолиевой кислоты или витамина В12.
Фолиевая кислота в виде кофермента (Н4-фо-лата) участвует в синтезе нуклеотидов. Недостаток фолиевой кислоты приводит к снижению скорости синтеза ДНК в быстроделящихся клетках, и в первую очередь в предшественниках эритроцитов. Клетки дольше пребывают в интерфазе, синтезируя гемоглобин, и становятся крупнее. Кроме того, из-за недостатка нуклеоти-дов они реже делятся, и количество эритроцитов снижается, а крупные мегалобласты быстрее разрушаются. Всё это в конечном итоге приводит к развитию анемии.
Аналогичная симптоматика развивается при недостатке в организме витамина В12. Этот витамин участвует в переносе метильной группы с N5-метил-Н4-фолата на гомоцистеин с образованием метионина и Н4-фолата (см. раздел 10). Недостаточность витамина В12 приводит к накоплению N5-метил-Н4-фолата в клетках. Дефицит Н4-фолата приводит к нарушению деления клеток и развитию анемии.
5. Перенос углекислого газа кровью (три формы транспорта углекислого газа).

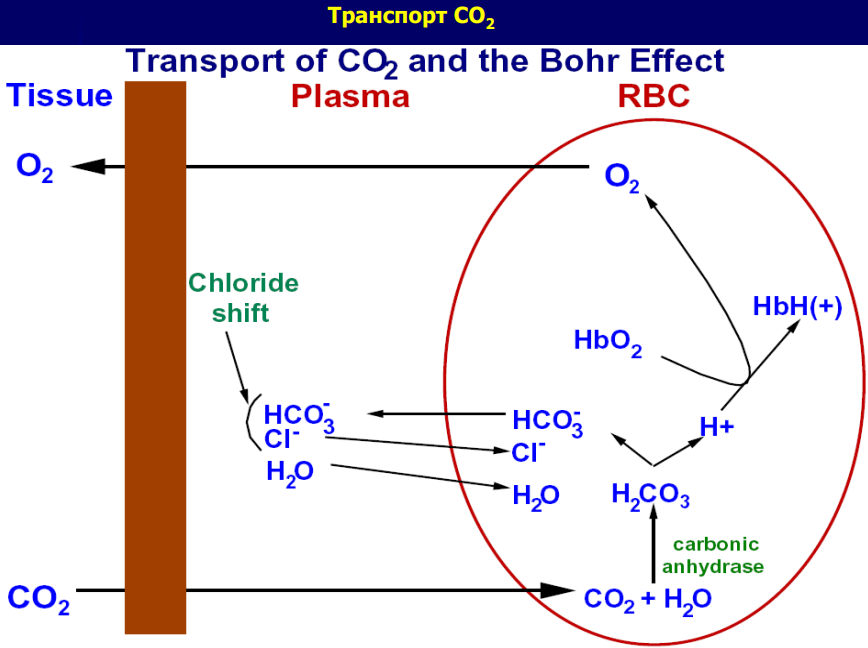
Углекислый газ транспортируется следующими путями:
- Растворенный в плазме крови - около 25 мл / л.
- Связанный с гемоглобином (карбгемоглобин) - 45 мл / л.
- В виде солей угольной кислоты - бикарбонаты калия и натрия в плазме крови-510 мл/л.
В состоянии покоя кровь транспортирует 580 мл углекислого газа в 1 л.
Основной формой транспорта СО2 является бикорбонаты плазмы, образующихся благодаря активному протеканию карбоангидразной реакции.
В эритроцитах содержится фермент карбоангидраза, который катализирует взаимодействие углекислого газа с водой с образованием угольной кислоты, распадается с образованием бикарбонатного иона и протона. Бикарбонат внутри эритроцита взаимодействует с ионами калия, выделяемых из калиевой соли гемоглобина при восстановлении последнего. Так внутри эритроцита образуется бикарбонат калия. Но бикарбонат-ионы образуются в значительной концентрации и поэтому по градиенту концентрации (в обмен на ионы хлора) поступают в плазму крови. Так в плазме образуется бикарбонат натрия. Протон, образовавшегося при диссоциации угольной кислоты, реагирует с гемоглобином с образованием слабой кислоты ННb.
В капиллярах легких эти процессы идут в обратном направлении. С ионов водорода и бикарбонатных ионов образуется угольная кислота, которая быстро распадается на углекислый газ и воду. Углекислый газ удаляется наружу.
Роль эритроцитов в транспорте углекислоты:
1) образование солей угольной кислоты;
2) образования карбгемоглобин.
6. Антиоксидантная функция эритроцитов. Роль глутатиона.
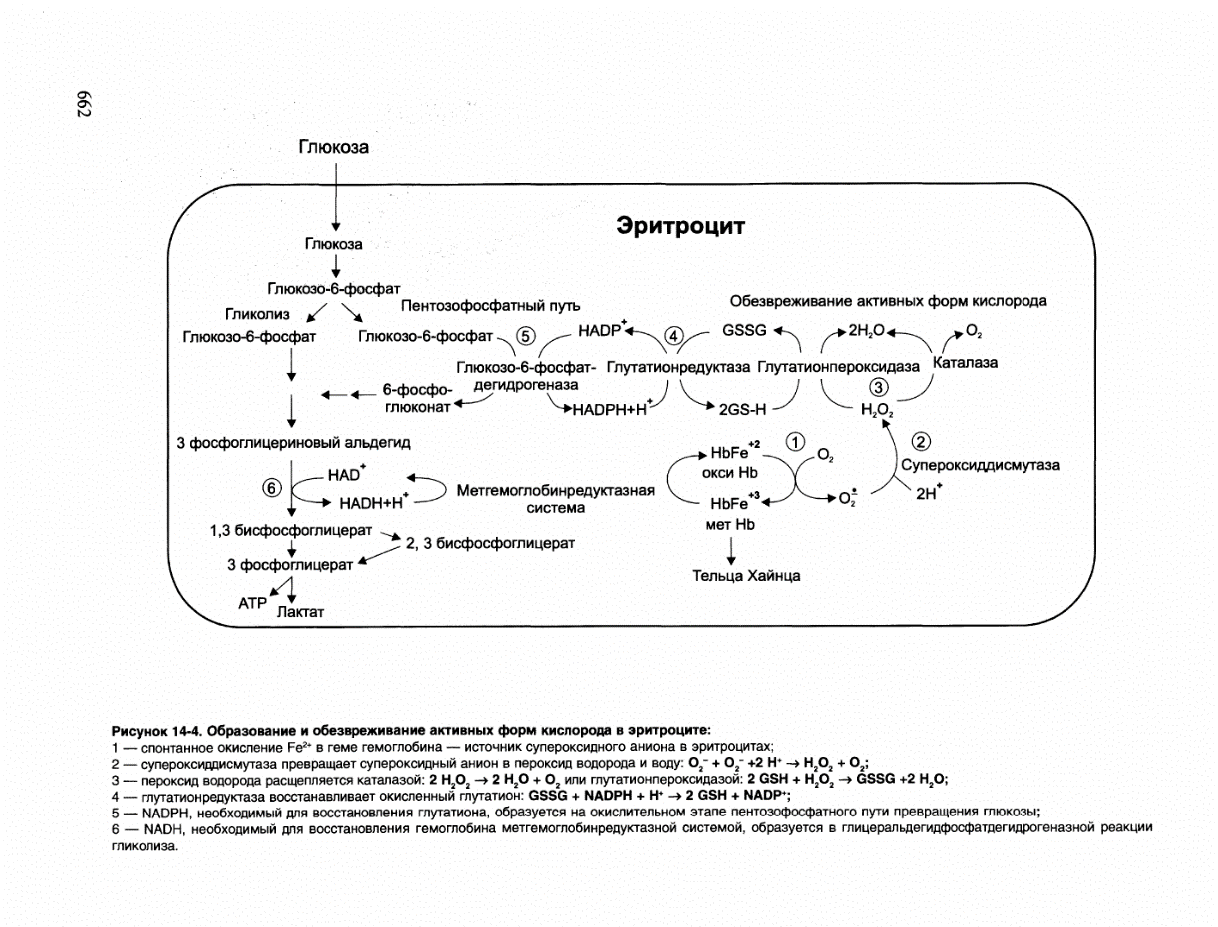
В. Обезвреживание активных форм кислорода в эритроцитах
Большое содержание кислорода в эритроцитах определяет высокую скорость образования супероксидного анион-радикала (O2-),пероксида водорода (Н2O2) и гидроксил радикала (ОН•). Эритроциты содержат ферментативную систему, предотвращающую токсическое действие активных форм кислорода и разрушение мембран эритроцитов (рис. 14-4). Постоянный источник активных форм кислорода в эритроцитах — неферментативное окисление гемоглобина в метгемоглобин:
В течение суток до 3% гемоглобина может окисляться в метгемоглобин. Однако постоян но метгемоглобинредуктазная система восстанавливает метгемоглобин в гемоглобин. Метгемоглобинредуктазная система состоит из цитохрома b5 и флавопротеина цитохром b5 редуктазы, донором водорода для которой служит NАDН, образующийся в глицеральдегиддегидрогеназной реакции гликолиза.
Роль глутатиона.
Глутатион играет важную роль в антиоксидантной защите не только при гипоксических, но и гипероксических состояниях, ограничивающих свободнорадикальное окисление. Глутатион обеспечивает формирование антиоксидантного потенциала в эритроцитах, кроветворных клетках, поддерживает пул восстановительного аскорбата.
7. Белки плазмы крови .Их роль. Изменение белкового состава крови при некоторых патологических состояниях.
В плазме крови содержится 7% всех белков организма при концентрации 60 — 80 г/л. Одна из их функций заключается в поддержании осмотического давления.
РОЛЬ:
✵ Белки плазмы образуют важнейшую буферную систему крови и поддерживают pH крови в пределах 7,37 — 7,43.
✵ Альбумин, транстиретин, транскортин, трансферрин и некоторые другие белки (табл. 14-2) выполняют транспортную функцию.
✵ Белки плазмы определяют вязкость крови и, следовательно, играют важную роль в гемодинамике кровеносной системы.
✵ Белки плазмы крови являются резервом аминокислот для организма.
✵ Иммуноглобулины, белки свёртывающей системы крови, α1-антитрипсин и белки системы комплемента осуществляют защитную функцию.
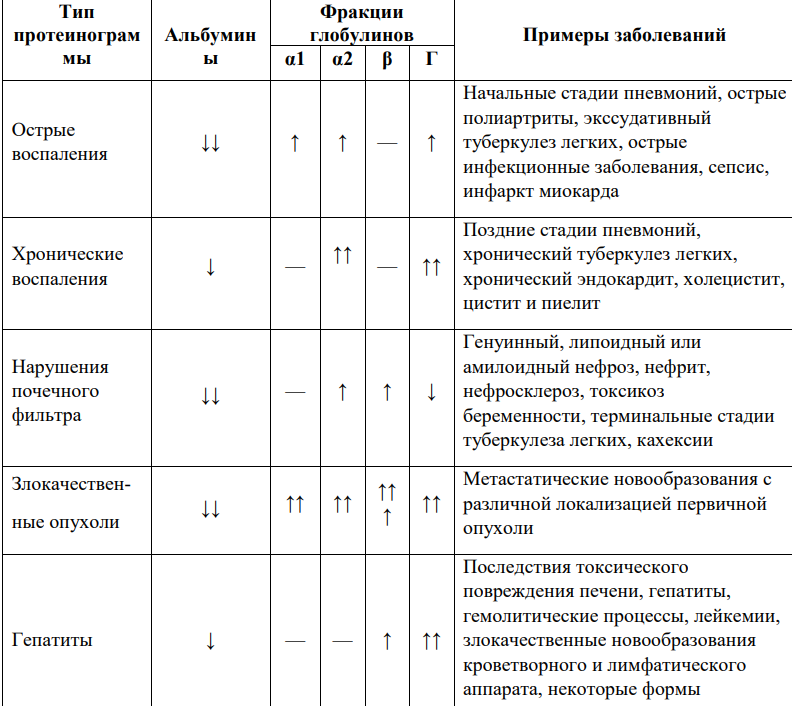
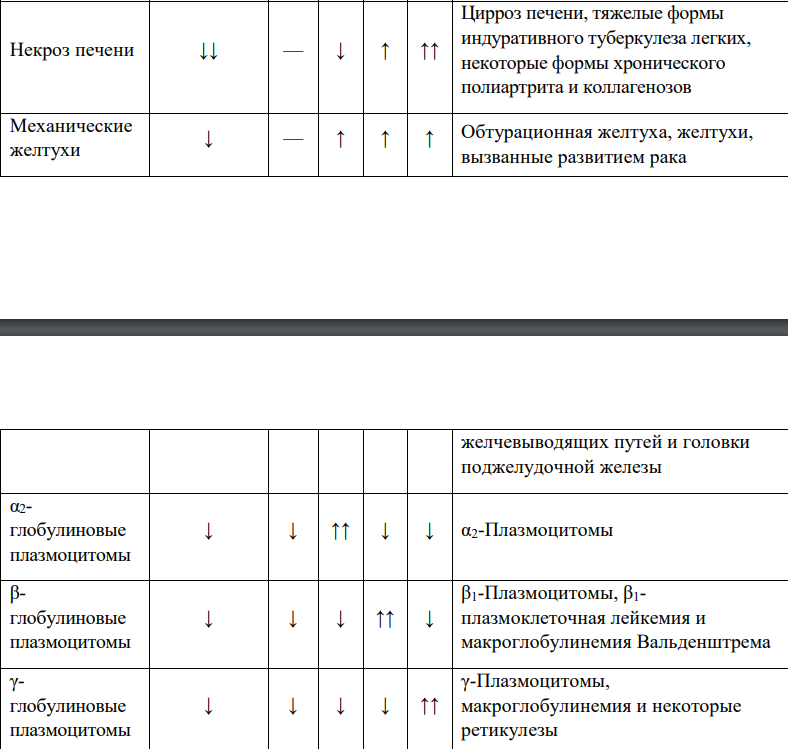
Методом электрофореза на ацетилцеллюлозе или геле агарозы белки плазмы крови можно разделить на альбумины (55 — 65%), α1-глобулины (2 — 4%), α2-глобулины (6 — 12%), β-глобулины (8 — 12%) и н-глобулины (12 — 22%) (рис. 14-19).
ЗАБОЛЕВАНИЯ ( ИЗМЕНЕНИЯ)
8. Важнейшие буферные системы крови. Их состав и механизм действия. Ацидоз и алкалоз.
Кровь имеет слабощелочную среду: рН артериальной крови = 7,4; рН венозной(большого содержания в ней h2co3)= 7,35.
Постоянство рН крови поддерживается буферными системами: гемоглобиновой, карбонатной, фосфатной и белками плазмы.
•Буферная система гемоглобина самая мощная. На ее долю приходится 75% буферной емкости крови. Эта система состоит из восстановленного гемоглобина (ННb) и его калиевой соли (КНb). Буферные свойства ее обусловлены тем, что при избытке Н+КНb отдает ионы К+, а сам присоединяет Н+ и становится очень слабо диссоциирующей кислотой. В тканях система гемоглобина крови выполняет функцию щелочи, предотвращая закисление крови вследствие поступления в нее углекислого газа и Н+ -ионов. В легких гемоглобин ведет себя как кислота, предотвращая защелачивание крови после выделения из нее углекислоты.
•Карбонатная буферная система (Н2СО3 и NaHC03) по своей мощности занимает второе место после системы гемоглобина. Она функционирует следующим образом: NaHCO3 диссоциирует на ионы Na+ и НС03-. При поступлении в кровь более сильной кислоты, чем угольная, происходит реакция обмена ионами Na+ с образованием слабо диссоциирующей и легко растворимой Н2СО3 Таким образом, предотвращается повышение концентрации Н+-ионов в крови. Увеличение в крови содержания угольной кислоты приводит к ее распаду (под влиянием особого фермента — карбоангидразы) на воду и углекислый газ. Последний поступает в легкие и выделяется в окружающую среду. В результате этих процессов поступление кислоты в кровь приводит лишь к небольшому временному повышению содержания нейтральной соли без сдвига рН. В случае поступления в кровь щелочи, она реагирует с угольной кислотой, образуя гидрокарбонат (NaHC03) и воду. Возникающий при этом дефицит угольной кислоты немедленно компенсируется уменьшением выделения углекислого газа легкими.
•Фосфатная буферная система образована дигидрофосфатом (NaH2P04) и гидрофосфатом (Na2HP04) натрия. Первое соединение слабо диссоциирует и ведет себя как слабая кислота. Второе соединение обладает щелочными свойствами. При введении в кровь более сильной кислоты она реагирует Na2HP04, образуя нейтральную соль и увеличивая количество мало диссоциирующего дигидрофосфата натрия. В случае введения в кровь сильной щелочи она взаимодействует с дигидрофосфатом натрия, образуя слабощелочной гидрофосфат натрия; рН крови при этом изменяется незначительно. В обоих случаях избыток дигидрофосфата и гидрофосфата натрия выделяется с мочой.
•Белки плазмы играют роль буферной системы благодаря своим амфотерным свойствам. В кислой среде они ведут себя как щелочи, связывая кислоты. В щелочной среде белки реагируют как кислоты, связывающие щелочи.
При различных патологических состояниях может наблюдаться сдвиг рН как в кислую, так и в щелочную среду. Первый из них носит название ацидоз, второй — алкалоз.
9. Ферменты сыворотки крови: секреторные, индикаторные, экскреторные. Определение их активности в диагностике различных заболеваний (изоферменты лактатдегидрогеназы и аминотрансферазы).
Ферменты сыворотки крови делятся на 3 группы: секреторные, индикаторные и экскреторные.
•Секреторные ферменты-собственные ферменты плазмы, синтезируясь в печени, в норме выделяются в плазму крови, где играют определенную физиологическую роль. Типичными представителями данной группы являются ферменты, участвующие в процессе свертывания крови, сывороточная холинэстераза,липопротеинлипаза.
•Индикаторные (клеточные) ферменты попадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Один из них находится главным образом в цитозоле клетки (ЛДГ, альдолаза), другие – в митохондриях (глутаматдегидрогеназа), третьи – в лизосомах (β-глюкуронидаза, кислая фосфатаза).
•Экскреторные ферменты- они попадают в плазму из экзокринных желез. Синтезируются главным образом в печени (щелочная фосфатаза). В физиологических условиях эти ферменты в основном выделяются с желчью.
Гипоферментемия встречается относительно редко, и касается в основном секреторных ферментов. В большинстве случаев она обусловлена генетическими нарушениями синтеза ферментов или их ингибированием, усиленной деградацией и экскрецией.
Дисферментемия связана в основном с появлением органо-специфичных ферментов в крови.
Гиперферментемия свидетельствует о некрозе или лизисе клеток,либо о нарушении проницаемости клеточных мембран при гипоксии,воздействии токсинов, бактерий, вирусов, действии лекарств и других ксенобиотиков.
Ферменты применяются в клинике в нескольких направлениях
1.Как химические реагенты при проведении клинико-диагностических методик. Например, фермент глюкозооксидаза используется для определения количества глюкозы в крови
2. Определение активности ферментов с целью диагностики функционального состояния органа или степени его поражения. (Активность ферментов в крови зависит от процессов синтеза и распада ферментов в ткани, состояния проницаемости мембран,скорости инактивации ферментов и их утилизации. Патологические процессы в органах вызывают деструктивные изменения мембран,нарушение их проницаемости. В результате ферменты поступают в плазму в повышенном количестве, что сопровождается повышением активности этих ферментов.)
В настоящее время в лабораторной диагностике заболеваний используются следующие ферменты

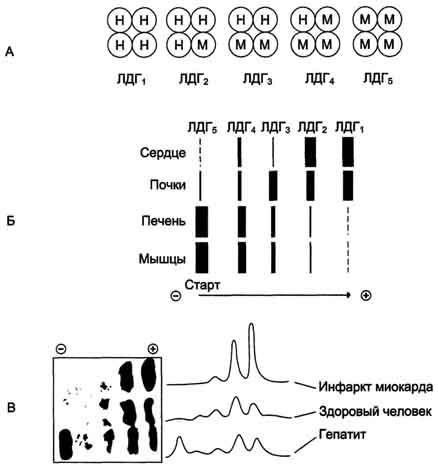
Лактатдегидрогеназа (ЛДГ).– фермент, катализирующий обратимую реакцию окисления лактата до пирувата.
Олигомерны белок, состоящий из 4 субъединиц 2 типов: H- heart, M-muscle.
Изоферменты: ЛДГ 1 и 2 локализуются в сердце, ЛДГ 3 и 4 локализуются в легких, ЛДГ 5 локализуется в печени.
Появление различных изоформ обусловлено особенностями окислительного метаболизма тканей. ЛДГ 4 и 5 – эффективно работают в анаэробных условиях, ЛДГ 1 и 2 – в аэробных.
Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме методом электрофореза.
Повышение уровня ЛДГ в крови может свидетельствовать о патологиях: сердечно-сосудистые заболевания,заболевания печени,анемии,онкологические заболевания.
Диагностическая значимость при ИМ: При ОИМ уровень возрастает быстро на 2–4 сутки, и нормализуется только на 2–3 неделе.
Аланинаминотрансфераза (АлАТ), аспартатаминотрансфераза (АсАТ).
Аминотрансферазы печени (АлАТ в большей степени), мышц, миокарда.
Уровень аминотрансфераз в крови повышается при повреждении печени и миокарда.
В норме соотношение активностей АСТ/АЛТ (коэффициент де Ритиса) равно 1,33±0,42.
При остром ИМ это соотношение резко повышается. Повышение АСТ в сыворотке крови наблюдается при ИМ через 6–12 часов от начала заболевания. Максимальное возрастание отмечается на 2–4 сутки, и на 5–7 сутки уровень фермента приходит к норме.
10) Небелковые азотистые компоненты плазмы крови. Остаточный азот. Азотемии(причины развития и последствия). Гипераммониемия причины развития и последствия.
Содержание небелкового азота в цельной крови и плазме почти одинаково и составляет в крови 15—25 ммоль/л.
Небелковый азот крови включает азот мочевивы (50 % от общего количества небелкового азота), аминокислот (25 %), мочевой кислоты (4 %), креатина (5 %), креатинина (2,5 %), аммиака и индикана (0,5 %) и других небелковых веществ, содержащих азот (полипептиды, нуклеотиды, нуклеозиды, глутатион, билирубин, холин, гистамин и др.). Таким образом, в состав небелкового азота входит главным образом азот конечных продуктов обмена простых и сложных белков.
**Белковый азот – это азот аминокислот, из которых состоит белок. Определяется по разнице между общим и остаточным азотом.
Остаточный азот (небелковый) – это азотистые соединения (мочевина, азот свободных аминокислот, креатинин, креатин, мочевая кислота и др.), за исключением азота белковой фракции.
**Общий азот – это азот всех азотсодержащих веществ.
Азотемия - повышение уровня небелкового азота в крови. Азотемию подразделяют на • ретенционную • и продукционную (преренальная).
Ретенционная азотемия развивается в результате недостаточного выделения с мочой азотсодержащих продуктов при нормальном поступления их в кровяное русло. Она в свою очередь может быть почечной и внепочечной.
При почечной ретенционной азотемии концентрация остаточного азота в крови увеличивается вследствие ослабления очистительной (экскреторной) функции почек.
Резкое повышение содержания остаточного азота происходит в основном за счет мочевины. В этих случаях на долю азота мочевины приходится 90 % небелкового азота крови вместо 50 % в норме.
Внепочечная ретенционная азотемия может возникнуть в результате тяжелой недостаточности кровообращения, снижения артериального давления и уменьшения почечного кровотока. Нередко внепочечная ретенционная азотемия является результатом наличия препятствия оттоку мочи после ее образования в почке.
Продукционная (преренальная) азотемия развивается при избыточном поступлении азотсодержащих продуктов в кровь, как следствие усиленного распада тканевых белков при обширных воспалениях, ранениях, ожогах, кахексии и др. Нередко наблюдаются азотемии смешанного типа.
Гипераммониемия
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови — гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла
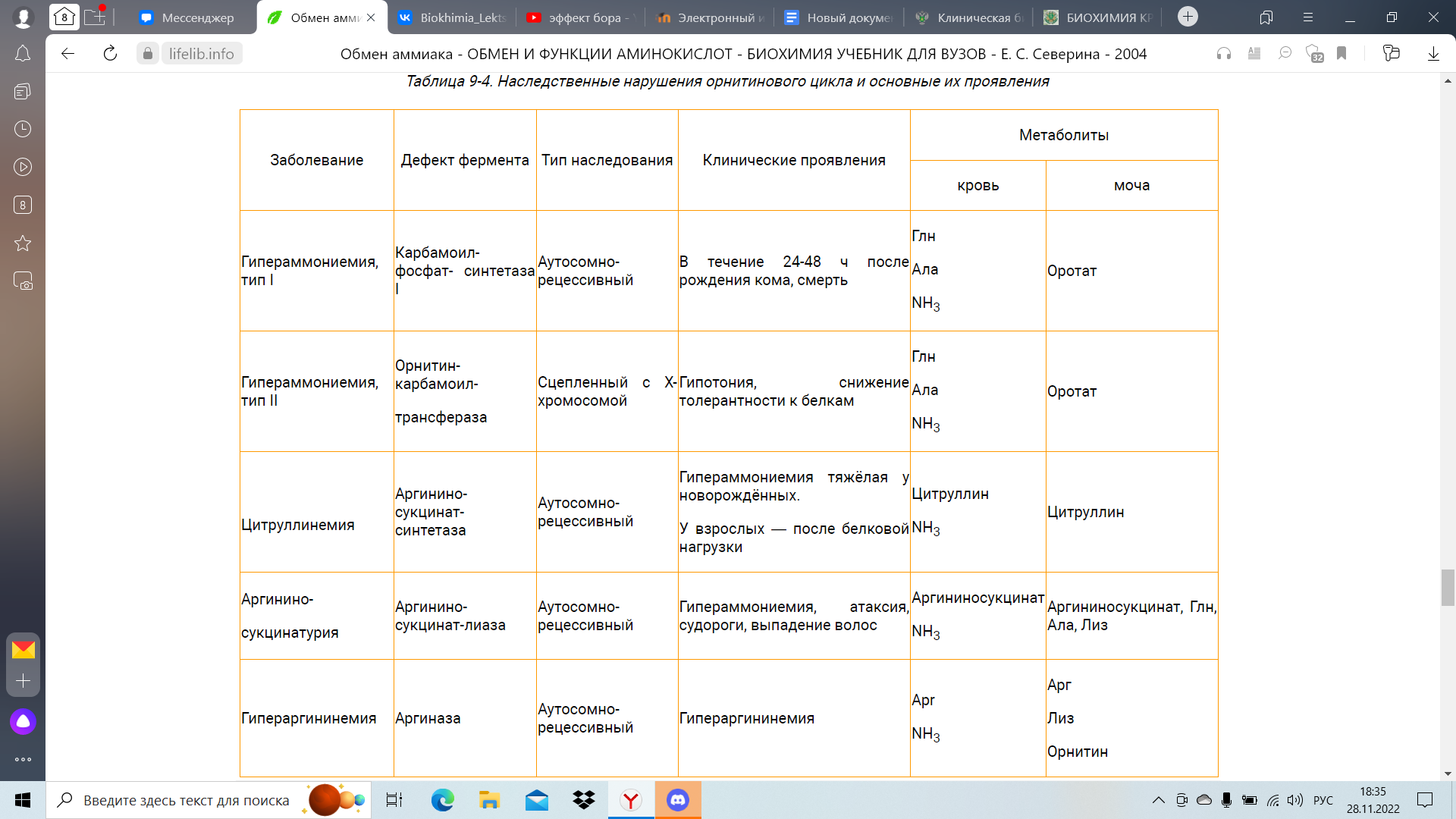
больше всего случаев гипераммониемии II типа.!!!
При гипераммониемиях I и II типа вследствие дефекта орнитинкарбамоилтрансферазы происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пиримидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой. Содержание всех метаболитов повышается, и состояние больных ухудшается при увеличении количества белков в пище. Тяжесть течения заболевания зависит также от степени снижения активности ферментов.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина.
Гипераммониемия сопровождается появлением следующих симптомов:
тошнота, повторяющаяся рвота;
головокружение, судороги;
потеря сознания, отёк мозга (в тяжёлых случаях);
отставание умственного развития (при хронической врождённой форме).
Все симптомы гипераммониемии — проявление действия аммиака на ЦНС
Для диагностики различных типов гипераммониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активности фермента в биоптатах печени.
Основной диагностический признак — повышение концентрации аммиака в крови. Содержание аммиака в крови может достигать 6000 мкмоль/л (в норме — 60 мкмоль/л). Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложнённых заболеваний.
Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов аминокислот в рацион и стимуляцию выведения аммиака в обход нарушенных реакций:
путём связывания и выведения NН3 в составе фенилацетилглутамина и гиппуровой кислоты;
повышением концентрации промежуточных метаболитов цикла (аргинина, цитруллина, глутамата), образующихся вне блокируемых реакций

Рис. 9-19. Пути выведения аммиака при включении в диету глутамата и фенилацетата (А), бензоата (Б), цитруллина и аргинина (В). На рисунке обозначены ферментные блоки: 1 — дефект карбамоилфосфатсинтетазы I; 2 — дефект орнитинкарбамоилтрансферазы; 3 — дефект аргининосукцинатлиазы.
Вводимый больным с дефектом карбамоил- фосфатсинтетазы I в качестве пищевой добавки фенилацетат в результате его конъюгации с глутамином образует фенилацетилглутамин, который экскретируется почками. Состояние больных при этом улучшается, так как происходит активация синтеза глутамина и снижение концентрации аммиака в крови (рис. 9-19, А).
Аналогичное действие оказывает введение бензоата, который связывает молекулу глицина. Образующаяся гиппуровая кислота выводится с мочой (рис. 9-19, Б). В составе гиппурата происходит выделение азота из организма. Недостаток глицина компенсируется либо путём синтеза его из серина, либо за счёт образования из NH3 и СO2 в реакции, катализируемой глицинсинтетазой. При этом образование глицина сопровождается связыванием одной молекулы аммиака.
При гипераммониемии II типа (дефект орнитинкарбамоилтрансферазы) введение больших доз цитруллина стимулирует синтез мочевины из аспартата (рис. 9-19, В), что также приводит к выведению азота из организма. Введение больших доз аргинина при аргининосукцинатурии (дефект аргининосукцинатлиазы) стимулирует регенерацию орнитина и выведение азота в составе цитруллина и аргининосукцината.
11) Безазотистые органические компоненты крови. Типы гиперлипопротеинемий. Гликемии, кетонемии и липидемии(причины и последствия)
Безазотистые компоненты крови:
• углеводы,
• липиды,
• органические кислоты
• и некоторые другие вещества.
Гиперлипопротеинемии – это повышение содержания липопротеинов в плазме крови выше нормы
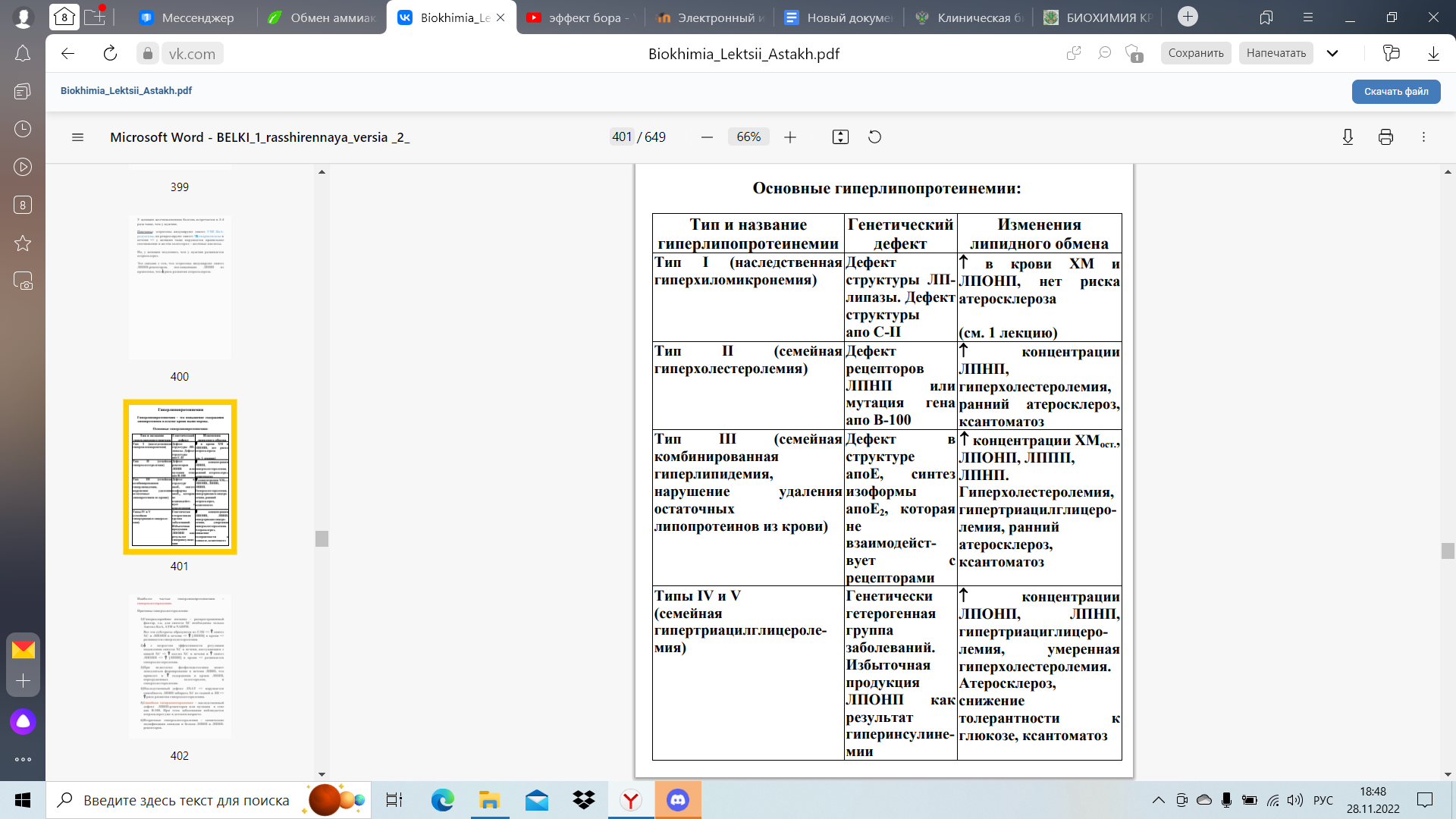
Наиболее частые гиперлипопротеинемии – гиперхолестеролемии
Гликемия — это медицинский термин, обозначающий уровень содержания глюкозы в крови. В норме гликемия должна поддерживаться на уровне 3,3-6,0 ммоль/л с незначительными колебаниями, связанными с естественными физиологическими процессами
Гипергликемию отмечают при • сахарном диабете, • лечении глюкокортикоидами, • лихорадке, • возбуждении животных, • ложная - при гемолизе.
Гипогликемия наблюдается при: • болезнях печени, • при гликогенной болезни, • гипокортицизме, • опухолях островковых клеток поджелудочной железы, • передозировке противодиабетических препаратов, • голодании, • при поражении почек.
Кетонемия - повышенное содержание в крови кетоновых тел. Возникает такое состояние при тяжёлой форме сахарного диабета или голодании.
При длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца и почек. Таким образом глюкоза сохраняется для окисления в мозге и эритроцитах. Уже через 2-3 дня после начала голодания концентрация кетоновых тел в крови достаточна для того, чтобы они проходили в клетки мозга и окислялись, снижая его потребности в глюкозе.
В норме концентрация кетоновых тел в крови составляет 1 — 3 мг/дл (до 0,2 мМ/л), но при голодании значительно увеличивается. Увеличение концентрации кетоновых тел в крови называют кетонемией, выделение кетоновых тел с мочой — кетонурией. Накопление кетоновых тел в организме приводит к кетоацидозу: уменьшению щелочного резерва (компенсированному ацидозу), а в тяжёлых случаях — к сдвигу pH (некомпенсированному ацидозу), так как кетоновые тела (кроме ацетона) являются водорастворимыми органическими кислотами (рК3,5), способными к диссоциации:
СН3-СО-СН2-СООН <-> СН3-СО-СН2-СОО- + H+.
Ацидоз достигает опасных величин при сахарном диабете, так как концентрация кетоновых тел при этом заболевании может доходить до 400 — 500 мг/дл. Тяжёлая форма ацидоза — одна из основных причин смерти при сахарном диабете. Накопление протонов в крови нарушает связывание кислорода гемоглобином, влияет на ионизацию функциональных групп белков, нарушая их конформацию и функцию.
Дислипидемия – это нарушение уровня липидов в крови, которое часто приводит к атеросклерозу. Патология возникает на фоне повышения холестерина в организме и диагностируется, в зависимости от страны, у каждого второго – каждого пятнадцатого человека. Обнаружить болезнь можно с помощью липидограммы.
Симптомы
При дислипидемии заметны такие внешние проявления:
ксантомы – узелки с холестерином над сухожилиями, чаще всего на кисти;
ксантелазмы – отложения под кожей век;
липоидная дуга роговицы – ободок серовато-белого цвета по краям роговицы глаза.
Причины
Наследственность.
Гипотиреоз – нарушение функций щитовидной железы.
Сахарный диабет.
Обструктивные заболевания печени.
Прием мочегонных, иммунодепрессантов и других лекарственных препаратов.
Повышенное содержание в пище животных жиров.
Диагностика дислипидемии
На первичном приеме врач анализирует состояние пациента и его жалобы, выясняет анамнез личный и семейный, проводит физикальный осмотр на предмет наличия ксантом, ксантелазм и липоидной дуги роговицы. Для уточнения диагноза назначают:
анализ крови и мочи – чтобы определить наличие воспалительного процесса;
биохимический анализ крови;
липидограмму;
иммунологический анализ крови;
генетический анализ – при необходимости.
Немедикаментозное лечение
Пациенту важно нормализовать массу тела. С этой целью ему назначают дозированные физические нагрузки и диету с ограничением животных жиров. Рацион необходимо обогатить витаминами и пищевыми волокнами, отдать предпочтение овощам и фруктам. Обязателен отказ от алкоголя и курения, иначе другие действия будут бессмысленны