Отчет по практической работе. Типовые химические расчеты. Расчет концентрации и ph раствора сильной кислоты. Отчет по практической работе. Типовые химические расчеты. Расчет. Практическая работа Типовые химические расчеты. Расчет концентраций и pH раствора сильной кислоты. Вариант 1 (соляная кислота hcl)
 Скачать 153.44 Kb. Скачать 153.44 Kb.
|
|
Практическая работа № 9. Типовые химические расчеты. Расчет концентраций и pH раствора сильной кислоты. Вариант 1 (соляная кислота HCl). Цель работы. Использование математических функций пакета Scilab, а также инструментария электронных таблиц MS Excel (относительные и абсолютные ссылки, средства форматирования текстовых и числовых значений в ячейках таблицы, средства построения и форматирования диаграмм и рядов данных) на примере типовых химических расчетов (пересчет концентраций растворов в различных единицах измерений и построение графика изменения pH раствора). Задание Дано: Молярная масса и таблица значений плотности растворов сильной одноосновной кислоты при разных процентных концентрациях раствора. Найти: • массовую концентрацию кислоты в растворах в г/л; • молярную концентрацию кислоты в растворах в моль/л; • pH растворов. Построить график изменения pH в зависимости от процентной концентрации раствора. Исследовать изменение результатов расчетов при изменении объема раствора. Теоретические основы. Объект исследования: сильная одноосновная кислота. Изменяемая величина: процентная концентрация раствора. Результирующая величина: pH раствора Расчетные формулы 1) pH раствора сильной одноосновной кислоты (результирующая величина) pH = - log10 (C); 2) Молярная концентрация вещества C = n / V (V – объем раствора); 3) Количество вещества n = mв-ва / M (М – молярная масса кислоты, справочная величина); 4) Масса вещества в растворе mв-ва = P*mр-ра (P - процентная концентрация раствора, изменяемая величина); 5) Масса раствора mр-ра = R*V (R – плотность, справочная величина). Справочные величины: — Плотность R. Зависит от процентной концентрации раствора P; — Молярная масса кислоты. Параметр: — Объем раствора V. Ход работы. 1. Создание структуры электронной таблицы для расчета концентраций и pH растворенного вещества. 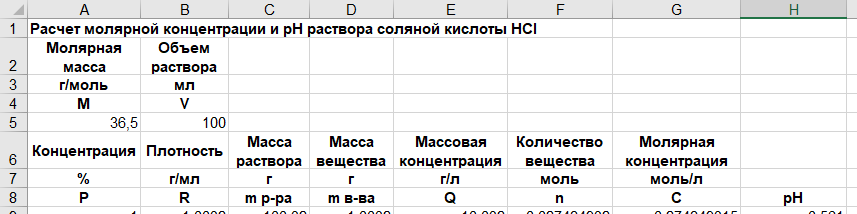 Рис. 1. Структура таблицы для расчета концентрации и pH растворенного вещества 2. Расчет массы раствора, массы вещества, массовой концентрации, количества вещества, молярной концентрации и значение pH по следующим формулам: С9 = B9*$B$5 D9 = A9*C9/100 E9 = D9/$B$5*1000 F9 = D9/$A$5 G9 = F9/$B$5*1000 H9 = -LOG10(G9) Значения pH в столбце H были отформатированы так, чтобы они имели ровно 3 знака после запятой, а все отрицательные числа были красными. 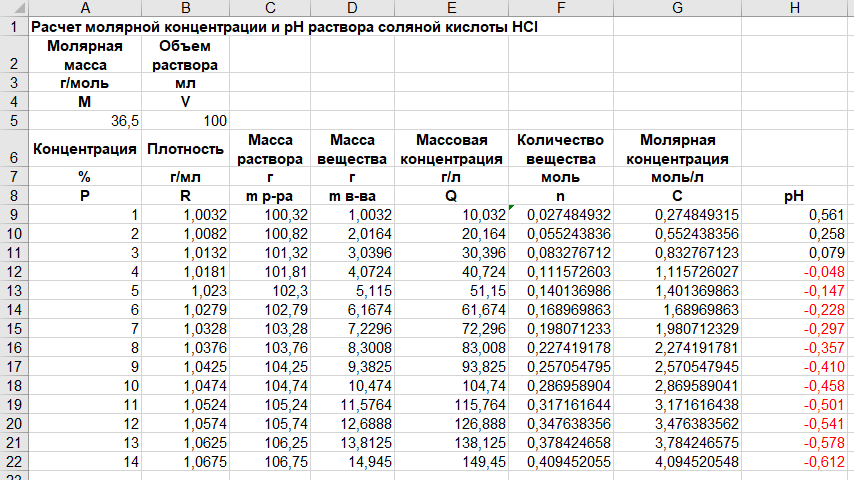 Рис. 2. Расчетная таблица 3. Построение графика изменения pH в зависимости от процентной концентрации раствора. Через пункт Формат оси были установлены минимальные и максимальные значения для оси Y. 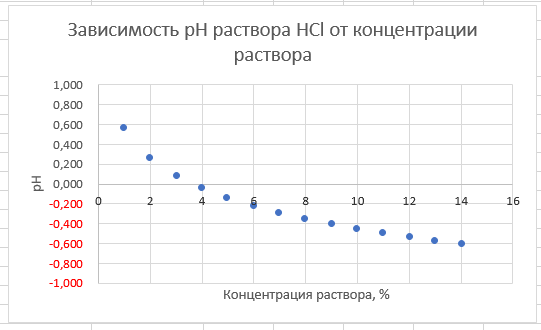 Рис. 3.1. График изменения pH в зависимости от процентной концентрации раствора 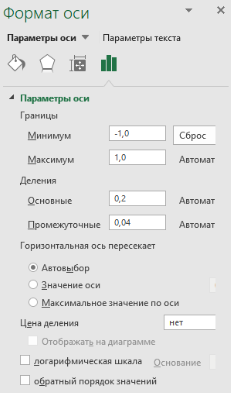 Рис. 3.2. Установка значения минимума и максимума для оси Y 4. Исследование изменение результатов расчетов при изменении объема раствора. Результаты расчета при V = 100 мл:
Результаты расчета при V = 50 мл:
При изменении параметра расчета V (объема раствора) происходит изменение величин массы раствора mр-ра, массы вещества в растворе mв-ва и количества вещества. Величины массовой концентрации вещества Q, мольной концентрации C и pH не изменяются при любых значениях объема раствора. При возрастании процентной концентрации раствора pH раствора уменьшается. 5. Написание программы для расчета концентраций растворенного вещества. Использование функции disp для отображения результатов в виде таблицы, функции plot2d для визуализации расчетов и функции xtitle для наименования графика и его осей. 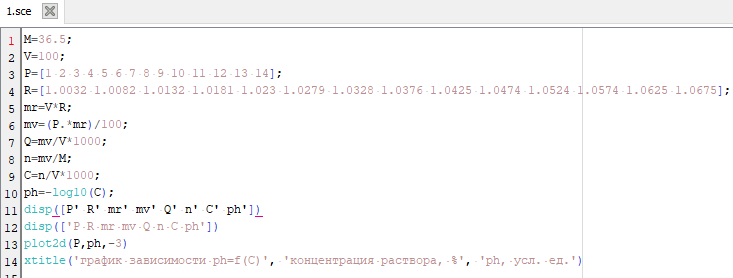 Рис. 4. Программа для расчета концентраций и pH растворенного вещества 6. Результаты выполнения программы. 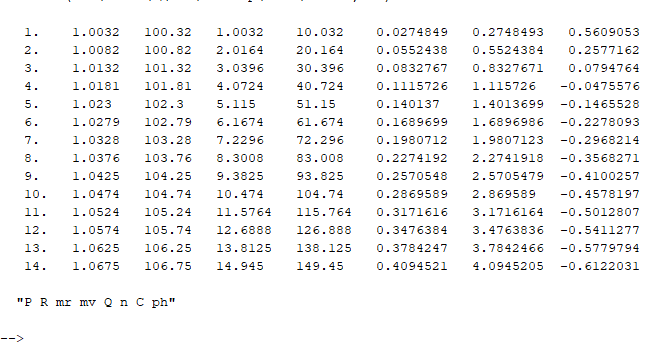 Рис. 5.1. Таблица для расчета концентраций и pH растворенного вещества 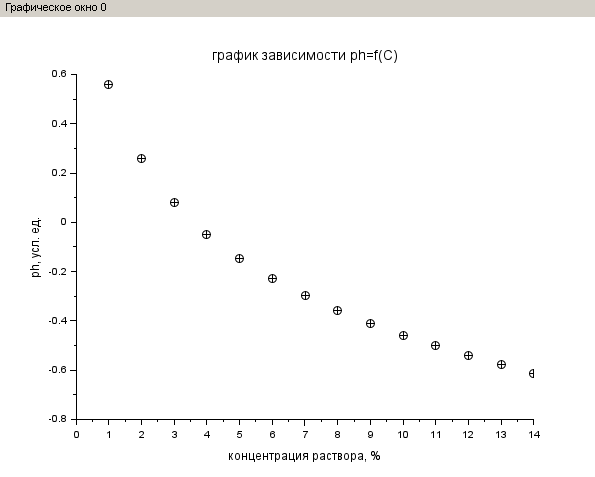 Рис. 5.2. График зависимости pH=f(C) 7. Анализ результатов расчетов. Качественный анализ: — При увеличении процентной концентрации раствора pH раствора уменьшается. Количественный анализ: — pH раствора азотной кислоты изменяется в пределах от 1 до -1. Содержательный анализ: — Может ли pH быть отрицательным? Да, для концентрированных растворов! pH = - log10 (C) Результат. Найдены: массовая концентрация кислоты в растворах, молярная концентрация кислоты в растворах и pH растворов. Построен график изменения pH в зависимости от процентной концентрации раствора. Исследовано изменение результатов расчетов при изменении объема раствора. |
