Глава 1 - общ.. 1. состав и внутренняя структура горных пород горные породы как объект разработки
 Скачать 236.5 Kb. Скачать 236.5 Kb.
|
|
1. СОСТАВ И ВНУТРЕННЯЯ СТРУКТУРА ГОРНЫХ ПОРОД 1.1. Горные породы как объект разработки Под горными породами понимают природные образования - агрегат минералов, слагающие самостоятельные геологические тела. В контексте данной дисциплины под общим наименованием горной породы будем понимать как вмещающие породы, так и полезные ископаемые (угольные пласты, рудные тела и пр.). С точки зрения геотехнологии главный объект изучения представляют свойства горных пород как объекта разработки. Свойства пород определяются их генезисом, составом и строением. По генезису (происхождению) горные породы разделяют на магматические, осадочные и метаморфические. Магматические породы образуются в результате остывания и кристаллизации природных расплавов – магмы. В зависимости от условий, в которых происходила кристаллизация, различают интрузивные (затвердевшие на глубине) и эффузивные (излившиеся на поверхность земли) горные породы. Эти условия во многом определяют свойства пород. Так, при кристаллизации на глубине (интрузивные породы типа гранитов, диоритов, габбро) при температурах порядка 700 – 1100 ОС и достаточно медленном остывании образуются достаточно крупные кристаллы, между которыми остаются включения газообразных и жидких компонентов магмы. Напротив, при затвердевании на поверхности (эффузивные породы типа диабазов, базальтов) температура и давление снижаются чрезвычайно быстро, и только часть расплава успевает выделиться в виде крупных кристаллов. Большая часть излившейся магмы (которая в этом случае называется лавой) выделяется в виде мельчайших кристаллов – микролитов или аморфного вулканического стекла. Кроме того, большая часть газообразных компонентов лавы вбрасывается в атмосферу, что приводит к низкой пористости эффузивных пород. Осадочные горные породы образовались при осаждении, переносе и накоплении в водной или воздушной среде органических материалов (известняки, мел, уголь и др.) или продуктов физического или химического выветривания исходных пород (аргиллиты, алевролиты, брекчии и др.). Характерным признаком осадочных пород является их слоистость. Метаморфические горные породы (мрамор, кварциты, сланцы и др.) образовались за счет переработки в недрах Земли уже сформировавшихся ранее пород за счет высокого давления, температуры, минерализованных растворов и газов. Эти условия могли образоваться при опускании участков массива при горообразовательных процессах (региональный метаморфизм) или при контакте с движущимся расплавом, например, при извержении вулканов (контактовый метаморфизм). В зависимости от этого метаморфические породы могут образовывать большие массивы или наблюдаться в виде пропластков и линз. Минеральным составом называется относительное объемное содержание в породе различных минералов.В широком смысле под минералом понимают любое природное устойчивое химическое соединение. Горная порода, в общем случае, состоит из кристаллических зерен или их обломков, цементирующего эти зерна материала и пор. В порах может находиться газ или жидкость. Все эти компоненты можно рассматривать как минералы (твердые, жидкие и газообразные). Минеральный состав изучается в тонких срезах образцов пород (шлифах) под микроскопом. В настоящее время известно более 3000 различных минералов, и число их непрерывно пополняется. Однако практическое значение имеют не более 20-30 минералов, называемых породообразующими. К их числу относятся минералы группы кварца (кварц, кремень, халцедон и др.), силикаты (полевые шпаты, амфиболы, пироксены, слюды и др.), карбонаты (кальцит, доломит и др.). В качестве цементирующего материала в горных породах часто присутствуют глинистые минералы, гипс и др. Свойства пород во многом зависят от соотношения указанных минералов. Так преобладание минералов группы кварца с кремнистым цементом обусловливает повышенную прочность пород. Напротив, при любом типе минеральных зерен, но глинистом цементе прочность пород будет невелика. Строение горных пород может быть выражено в единстве двух понятий - структуры и текстуры. Под структурой понимают особенности строения горной породы, обусловленные размером и формой, образующих породу минеральных зерен. Основные типы структур - кристаллическая, скрытокристаллическая, аморфная, порфировая, обломочная. При одинаковом минеральном составе с увеличением крупности зерен прочность пород, как правило, снижается. Текстура характеризует взаимное пространственное расположение минеральных зерен. При решении технологических задач обычно выделяют: массивную, пористую, слоистую текстуры. Структура и текстура пород являются качественными (диагностическими) признаками. Совместно с минеральным составом они определяют петрографическое наименование породы. Напротив, название породы дает общее представление о ее минеральном составе и строении.Однако в силу чрезвычайно большого многообразия реальных горных пород, судить об их свойствах, основываясь только на названии породы, практически невозможно. Поэтому в принципе невозможно создать исчерпывающего справочника свойств горных пород. Каждый раз для конкретной породы необходимо непосредственное определение ее характеристик. Для знакомства с методами определения свойств горных пород предусмотрен цикл лабораторных работ. Горная порода является сложным многокомпонентным телом. По степени неоднородности состава и строения, а также изменчивости свойств горные породы не имеют аналогов среди других, используемых человеком материалов. Кроме того, слагаемые горными породами массивы, как правило, имеют развитую систему трещиноватости, тектонические нарушения, слоистое строение. Все это определяет существенную (десятки процентов) вариацию свойств горной породы даже в одной пробе. В этой связи единичный акт измерения какого-либо показателя не дает возможность достоверно оценить величину свойства породы. Объективная информация может быть получена только тогда, когда установлен вероятностный закон распределения конкретного показателя. Большинство свойств горных пород характеризуется нормальным распределением (распределение Гаусса): 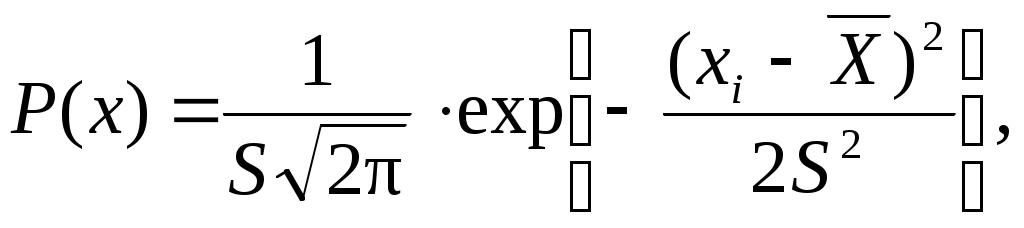 (1.1) (1.1)т. е. вероятность Р(х) появления данного значения хiнекоторого свойства зависит от среднего арифметического где n – число измерений. Таблица 1.1. Вариация свойств горных пород
Среднее квадратическое отклонение (стандарт) характеризует средний квадрат отклонений измеренных значений от среднего арифметического: Относительной мерой разброса данных является коэффициент вариации: Для эффузивных горных пород Урала средняя вариация свойств представлена в таблице 1.1. Графически результаты измерений какой-либо характеристики горных пород могут быть представлены в виде гистограммы или полигона распределения. Так, на рис. 1.1 представлено распределение скорости распространения упругой волны в диабазах Юбилейного месторождения. 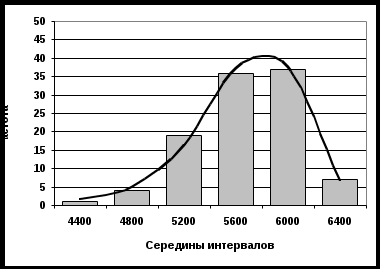 Рис. 1.1. Распределение скорости упругой волны в диабазах Здесь среднее значение скорости волны составляет 5800 м/с, однако результаты измерений по различным пробам изменялись с 4300 по 6500 м/с. В этих условиях среднее арифметическое может служить лишь как наиболее вероятное значение свойства. Для практических расчетов следует указать границы интервала, который с заданной надежностью P перекрывает истинное значение a. Такой интервал называется доверительным и в случае симметричного распределения данных определяется по формуле: где t(P,k) – коэффициент, определяемый распределением Стьюдента при k = n- 1 числе степеней свободы и принятой надежности P. Контрольные вопросы и упражнения 1. Как связаны состав и строение горных пород с их генезисом? 2. Что понимается под структурой и текстурой горных пород, и какие их типы можно выделить для горных пород? 3. Чем обусловлена изменчивость свойств горных пород? 4. Опишите статистические характеристики изменчивости свойств горных пород. 1.2. Классификация свойств горных пород Под свойством горной породы в общем случае понимают ее реакцию на внешнее воздействие. Такое воздействие осуществляется в различных процессах горной технологии. Существуют три основных способа воздействия на горную породу при ее добывании и переработке, соответствующие трем основным видам энергии - механической, термической и электромагнитной. Поэтому целесообразно выделить и три основных класса свойств. К этому следует добавить класс свойств, характеризующий поведение горной породы в гравитационном поле. Горные породы, содержащие радиоактивные элементы (уран, торий, радий) или радиоактивные изотопы таких элементов, как калий, кальций, вольфрам и др., характеризуются радиоактивными свойствами. Иногда этот класс свойств объединяют с электромагнитными свойствами, рассматривая их как реакцию горной породы на воздействие потоков микрочастиц или электромагнитных волн значительной жесткости (рентгеновские, гамма-лучи). Кроме того, горные породы характеризуются гидравлическими и газодинамическими свойствами, описывающими поведение породы при воздействии на нее жидкостей и газов. В целом, данные свойства можно отнести к классу механических, так как последний включает в себя все свойства, проявляющиеся при воздействии на породу любого вещественного поля. Особо следует выделить класс горно-технологических свойств, которые определяются не только составом и строением горных пород, но и параметрами технологии их разработки. Таким образом, структура классификации свойств горных пород может быть представлена в следующем виде (рис. 1.2). I. Плотностные - характеризуют поведение горной породы в гравитационном поле. II. Механические – включают следующие группы свойств: 1) упругие свойства – характеризуют взаимосвязь обратимых деформаций и напряжений в горных породах; 2) акустические свойства – описывают закономерности распространения в горных породах упругих волн; 3) прочностные свойства – характеризуют разрушаемость горных пород; 4) пластические свойства – оценивают взаимосвязь необратимых деформаций и напряжений в горных породах; 5) реологические свойства - изменение механических свойств пород во времени. 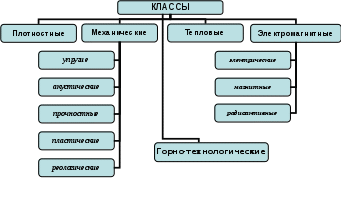 Рис. 1.2. Классификация свойств горных пород III. Тепловые - характеризуют поведение горных пород при нагреве и охлаждении, т. е. в тепловом поле. IV. Электромагнитные – подразделяют на группы: 1) электрические свойства – характеризуют закономерности поведения горных пород в электрическом поле; 2) магнитные свойства - поведение пород в магнитном поле; 3) радиоактивные - специфическое поведение горных пород, содержащих радиоактивные элементы или изотопы. V. Горно-технологические – характеризуют поведение горных пород при воздействии на них различных инструментов и технологических процессов. Следует отметить, что здесь приведена лишь самая общая структура классификации свойств горных пород. Полная классификация значительно более разветвленная. Кроме того, в различных областях горной практики существуют свои специфические классификации. Контрольные вопросы и упражнения 1. Какой принцип положен в основу классификации физических свойств горных пород? 2. Укажите классы физических свойств горных пород. 3. Какие группы характеристик включает класс механических свойств горных пород? 1.3. Строение кристаллов и анизотропия их свойств Минералы, слагающие горные породы, могут находиться в аморфном (обсидиан) или кристаллическом состоянии. Причем абсолютное большинство пород относятся к классу кристаллов. Основной особенностью кристаллов является геометрически правильное расположение частиц (атомов, ионов или молекул) в пространстве, образующее кристаллическую решетку. Геометрически кристаллическую решетку можно образовать параллельным переносом (трансляцией) некоторой элементарной ячейки. Элементарная ячейка представляет собой минимальный объем кристалла в виде параллелепипеда, который сохраняет все его свойства. Для характеристики элементарной ячейки задают шесть параметров: три величины образующих ее ребер – a, b, c и три угла между ними - , , . Все многообразие реального строения кристалла можно свести к комбинации 14 типов элементарных ячеек (так называемые решетки Браве) – см. рис. 1.3. Все 14 решеток Браве распределены по семи кристаллическим системам (сингониям) в соответствии с ориентацией и относительными величинами параметров решетки. Различают четыре типа элементарных ячеек: примитивная решетка – атомы расположены только в вершинах элементарных параллелепипедов; базоцентрированная – атомы в вершинах и в центрах двух противоположных граней; объемно-центрированная – атомы в вершинах и центре параллелепипедов; гранецентрированная – атомы в вершинах и в центре всех граней. Важнейшими характеристиками кристалла служат: координационное число – количество ближайших соседей данного атома, периоды решетки – расстояние между атомами; атомный радиус – половина расстояния между атомами. Параметры кристаллической решетки определяют методами рентгеноструктурного анализа, и все линейные размеры выражают обычно в ангстремах (1А=10-8см) или в нанометрах (1 нм = 10-9 см). 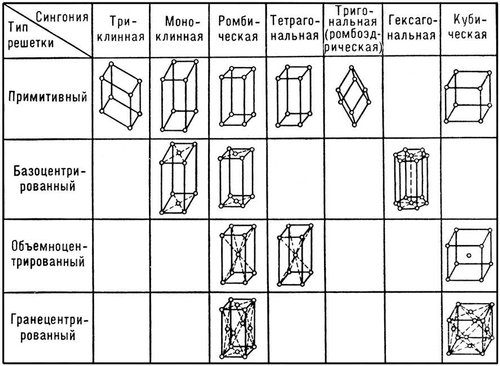 Рис. 1.3. Типы кристаллических решеток Кристаллы образуются при остывании расплава пород (магмы) до температуры кристаллизации. Кристаллизация начинается одновременно из нескольких центров, называемых зародышами. По мере развития кристаллизации возникает все больше таких центров, и процесс ускоряется, причем зарождающиеся кристаллы имеют геометрически правильную форму (монокристаллы). Однако по мере их развития, они сталкиваются и, срастаясь, образуют поликристаллическую структуру. Процесс замедляется, и кристаллы уже не имеют правильной формы. Интересно, что даже свободно выросшие кристаллы имеют причудливую, часто вытянутую форму с несколькими разветвлениями, образуя друзу. Это объясняется следующими обстоятельствами. Градиент температур, как правило, имеет направленный характер. В направлении отвода тепла кристалл растет быстрее, чем в других направлениях. Если на боковой грани растущего кристалла возникает какое-либо нарушение, образуется новый центр кристаллизации, и появляется возможность его роста в боковом направлении. В результате образуется древовидный кристалл (дендрит). Упорядоченное строение кристаллов определяет анизотропию их свойств, т. е. разницу в величине векторных характеристик кристалла, измеренных в разных направлениях. Действительно, если посмотреть на самые разные типы кристаллических решеток (рис. 1.3.1), то легко убедиться, что в любых произвольно выбранных направлениях расстояние между узлами решеток (атомами) будет различным. Следовательно, и силы взаимодействия между ними будут отличаться, что и определяет анизотропию свойств. Влияние такого строения на свойства кристаллов и минеральных образований ярко прослеживается на примере алмаза и графита, которые являются двумя различными кристаллическими формами одного и того же химического элемента - углерода. Здесь в отличие от плотной упаковки алмаза, где каждый атом углерода помещается в центре тетраэдра, образованного атомами, являющимися его ближайшими соседями, кристалл графита имеет слоистое строение и легко делится на чешуйки. Силы связи (графита) между слоями ослаблены за счет большего расстояния между атомами по сравнению с расстоянием между атомами, находящимися в одной плоскости. Напротив, в аморфных породах (типа вулканического стекла) атомы расположены хаотично и все направления в них равноправны. Такие тела называются изотропными. Контрольные вопросы и упражнения 1. Чем отличаются кристаллы от аморфных тел? 2. Назовите и охарактеризуйте четыре типа элементарной ячейки кристалла. 3. Что понимается под анизотропией свойств кристалла, и чем она обусловлена? 1.4. Силы связи и внутренняя структура горных пород Свойства кристаллов определяются не только пространственным расположением частиц в узлах кристаллической решетки, но типом связи между ними. Строго говоря, между атомами действуют различные по своей природе силы: гравитационные, магнитные и электрические. Однако энергия взаимодействия атомов за счет первых двух сил на порядки меньше, по сравнению с электрическим взаимодействием. Химически активные элементы можно условно разделить на две группы – металлы (+), которые отдают валентные электроны, и металлоиды (-), принимающие избыточные валентные электроны. Трем различным сочетаниям таких элементов соответствуют три основных типа связей: ионная (+ ); ковалентная ( ); металлическая (+ +). Кроме перечисленных типов во всех телах существуют молекулярные связи. По преобладающим типам связей различают следующие группы кристаллов. 1. Ионные кристаллы. Ионная связь возникает в результате того, что в процессе образования кристалла электроны от атомов с меньшей электроотрицательностью переходят к атомам с большей электроотрицательностью. Например, в каменной соли NaCl (галит) электрон от натрия переходит к атому хлора. В результате образуется пара ионов Na+ и Cl. Для ионных кристаллов энергия связи U складывается из следующих величин: U = (E – J – R + V)/2, (1.6) где Е – электронное сродство, т. е. выигрыш в энергии нейтрального атома, приобретающего электрон и превращающегося в отрицательный ион; J – энергия ионизации, т. е. энергия, затраченная на отрыв электрона от атома и создание положительного иона; R – энергия отталкивания заполненных электронных оболочек при сближении ионов (следствие принципа запрета Паули); V – кулоновская энергия притяжения. Величины энергий ионизации и электронного сродства (EиJ) в значительной степени компенсируют друг друга. Энергия отталкивания R быстро убывает с расстоянием между ионами и не вносит заметного вклада в полную энергию связи. Тогда можно считать, что основной вклад в общую энергию связи ионного кристалла вносит энергия притяжения. По закону Кулона: где q1, q2 – величины зарядов ионов; 0 – электрическая постоянная; r – расстояние между атомами; АМ – постоянная Маделунга, зависящая только от типа кристаллической решетки, т. е. от ее геометрии; например, для галита (NaCl) – АМ = 1,748. В ионных кристаллах одинаковой структуры силы взаимодействия между ионами тем больше, чем выше их валентность и чем меньше сумма их атомных радиусов. Кристаллические зерна многих горных пород относятся именно к кристаллам ионного типа. В таких породах с увеличением сил взаимодействия прочность минеральных зерен и, следовательно, породы в целом, повышается. 2. Атомные (ковалентные) кристаллы. В узлах кристаллической решетки находятся нейтральные атомы, связанные обменным взаимодействием. Природа ковалентной связи может быть описана с помощью квантово-механических представлений, учитывающих волновые свойства электрона. Упрощенно механизм обменного взаимодействия можно представить следующим образом. Пусть имеются два атома (в простейшем случае - атомы водорода). При больших расстояниях между ядрами атомов атомы можно считать изолированными. По мере уменьшения расстояния увеличивается степень перекрытия электронного облака первого атома вторым, т.е. увеличивается вероятность перехода электрона к «чужому» протону. При дальнейшем сближении атомов (рис. 1.4)степень перекрытия облаков растет, и частота обменов электронов местами увеличивается настолько, что теряет смысл говорить о принадлежности электрона 1 протону а и электрона 2 - протону б. В этом случае в системе возникает новое состояние, при котором электроны принадлежат одновременно обоим ядрам. Такие электроны называются обобществленными.
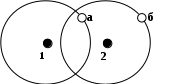 овалентная связь возникает при взаимодействии одинаковых атомов с 4 по 7 группу таблицы химических элементов Менделеева. При этом 4-валентные элементы отдают в обще пользование четыре электрона, 5-валентные - три, 6-валентные - два и 7-валентные - один электрон. В этом случае у взаимодействующих атомов оказываются заполненными внешние оболочки обобществленными электронами. Ковалентная связь присуща наиболее твердым кристаллам, например алмазу. овалентная связь возникает при взаимодействии одинаковых атомов с 4 по 7 группу таблицы химических элементов Менделеева. При этом 4-валентные элементы отдают в обще пользование четыре электрона, 5-валентные - три, 6-валентные - два и 7-валентные - один электрон. В этом случае у взаимодействующих атомов оказываются заполненными внешние оболочки обобществленными электронами. Ковалентная связь присуща наиболее твердым кристаллам, например алмазу. 3. Металлические кристаллы. Аналогично ковалентным кристаллам в узлах пространственной решетки металлических кристаллов размещаются совершенно одинаковые частицы. Следовательно, ионная связь возникнуть не может. Для установления ковалентной связи у металлов недостает валентных электронов (для большинства металлов координационное число равно 8-12). Однако при кристаллизации металла его атомы сближаются настолько, что волновые функции электронов существенно перекрываются. Вследствие этого валентные электроны получают возможность переходить от одного атома к другому и могут свободно перемещаться по всему объему металла. Такие валентные электроны в металлах принято называть коллективизированными. Свобода движения валентных электронов внутри металлического кристалла и их большое число в единице объема позволяют провести некоторую аналогию между свойствами валентных электронов в металле и свойствами молекул газа. И те и другие могут свободно перемещаться по всему объему. Поэтому для обозначения совокупности свободных валентных электронов внутри металлического кристалла употребляется термин – электронный газ. Электронный газ является общим для всего кристалла, он обладает «цементирующим» действием, связывая в прочную систему положительно заряженные ионы металла. Из характера металлической связи видно, что она должна быть более гибкой и эластичной, чем ионная и ковалентная. Иллюстрацией этого является большая пластичность (ковкость) металлов. Наличие высокой концентрации свободных электронов обусловливает хорошую электропроводность и теплопроводность металлов. 4. Молекулярные кристаллы. В узлах кристаллической решетки находятся устойчивые молекулы, которые сохраняют индивидуальность не только в газообразной, но и в жидкой и твердой фазах (N2 , Cl2, CH4, H2O). Молекулы удерживаются в узлах решетки довольно слабыми силами, природа которых сводится к взаимодействию между молекулярными диполями (силы Ван-дер-Ваальса). Различают три вида взаимодействия молекул. Дисперсионное – взаимодействие в атомах мгновенных диполей. Взаимодействие обусловлено тем, что энергетически более выгодно, когда электроны вращаются синхронно и мгновенные значения их дипольных моментов (векторное произведение заряда электрона на радиус его орбиты) совпадают по направлению. В этом случае между диполями возникают силы притяжения. Ориентационное – молекулы уже являются электрическими диполями и за счет электростатического взаимодействия стремятся расположиться упорядоченно с минимумом потенциальной энергии. Индуцированное – молекулы неполярны, но обладают высокой поляризуемостью под влиянием внешнего электрического поля, например, при приближении полярной молекулы. Молекулярная связь самая непрочная и легко разрушается тепловым движением, вследствие чего молекулярные кристаллы плавятся при очень низких температурах, например лед. Любой из указанных типов связи только в редких случаях встречается в чистом виде. Обычно связь между атомами в твердом теле представляет собой комбинацию различных типов связей. Например, в межатомном притяжении почти всегда содержится вклад сил Ван-дер-Ваальса. Для горных пород, помимо взаимодействия частиц в узлах кристаллической решетки, большое значение имеет характер связи между отдельными минеральными зернами. Формирование таких связей происходит в момент кристаллизации горных пород или осадконакопления. Условно можно выделить следующие типы связей между зернами в горной породе. 1. Внутрикристаллические связи.Проявляются по плоскостям спайности кристалла. При формировании отдельного зерна процесс кристаллизации сопровождается образованием плоскостей спайности или плоскостей ослабления. Их появление обусловлено тем, что кристаллизация начинается одновременно в нескольких центрах, и такие плоскости представляют собой границы соприкосновения растущих кристаллических образований. В плоскостях спайности расстояние между частицами несколько больше, чем в основном теле кристалла, что и определяет эти плоскости, как поверхности ослабления. 2. Структурные связи.Образуются при механическом соприкосновении зерен, кристаллизующихся из разных центров в разное время. В процессе образования полиминеральных пород при остывании расплава (магмы) начинают кристаллизоваться наиболее тугоплавкие минералы, затем минералы со все меньшей температурой плавления. В результате последние заполняют промежутки между ранее сформировавшимися кристаллами, образуя зерна произвольной формы. Эти же связи могут возникать и при образовании мономинеральных пород за счет того, что начало кристаллизации из разных центров происходит не одновременно. Это обусловлено неоднородностью распределения температуры и давления в расплаве, наличием примесей и др. 3. Адгезионные связи.Образуются при кристаллизации одного минерала на уже сформировавшейся поверхности другого минерального зерна. Ионы менее тугоплавкого минерала притягиваются к поверхности ранее образовавшихся зерен, и здесь начинается рост этого минерала, т. е. возникает центр кристаллизации. Такие связи достаточно прочны, но из-за несовпадения размеров ионов и различия в параметрах кристаллической решетки двух минералов такая поверхность является ослабленным сечением. 4. Диффузионные связи.Образуются за счет проникновения (диффузии) атомов или ионов одного минерала в другой. Между внедренными в минерал чужими и своими частицами возникает прочная ковалентная или ионная связь. Граница между минеральными зернами в процессе взаимной диффузии размывается, становится нечеткой. Ширина области взаимной диффузии зависит от условий кристаллизации и достигает нескольких межатомных расстояний. 5. Химические связи.Образуются за счет химических реакций на границе минеральных зерен. Например, при контакте кварца SiO2 с магнетитом Fe3O4 образуется силикат железа Fe2SiO4 – минерал, называемый фаялитом. Такие реакции происходят в тонком приконтактном слое, и граница представляет собой трехслойную область (плавный переход от одного минерала к другому), точно повторяющую контуры минеральных зерен. Такая связь является наиболее прочной. 6. Механические связи.Образуются при внедрении цемента (чаще всего глинистого состава) в промежутки между уже сформировавшимися минеральными зернами. Такая связь наиболее характерна для переотложенных осадочных пород и отличается наименьшей прочностью. В чистом виде указанные выше связи между минеральными зернами встречаются крайне редко. Действительно, диффузия атомов одного минерала в другой практически всегда сопровождается их химическим взаимодействием. С другой стороны, образование структурной или механической связи вызывает диффузионные процессы в местах соприкосновения зерен, где возникают области повышенного давления. Контрольные вопросы и упражнения 1. Назовите основные типы сил связи между частицами кристалла. 2. Чем обусловлена связь частиц в ионном кристалле? 3. Поясните схему обменного взаимодействия в ковалентном кристалле. 4. Чем обусловлено взаимодействие атомов в кристаллах металла? 5. Как взаимодействуют молекулы в молекулярном кристалле? 6. Назовите и охарактеризуйте основные типы связи между отдельными минеральными зернами в горной породе. 1.5. Дефекты кристаллической структуры По известному строению и силам связи между частицами кристалла можно, в принципе, рассчитать его свойства. Однако сравнение теоретических свойств с результатами опытов показывает их существенное различие. Например, реальная прочность кристаллов на два-три порядка ниже расчетной прочности. Это обусловлено наличием дефектов структуры реальных кристаллов. Под дефектами понимают любое нарушение упорядоченности идеальной кристаллической решетки. Различают следующие виды дефектов: 1. Тепловые колебания. 2. Точечные дефекты - вакансии, атомы внедрения, атомы примеси. 3. Линейные дефекты - дислокации. 4. Поверхностные дефекты - наружная поверхность кристалла, внутренние поверхности трещин и пор. 5 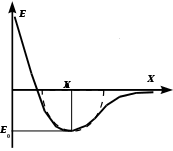 . Объемные дефекты - поры, пустоты, трещины. . Объемные дефекты - поры, пустоты, трещины. Рис. 1.5. График тепловых колебаний атомов Тепловые колебания атомов присущи любым телам. Это обусловлено самим характером кривой взаимодействия частиц (рис. 1.5). Здесь при достаточном удалении атомов друг от друга (X ), они практически не взаимодействуют (Е 0). При сближении атомов возрастает сила (и энергия) их притяжения. Однако чрезмерному сближению атомов препятствуют резко возрастающие силы отталкивания (Е ). Наиболее устойчивое положение атомов кристаллической решетки, т.е. состояние равновесия, соответствует минимуму потенциальной энергии системы. Однако в действительности силы, удерживающие атомы в узлах решетки, столь малы, что достаточно уже тепловой энергии при любых температурах, отличных от абсолютного нуля, чтобы заставить атомы переместиться из равновесного положения. Силы взаимодействия стремятся вернуть атом в исходное положение. Возникающие тепловые колебания вызывают временные искажения регулярности решетки кристалла. Энергия тепловых колебаний распределяется по отдельным атомам неравномерно. При неизменной общей энергии системы мгновенные значения энергии каждого атома изменяются от нуля до удвоенной средней энергии тепловых колебаний атома. Такое отклонение истинного (мгновенного) значения энергии атома от ее средней величины называется флуктуацией энергии и обусловлено хаотичностью теплового движения частиц. Флуктуации энергии являются чисто случайной величиной и могут быть описаны лишь с вероятностных позиций. Точечные дефекты - это нарушения кристаллической решетки в изолированных друг от друга точках. Вследствие флуктуации энергии отдельный атом может получить энергию, достаточную для разрыва связей с соседними атомами и выхода из узла решетки. На его месте образуется вакансия, в направлении к которой смещаются соседние атомы, тем самым, внося искажения в кристаллическую решетку. Ушедший атом может реализовать одну из трех возможностей: занять соседнюю вакансию (при этом происходит аннигиляция, т.е. взаимное уничтожение дефектов); выйти на границу кристалла (оставляя после себя вакансию); внедриться между узлами решетки (образуя пару дефектов - атом внедрения и вакансия). Наличие примесных атомов, т.е. атомов другого химического элемента, также вносит искажение в кристаллическую решетку. За счет тепловых флуктуаций указанные дефекты постоянно зарождаются и исчезают в любом реальном кристалле. С повышением температуры увеличивается кинетическая энергия атомов и, следовательно, возрастает вероятность выхода атомов из узла решетки. При отсутствии механических воздействий дефекты кристалла находятся в термодинамическом равновесии, т.е. число вновь образующихся дефектов компенсируется их аннигиляцией. Данной температуре соответствует определенная концентрация дефектов (достигающая 109 1/мм3). В результате серии последовательных «скачков» вакансий и атомов наблюдается диффузия точечных дефектов, носящая хаотический характер. Под действием внешней механической нагрузки за счет внесения дополнительной энергии в тело термодинамическое равновесие нарушается, концентрация дефектов возрастает, и их движение приобретает упорядоченный (направленный) характер. Вследствие этого происходит объединение вакансий (что энергетически выгодно) с образованием микропустот и зародышевых микротрещин. 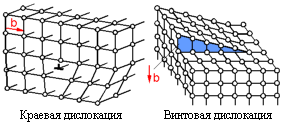 Линейные дефекты можно представить сочетанием краевой и винтовой дислокаций (рис. 1.6). Краевая дислокация образуется за счет лишней (или оборванной) атомной плоскости, внедренной в кристаллическую решетку. Под линией дислокации понимают место «обрыва» этой плоскости, где искажения кристаллической решетки максимальны. Винтовая дислокация образуется за счет сдвига кристаллической решетки на одно межатомное расстояние. Рис. 1.6. Типы дислокаций Энергия образования дислокаций значительно выше, чем точечных дефектов, и составляет порядка 3-30 эВ на одно межатомное расстояние вдоль линии дислокации. Поэтому тепловые флуктуации не могут рождать дислокации, т.е. число дислокаций не зависит от температуры и обусловлено лишь предысторией кристалла (условиями кристаллизации и последующей пластической деформацией). Важнейшим свойством дислокаций является их подвижность и активное взаимодействие между собой и с любыми другими дефектами кристаллической решетки. Для того, чтобы вызвать движение дислокаций, достаточно создать в кристалле небольшое напряжение сдвига порядка 1 МПа. Уже под влиянием такого напряжения дислокация будет перемещаться в кристалле, пока не встретит какого-либо препятствия, которым может быть граница зерна, другая дислокация, атом внедрения и др. При встрече с препятствием дислокация искривляется, огибает препятствие, образуя расширяющуюся дислокационную петлю, которая затем «отшнуровывается» от исходной дислокации и начинает самостоятельное существование. Оставшаяся часть дислокации (перед препятствием) под воздействием достаточного внешнего напряжения снова будет изгибаться, и весь процесс повторится. Таким образом, при взаимодействии движущихся дислокаций с препятствиями происходит их размножение. Если в недеформированных кристаллах через площадку в 1 см2 проходит порядка 106-108 дислокаций, то при пластической деформации плотность дислокаций возрастает в тысячи, а иногда и в миллионы раз. Процесс размножения дислокаций продолжается до тех пор, пока их суммарное упругое поле не сбалансирует внешнее напряжение. П 19 оверхностные дефекты. К таким дефектам относятся: наружная поверхность тела в целом, граница между отдельными зернами и любые другие несовершенства, возникающие на плоскостях контакта различных кристаллов. В частности, в кристаллах существуют плоскости ослабления (плоскости спайности), где расстояние между атомными плоскостями несколько больше, чем в самом кристалле. Установлено, что все кристаллы имеют мозаичную структуру, т.е. состоят из блоков размером 10-6 - 10-8 м, расположенных лишь приблизительно параллельно друг другу (величина углов между ними - от нескольких секунд до десятков минут). Объемные дефекты. Представляют собой трещины, поры и пустоты. Контрольные вопросы и упражнения 1. Что понимается под дефектом кристаллической структуры? 2. Что называется флуктуацией энергии в кристалле? 3. Назовите типы точечных дефектов кристалла и укажите их свойства. 4. Что понимается под линейными дефектами структуры – дислокациями, и какими свойствами они обладают. 5. Как реагируют точечные и линейные дефекты на приложение к кристаллу внешней механической нагрузки? 6. Охарактеризуйте поверхностные и объемные дефекты кристаллической структуры. |
