1 у dелементів заповнюються орбіталі не зовнішнього, а передзовнішнього енергетичного рівня. У атомів dелементів на зовнішньому енергетичному рівні на nsпідрівні, як правило, знаходяться два електрони. Fe0 1s
 Скачать 216.99 Kb. Скачать 216.99 Kb.
|
   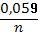 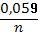   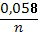 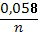   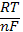 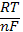 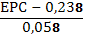 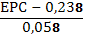     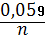 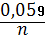   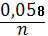 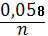   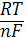 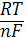   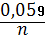    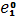 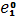   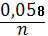 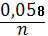   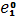 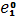           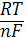 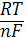 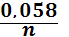 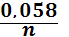     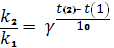 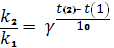 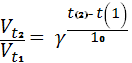 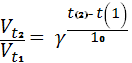     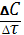 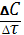 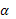 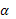 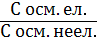 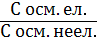 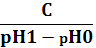 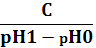         Відповіді до відкритих питань з диф. заліку Відповіді до відкритих питань з диф. заліку1 У d-елементів заповнюються орбіталі не зовнішнього, а передзовнішнього енергетичного рівня.У атомів d-елементів на зовнішньому енергетичному рівні на ns-підрівні, як правило, знаходяться два електрони. Fe0 1s22s22p62s23p63d64s2 Ферум(ІІІ) оксид має амфотерні властивості. Він реагує з кислотами з утворенням солей трьохвалентного Феруму:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O Ферум(ІІІ) гідроксид Fe(OH)3 є нерозчинною речовиною бурого кольору. Його можна добути реакцією обміну між солями трьохвалентного Феруму і лугами у розчині: FeCl3 + 3NaOH → 3NaCl + Fe(OH)3↓.Ферум(ІІІ) гідроксид проявляє амфотерні властивості і може взаємодіяти з кислотами і лугами. Основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу. Він накопичується здебільшого в печінці, кістковому мозку, селезінці. Нестача Феруму призводить до небезпечної хвороби — недокрів’я. Тому обов’язково треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо. Препарати Феруму: Актиферин ( лікування залізодефіцитної анемії), Гемоферон, Глобіген,Ферогематоген. В основному всі вони використовуються по нестачі заліза в організмі, при залізодефіцитних анеміях. 2KMnO4 + 10FeSO4 + 8H2SO4 (розб.) = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O 2 Протонна (протолітична) теорія кислот і основ. У 1923 р. датський вчений Й. Бренстед і англійський хімік Т. Лоурі запропонували протонну (протолітичну) теорію, на основі якої кислотно-основні власти вості речовин пояснюють за відношенням їх до протона. Кислотою називають сполуку, що віддає протони, тобто є донором протонів. Основою називають сполуку, що приєднує протони, тобто акцептором протонів. Згідно з цією теорією, у результаті кислотно-основної взаємодії ут ворюються нова кислота й нова основа. Отже, взаємодія між кислотою й основою зводиться до переходу протона від кислоти до основи. Внаслідок цього кислота (1) перетворюється на основу (1), а ос нова (2) - на кислоту (2). Ці пари (кислота - основа) називають поєднаними (спряженими). Згідно з теорією Бренстеда - Лоурі, кислоти й основи називають протолітами, а реакції, що відбуваються з перенесенням про тонів, - протолітичними. Речовини, що виявляють двоякі властивості - і віддають, і при єднують протони, - відносять до амфолітів. До них належить вода Н20, деякі йони (НС03-, НS-, Н2Р04-) тощо. Протолїтичні реакції відбуваються у напрямку утворення слабкіших протолітів. 3 Активна кислотність - це концентрація протонів (Н+). Потенційна кислотність - це концентрація неднсоціпованпх молекул кислоти. Загальна кислотність - це загальна концентрація кислоти в моль екв. Сума активної та потенційної кислотностей дорівнює загальній кислотності. Під час титрування визначається загальна кислотність. Активна лужність - це концентрація гідроксид - аніонів. Потенційна лужність - це концентрація неднсоціґюваннх молекул основи. Загальна лужність - це загальна концентрація основи в моль екв. Сума активної та потенційної лужностей дорівнює загальній лужності. Під час титрування визначається загальна лужність. Концентрацію протонів в розчині кислоти обчислюють за формулою: [Н+] = α[кислоти], де α – ступінь дисоціації кислоти Сильна кислота: α=1, [Н+] = [кислоти] Слабка кислота: [Н+] = Під час дисоціації основи утворюються гідрокснд-аніонн, концентрацію яких обчислюють за формулою: [ОН-] = α[основи], де α – ступінь дисоціації основи Сильна основа: α=1, [ОН-] = [основи] Слабка основа: [ОН-] = 4 рН – це відємний десятковий логарифм концентрації іонів гідрогену. pH, Водневий показник — величина, що показує міру активності іонів водню (Н+) в розчині, тобто ступінь кислотності або лужності цього розчину. Для сильний кислот: [H+] = Ск; pH = -lg [H+] = -lg Ck Для сильних основ: : [OH-] = Co; pOH = -lg[OH-] = -lgCo, рН = 14-рОН. Для слабких кислот: pH = ½ pKk - lgCk Для слабких основ: рН = 14 - 1/2(рК + lgСосн). 5 Величина рН є важливою характеристикою всіх фізіологічних рідин, від значення якої залежить функція клітин, тканин, органів і організму людини в цілому. Шлунковий сік, кров, слина, сік підшлункової залози та інші рідини характеризуються певним значенням рН, яке в нормі може змінюватися у вузькому інтервалі. Відхилення значення рН від норми призводить до виникнення патологічних станів організму, ос кільки йони Гідроксонію і гідроксид-іони визначають структуру та біо логічні функції білків, нуклеїнових кислот, активність ферментів та інших клітинних компонентів організму. рН: рН крові = 7,36; рН шлункового соку = 0,9 - 1,5; рН сечі 5 – 6,5; рН жовчі = 6,2 – 8,5. Ацидо́з — підвищена кислотність крові, шлункового соку та тканин організму внаслідок зміни кислотно-лужної рівноваги в кислу сторону. Підвищення кислотності відбувається внаслідок збільшення концентрації іонів водню (зниження pH) і зменшення резервної лужності. Алкало́з — збільшення pH крові (та інших тканинах організму) за рахунок накопичення лужних речовин. Алкалоз — порушення кислотно-лужної рівноваги організму, що характеризується абсолютним або відносним надлишком основ. Залежність швидкості ферментативної реакції від рН середовища. Ферменти є досить чутливими до змін рН середовища, в якому вони діють. Кожний фермент виявляє свою оптимальну активність лише за певного рН середовища, наприклад, пепсин - 1,5-2,0, амілаза слини - 6,8-7,4, трипсин - 7,5-8,5, аргіназа - 9,5-10,0, тобто фермент має свій оптимум рН, за якого він є найактивнішим. Відхилення рН від оптимальних величин викликає зниження активності ферменту, тому що призводить до зміни ступеня іонізації іо-ногенних груп в активному центрі, а це впливає на спорідненість субстрату із посадочною ділянкою активного центру ферменту і на каталітичний механізм перетворення. Окрім того, зміна іонізації білка (не тільки в зоні активного центру) викликає конформаційні зміни молекули ферменту. 6 Буферними називають системи, які достатньо стійко зберігають величину рН під час додавання невеликої кількості сильної кислоти або лугу, а також під часрозведення(або концентрування). 7 Існує два типи буферних систем: а) кислотні □ складаються із слабкої кислоти та її солі, утвореної сильною основою. Наприклад, ацетатний буфер: СН3СООН + СН3COONa. б) основні □ складаються із слабкої основи та її солі, утвореної сильною кислотою. Наприклад, аміачний буфер: NH4OH + NH4Сl. 8 За рахунок часткової дисоціації кислоти та повної дисоціації солі в розчині будуть знаходитись одночасно іони СН3СОО-, Н+, Na+: CH3COONa → CH3COO- + Na+ CH3COOH →CH3COO- + H+ Якщо до нього добавити сильної кислоти, то іони Гідрогену реагуватимуть з аніонами солі, утворюючи слабку ацетатну кислоту: CH3COO- + H+ → CH3COOH (рКа = 4,75) Сильна кислота заміняється еквівалентною кількістю слабкої кислоти і рівновага зміщується вліво. При добавлянні лугу до буферного розчину гідроксид-іони взаємодіятимуть з іонами Н+ ацетатної кислоти з утворенням молекул води: CH3COOH + ОН- →CH3COO - + H2О Нехай буферна система містить приблизно рівні концентрації слабкої кислоти (AH) та спряженої з нею основи (A-), при додаванні до неї сильної кислоти, що є донором іонів H+, останні зв'язуватимуться із основою A-: H3O+ + A- → H2O + AH. З іншої сторони, при додаванні невеликої кількості лугу, що постачає іони OH- у розчин, з ними взаємодіятиме слабка кислота: OH- + AH → H2O + A-. Ці дві оборотні реакції і забезпечують буферні властивості розчину: додавання до розчину іонів H+ чи OH- має наслідком зміну співвідношення слабкої кислоти і спряженої основі, і зовсім незначний зсув pH. 9 Основні рівняння буферних систем: Кислотний тип: [H+] = KдОсновиний тип: [ОH--] = Kд 10 Рівняння Гендерсона – Гассельбаха Кислотний тип : pH = pKд – lg [кислоти]/[солі] Основний тип: pОH = pKд – lg [основи]/[солі] Як випливає з рівняння Гендерсона-Хассельбаха, рН буферного розчину залежить від співвідношення концентрацій кислоти і солі (або підстави і солі): Тому, в разі кислотно-сольової буферної системи, збільшення концентрації кислоти або зниження концентрації солі зрушує рН розчину в кислую сторону. При цьому зміна співвідношення концентрацій в 10 разів зрушує рН на одиницю. 11 Білковий буфер представляє систему з білку(протеїн - Pt) і його солі. Компоненти буфера можуть бути зображені як Pt - COOH -слабодиссоциированная білок-кислота і її сіль Pt -COONa. Pt - COOH ⇔ Pt - COO - H Pt - COONa ⇔ Pt - COO - Na При збільшенні концентрації іонів водню сіль білкувзаємодіє з ними, утворюючи слабодиссоциированную білок-кислоту і нейтральну сіль : Pt - COO - Н --> Pt - COOН З гидроксид-ионами взаємодіє білок-кислота і замістьсильної основи утворюється сіль і вода : Pt - COOН OH - ⇒ Pt - COO - H2O Проте до складу білків входять не лише вільнікарбоксильні групи, але і вільні аміногрупи. Тому зв'язування іонів може відбуватися і по аміногрупі: Pt - NH 3 OH - ⇒ Pt - NH3OH рН плазми крові, створюваного бікарбонатним буфером, можна розрахувати, знаючи кількість розчинених в плазмі крові діоксиду вуглецю ібікарбонатів по рівнянню Гендерсона- Гассельбаха. Фосфатний буфер. Цей буфер має найбільше значення в таких біологічнихрідинах, як мочивши і соки травних залоз. Для крові має невелике значення,оскільки в плазмі фосфатів мало, але нутри клітин він грає істотну роль. Фосфатний буфер cостоит з гідрофосфатних ідигидрофосфатных аніонів (HPO 2 -4 і H2PO4 ). Його буферна дія видно з прикладу: H HPO 2 --4 ⇔ H2PO4 OH - H-2 -2po4 ⇔ HPO4 H2O Буферні системи мають найважливіше значення для життєдіяльності організмів; вони визначають постійність кислотності різних біологічних рідин (крові, лімфи, міжклітинних рідин). Основні Б. с. організму тварин і людини: бікарбонатна (вугільна кислота і її солі), фосфатна (фосфорна кислота і її солі), білки (їх буферні властивості визначаються наявністю основних і кислотних груп). Білки крові (перш за все гемоглобін, що обумовлює близько 75% буферної здатності крові) забезпечують відносну стійкість ph крові. |
