1 у dелементів заповнюються орбіталі не зовнішнього, а передзовнішнього енергетичного рівня. У атомів dелементів на зовнішньому енергетичному рівні на nsпідрівні, як правило, знаходяться два електрони. Fe0 1s
 Скачать 216.99 Kb. Скачать 216.99 Kb.
|
|
31 Необоротні процеси - фізичні процеси які можуть мимоволі протікати лише в одному певному напрямку. До них відносяться процеси дифузії, теплопровідність, термодифузії в’язкої течії і т.п. В замкнутих системах необоротні процеси супроводжуються зростанням ентропії. Вона може лишатися постійною або навіть убувати за рахунок обміну ентропією з зовнішнім середовищем. У необоротних процесах ентропія ізольованої системи зростає. Усі процеси, які проходять самодовільно - необоротні. 32 Швидкість хімічної реакції - це зміна концентрації однієї із реагуючих речовин за одиницю часу і в одиниці об'єму (для гомогенних реакцій) або на одиниці поверхні (для гетерогенних реакцій). V = - для гомогенних реакцій: V = - для гетерогенних реакцій: V = - Швидкість хімічної реакції залежить від природи реагуючих речовин, концентрації, температури. Закон діючих мас - швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, зведених в ступені, рівних стехіометричним коефіцієнтам. Наприклад, для реакції аА + bВ сС V= k[А]а • [В]b , де k - константа швидкості хімічної реакції; вона дорівнює швидкості хімічної реакції за концентрації речовин 1 моль/л і залежить від природи речовин та температури. 33 Правило Вант - Гоффа - під час збільшення температури на 10° швидкість хімічної реакції збільшується в 2 - 4 рази. або 34 Ферменти - це речовини білкової природи які синтезуються клітиною і значно збільшують V біохімічних реакцій. Містять активний центр (або кілька), що визнач. специфічність хімічної реакції. Швидкість біохімічної реакції прямо пропорційна концентрації певного ферменту, який її каталізує. Температурний інтервал дії ферментів: 10-56 С. Діапазон рН: 4-10. (ферменти травлення в кислому середовищі пепсин - рЬ=1.0-2.0, ферменти сечовивідної системи у лужному середовищі - аргіназа рН=10 -10.2). Селективність ферменту: взаємодія відбувається за принципом «замок-ключ», тобто має бути повне співпадіння у структурі субстрату та активного центру ферменту. Ефективність: використання при порушенні травлення(пепсин, панкреатин), для руйнування білкових утворень(трипсин,лідаза), для лікування інфекцій головного мозку, тромбів (плазмін), для комплексного розкладу речовин(ліки з комплексом ферментів - солізим, фестал, лізим, ензистал), для визначення орг. і неорг речовин, для виробництва кефіру, йогуртів, дріжджів, у біохімічному аналізі, синтезі а/б. Розділ медицини, що займається використанням ферментів для лікування наз. ензимотерапією. 35 Оборотними називають реакції, в яких кінцеві продукти взаємодіють між собою із утворенням початкових речовин. Такі реакції ідуть не до кінця, а до стану рівноваги: 3H2 + N2 ↔ 2NH3 Необоротними називають реакції, в яких початкові речовини повністю перетворюються на продукти реакції, тобто реакція іде до кінця. Ознаки необоротності: а) випадіння осаду: Na2SO4 + ВаСl →2NаС1 + ВаSO4 ↓; б) виділення газу: Na2СОз + Н2SO4 → Na2SO4 + Н2O + CO2↑ в) утворення слабкого електроліту: 2NaОН + Н2SO4 → Na2S04 + 2Н2O . Хімічна рівновага - це стан системи, під час якого швидкості прямої та зворотньої реакцій однакові. Рівноважними називають концентрації, які встановлюються на стан рівноваги (для початкових речовин рівноважна концентрація це кількість речовини, яка залишилася на момент рівноваги; для продуктів реакції - це кількість речовини, яка утворилася на момент рівноваги). Хімічна рівновага характеризується константою рівноваги КР, яка дорівнює відношенню добутку концентрацій продуктів реакції до добутку концентрацій вихідних речовин в ступенях рівним стехіометричним коефіцієнтам. Відповідно до закону діючих мас для оборотної реакції: аА + bВ → сС + dD вираз КР можна записати таким чином: Kp = Термодинамічні умови рівноваги: ΔG=0; ΔF=0 КР показує, в скільки разів швидкість прямої реакції більше швидкості зворотньої реакції. Якщо КР > 1, то швидше іде пряма реакція; ΔG < 0. Якщо КР < 1, то швидше іде зворотна реакція; ΔG > 0. Якщо КР = 1, то ΔG=0 (стан рівноваги). КР залежить від природи реагуючих речовин та температури і не залежить від концентрації та каталізатора. Зсув хімічної рівноваги - це перехід системи з одного рівноважного стану в інший. Принцип Ле-Шательє: якщо на систему, що знаходиться в рівновазі, подіяти певним чинником (змінити концентрацію, тиск, температуру), то рівновага зрушується у напрямку тієї реакції, яка послаблює цю дію. Хімічна рівновага встановлюється в насиченому розчині солі між твердою фазою та іонами, що перейшли в розчин. 36 Гальванічний елемент - це система, в якій хімічна енергія окисно- відновної реакції перетворюється на електричну. Електродним називається потенціал, що виникає на металевому електроді, зануреному в розчин солі цього металу. Така система називається напівелементом, схема якого записується таким чином: Ме | Ме n+. Величину електродного потенціалу можна розрахувати за рівнянням Нернста: e = e0 + lnaMn+ де е0 - нормальний електродний потенціал, що виникає на електроді, зануреному в розчин солі цього металу із концентрацією 1 моль/л; R - універсальна газова стала = 8,313 Дж/к* моль; Т - температура за Кельвіном; n - заряд іона; F - число Фарадея 96500 Кл/ моль; а - активність іонів металу (або концентрація). За 18°С рівняння має вигляд: e = e0 + lgaMn+ Для визначення концентрації Н+ використовують водневий електрод, схема якого має вигляд: Pt(Н2) | Н+ (потенціал нормального водневого електроду прийнятий за 0) та скляний електрод: скло | Н+. 38 Розглянемо простий гальванічний елемент Даніеля-Якобі, який складається з двох полуелементів - цинкової та мідної пластин, занурених до розчинів сульфатів цинка і міді відповідно, які з’єднані між собою т.з. електролітичним ключом (містком) - наприклад, паперової стрічнки, змоченої розчином будь-якого електроліта, або трубки, заповненої агаром на розчині електроліту. Схема гальванічного елементу Якобі: (-) Zn|ZnSO4|| CuSO4| Cu(+) Електродний потенціал будь-якого електроду дорівнюватиме ЕРС елемента, складеного з цього електрода і стандартного водневого електрода. При цьому знак електродного потенциала вважають позитивним, якщо в такому гальванічному елементі дослідний електрод є катодом, і негативним, якщо дослідний електрод є анодом. Рівняння ЕРС гальванічного елементу Якобі: ЕРС= e0Cu – e0Zn + ln Рівняння ЕРС гальванічного елементу загального типу (електроди із різних металів, занурених в розчини своїх солей): ЕРС= – + ln За 180: ЕРС= – + lg За 250: ЕРС= – + lg Концентраційним називається гальванічний елемент, що складається із однометалевих електродів, занурених в розчини їх солей різної концентрації. Схема концентраційного елементу: (-)Ag| AgNO3|| AgNO3|Ag (+) С2 < С1 Рівняння ЕРС концентраційного елементу: ЕРС= ln За 180: ЕРС= lg За 250: ЕРС= lg 39 Для визначення рН розчинів складають такі гальванічні елементи або ланцюги: а) каломельно-скляний елемент: (-) скло | Н+ || Hg2С12,КCl| Нg (+); pH = б) воднево - хлорсрібний елемент: (-) Рt(Н2) | Н+|| АgС1, КСl| Аg (+); pH = 40 Окиснювально - відновні або редокс – системи -це системи, в яких індиферентний електрод не обмінюється іонами із розчином, а тільки забезпечує постачання або відведення електронів для окиснювально - відновної реакції, що протікає в розчині, який містить окислену та відновлену форми однієї речовини. Схема редокс - системи: Рt|FeС12,FеС13. Редокс - потенціал обчислюють за рівнянням Петерса: e red = e0red+ lnщо виникає на електроді, зануреному в розчин із співвідношенням в ньому окнсненої та відновленої форм 1; n - число єлектронов, яке віддає відновник або приймає окислювач. за 180: e red = e0red+ lg за 250: e red = e0red+ lg Редокс-системи організму беруть участь в окисно-відновних реакціях, які визначають метаболізм (катаболізм) харчових речовин в організмі людини. Процес перенесення протонів і електронів в дихальному ланцюгу здійснюється за участю системи НАД-НАДН, хінон-гідрохінон, ФАД-ФАД-Н2. 41 Дифузний потенціал - це додатковий потенціал що виникає на межі розчин-розчин. Причиною його виникнення є різна швидкість руху катіонів та аніонів солі. Внаслідок дифузії позитивні і негативні йони переміщуються від розчину з більшою активністю до розчину з меншою активністю, тому в розчині з меншою активністю – надлишок аніонів, а в розчині з більшою активністю – катіонів – таким чином виникає різниця потенціалів. Дифузний потенціал ускладнює вимірювання, тому його намагаються зменшити. Мембранний потенціал виникає у випадках якщо між двома розчинами є вибірково-проникна мембрана. По обидві її сторони накопичуються йони протилежного знака, одна з них заряджається позитивно, інша- негативно. Мембранні та дифузні потенціали призводять до утворення біопотенціалів і біострумів в живих організмах. Мембранний потенціал виміряний в стані фізіологічного спокою клітини – потенціал спокою. Раптове підвищення та падіння мембранного потенціалу – потенціал дії. Яскравим прикладом мембранного потенціалу є натрієво-калієвий насос. Мембранні потенціали використовуються в ЕКГ, електроенцефалографічних електроміографічних методів дослідження. 42 Сорбція - це поглинання газів, пари чи розчинених речовин поверхнею і об’ємом твердого тіла чи рідини. Речовини поглиначі називаються сорбентами, речовини, що поглинаються -сорбатом чи сорбтивом. На молекули, що знаходяться на поверхні поділу фаз, наприклад, рідина-повітря, діють сили неоднакової величини. Це пов’язано з тим, що сили зчеплення між молекулами газів є значно слабшими, ніж між молекулами рідини. тобто рідина намагається втягнути в глибину молекулу, що знаходиться на її поверхні. Тому поверхня рідини намагається скоротитись до мінімально можливої. Так виникає поверхневий натяг. Поверхневий натяг - це сила, що намагається скоротити вільну поверхню тіла до найменшої можливої межі. Поверхневий натяг залежить від температури, природи контактуючих фаз, концентрації розчинених речовин. Поверхневий натяг визначається і природою рідини, а особливо її полярністю. Поверхневий шар рідини має певний запас поверхневої енергії. Ця енергія витрачається на роботу, спрямовану на утворення поверхні поділу фаз. При постійному тиску і температурі вона відповідає вільній енергії і має назву - поверхнева енергія Гібса. Поверхне́ва ене́ргія — енергія, яка потрібна на виконання роботи зі збільшення площі поверхні на одиницю. 43 Речовини, які зменшують поверхневий натяг рідин називаються поверхнево-активними (ПАР), речовини, які не змінюють чи навіть збільшують поверхневий натяг рідин називаються поверхнево-інактивними (ПІВ).Поверхнево-активні властивості мають численні органічні сполуки: фосфоліпіди, жирні кислоти, соли жирних кислот (мила), сульфокислоти, спирти, аміни, білки. До ПІВ належать здебільшого сильні неорганічні електроліти - кислоти, луги, соли. В організмі людини ПАР – це сурфактанти альвеол легенів, та окремі компоненти жовчі. Внаслідок сорбції гази, що розчинені в крові починають виділятися (через зміну тисків), збільшуватись в розмірах та призводити до закупорки судин – декомпресійна хвороба (кесонова хвороба). Під впливом жовчі (в складі якої містяться ПАР) жири розпадаються на дрібненькі краплинки (емульгація жирів). Це значно полегшує розщеплення жирів ферментами. Під час фагоцитозу поверхнево активні речовини дозволяють розчинити клітинну оболонку і тим самим забезпечити проникнення частинки в цитоплазму. 44 Сорбція - це поглинання газів, пари чи розчинених речовин поверхнею і об’ємом твердоготіла чи рідини. Речовини поглиначі називаються сорбентами, речовини, що поглинаються -сорбатом чи сорбтивом. Абсорбція - поглинання газу чи пари всім об’ємом твердого тіла чи рідини, тобто це об’ємна сорбція. Цей процес полягає в проникненні молекул газу чи рідини в масу сорбенту і завершується утворенням твердого чи рідкого розчину. Швидкість процесу досить низька і визначається дифузією. Приклад – поглинання водню паладієм, аміаку чи диоксиду вуглецю -водою. Адсорбція - накопичення молекул сорбата в поверхневому шарі твердого тіла чи рідини. Ці види сорбції відносяться до розряду фізичної сорбції, бо вони здійснюються за рахунок слабких взаємодій - сил Ван-дер-Ваальса (міжмолекулярної взаємодії -орієнтаційних, індукційних, дисперсійних) і водневих зв’язків. Якщо в процесі сорбції утворюються нові хімічні сполуки, то такий процес називається хемосорбцією. Адсорбе́нт — тверда або рідка речовина, на поверхні частинок якої відбувається адсорбція. Як адсорбент використовують силікагель, активоване вугілля, деякі оксиди, смоли. Кількісна залежність величини адсорбції від тиску або концентрації газу виражається ізотермою адсорбції Ленгмюра  , де , де  – величина адсорбції, що показує кількість речовини, адсорбованої одиницею поверхні адсорбенту або одиницею маси адсорбенту, кмоль/м3 – величина адсорбції, що показує кількість речовини, адсорбованої одиницею поверхні адсорбенту або одиницею маси адсорбенту, кмоль/м3Залежність величини адсорбції від тиску виражає рівняння Фрейндліха  . . 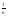 , ,Найбільш універсальною є теорія БЕТ, яка була розроблена в 1935-1940-рр. Брунауером, Емметом і Теллером. Для багатошарової адсорбції автори вивели рівняння ізотерми адсорбції  , де , де  обєм адсорбованого газу, м3/г; обєм адсорбованого газу, м3/г;  обєм адсорбованого газу при заповненні поверхні адсорбенту суцільним мономолекулярним шаром адсорбтиву, м3/г; обєм адсорбованого газу при заповненні поверхні адсорбенту суцільним мономолекулярним шаром адсорбтиву, м3/г;  і і  відповідно рівноважний тиск адсорбованого газу і тиск насиченої пари при даній температурі, Па; відповідно рівноважний тиск адсорбованого газу і тиск насиченої пари при даній температурі, Па;  константа адсорбційної рівноваги. константа адсорбційної рівноваги.45 Останнім часом набула популярності адсорбційна терапія для видалення токсинів та шкідливих речовин з організму людини. Одним з найсучасніших методів очищення крові від токсичних речовин за допомогою відповідних адсорбентів є гемосорбція. ЇЇ застосовують при нирковій та печінковій недостатності, при сильних отруєннях снодійними препаратами, фрсфоорганічними сполуками. Ентеросорбція – метод лікування, що полягає у використанні речовин, що здатні сорбувати на собі продукти обміну та ксенобіотичні речовини. Ентеросорбенти — речовини, що вводяться в просвіт шлунково-кишкового тракту і здатні сорбувати (пов’язувати) деякі компоненти його вмісту. Первинний етап дії ентеросорбенту — сорбція деяких речовин, що знаходяться в просвіті шлунково-кишкового тракту, таких як жовчні кислоти, холестерин, індол, скатол, аміак, поліаміни, біоактивні кишкові речовини, бактеріальні токсини. Внаслідок сорбції змінюється склад внутрішнього середовища шлунково-кишкового тракту. Це призводить на другому етапі до зниження концентрації ряду речовин в кишковому соку, що всмоктується в нижніх відділах кишечника, а також до пасивного транспорту деяких речовин, в т.ч. хвороботворних, з внутрішнього середовища організму через стінку кишечника в його порожнину з їх подальшою сорбцією і виведенням. Аплікаційно-сорбційна терапія, що почалась ще із застосування для лікування ран деревного попілу, сьогодня з появою високоємних активованих волокнистих вуглецевих сорбентів суттєво поширила свої можливості. Багаторічне вивчення медико-біологічних механізмів аплікаційно-сорбційної терапії завершилось розробкою підходів до використання методу АС на різних етапах перебігу ранового процесу. У ранньому післяопераційному періоді для запобіганню розвитку інфекції та скорочення терміну лікування ран. Великий сорбційний потенціал вуглеволокнистих сорбентів забезпечує швидке поглинання з ранового вмісту великої кількості (до 1,5 Г на 1 Г власної ваги) різноманітних біологічно активних компонентів, включаючи продукти білкового катаболізму та протеолізу, бактеріальні ендотоксини, біогенні аміни та медіатори запалення, що викликає зменшення інтенсивності місцевої судинної і запальної реакції. Аплікаційні сорбційні пов’язки на основі волокнистих вуглецевих сорбентів блокують локальні джерела інтоксикації і запобігають повторному інфікуванню ран, що надзвичайно актуально саме для онкологічних хворих, хірургічне втручання у яких нерідко проводиться на фоні інтоксикації і зниженій активності детоксикаційних систем організму та у багатьох випадках призводить до гнійно-запальних ускладнень. |
