биохиимия. ОКисления. Цикл. 1 вопрос Цикл трикарбоновых кислот
 Скачать 488.78 Kb. Скачать 488.78 Kb.
|
|
1 вопрос: Цикл трикарбоновых кислот Цикл ТКК представляет собой последовательность восьми реакций, протекающих в матриксе митохондрий. Схематически этот процесс можно записать следующим образом: 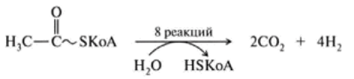 ЦТК начинается с взаимодействия ацетил-КоА с четырехуглеродной ди- карбоновой кислотой — оксалоацетатом, в результате чего образуется первая шестиуглеродная трикарбоновая кислота — цитрат. Далее следует серия реакций, в процессе которых происходит высвобождение двух молекул С02 и регенерация оксалоацетата. Характеристика ферментов ЦТК приведена в табл. 19.2. • Первая реакция цикла ТКК — это необратимая реакция конденсации ацетил-КоА с оксалоацетатом, катализируемая ферментом цитратсинтазой. В результате реакции происходит синтез цитрата:  Синтезируется ферментом аконитазой. Реакция идет через образование промежуточного продукта -аконитата: 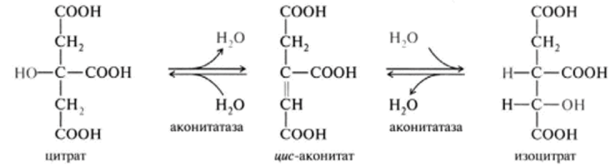 Третья реакция, подобно первой, является необратимой. В ней происходит окислительное декарбоксил ирование изоцитрата: гидрокс и группа изоцитрата окисляется до карбонильной с помощью НАД и одновременно отщепляется карбоксильная группа в (3-положении. Промежуточный продукт реакции — оксалосукцинат. Это первая реакция цикла, в которой восстанавливается НАД+-кофсрмент фермента изоцитратдегидрогеназы: 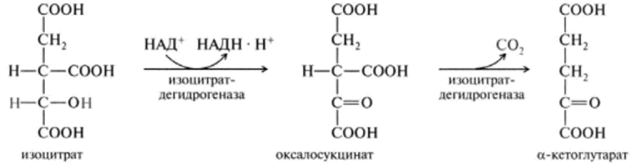 Присоединения сукцинил-КоА. Вторая реакция — это изомеризация цитрата в изоцитрат, в процессе которой происходит перенос гидроксигруппы к другому атому углерода, катали- Механизм этой реакции сходен с реакцией окислительного декарбоксил ирован ия пиру вата до ацетил-КоА, а а-кетоглутаратде- гидрогеназный комплекс напоминает по своей структуре пируватдсгидрогс- назный комплекс. Как в одном, так и в другом случае в ходе реакции принимают участие пять коферментов и три фермента: а-кетоглутарагдегидро- гсназа (кофермент ТПФ), легидролиноил1ранссукцинилаза (кофермент липоевая кислота), дегидролипоилдегидрогеназа (кофермент ФАД), а также HSKoA и НАД+. Суммарная реакция этого процесса может быть описана следующим уравнением:  • Пятая реакция является единственной в цикле реакцией субстратного фосфорилирования, катализируется ферментом сукцинил-КоА-синтетазой. В этой реакции сукцинил-КоА при участии ГДФ и неорганического фосфата превращается в сукцинат. Одновременно происходит образование высокоэр- гической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА. Она протекает в две стадии: — расщепление путем фосфоролиза тиоэфирной связи в сукцинил-КоА: 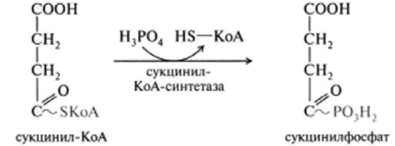 — активированная фосфорильная группа сукцинилфосфата переносится на ГДФ с образованием ГТФ и сукцината:  Суммарное уравнение для двух сопряженных реакций имеет следующий вид:  • В шестой реакции происходит дегидрирование сукцината до фумарата. Она катализируется ферментом сукцинатдегидрогеназой, в молекуле которого с апобслком ковалентно связан кофермент ФАД: 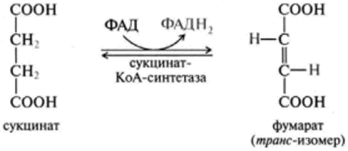 • В ходе седьмой реакции осуществляется гидратация фумарата до L-ма- лата. Она катализируется стереоспецифичным ферментом фумаразой:  • В восьмой, заключительной, реакции ЦТК происходит регенерация ок- салоацетата. Под действием НАД+-зависимой малатлегилрогеназы L-малат дегидрируется и превращается в оксалоацетат:  Суммарное уравнение цикла трикарбоновых кислот можно представить в следующем виде: 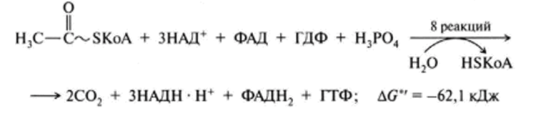 2 вопрос: Главная цепь дыхательных ферментов митохондрий, ее структурная организация. Основные переносчики электронов встроены во внутреннюю мембрану митохондрий и организованы в 4 комплекса, расположенных в определённой последовательности . В этой последовательности их стандартные о-в потенциалы становятся более положительными по мере приближения к кислороду. Каждое звено этой цепи специфично в отношении донора и акцептора электронов. На первом этапе дегидрогеназы катализируют отщепление водорода от различных субстратов. Если субстратами служат а-гидрокси-кислоты малат, изоцитрат, 3-гидроксибутират, водород переносится на NAD+. Образовавшийся NADH в дыхательной цепи, в свою очередь, окисляется NADH-дегидрогеназой (комплекс I). Если субстратом служат такие соединения, как сукцинат или глицерол-3-фосфат, акцептором водорода служат FAD-зависимые дегидрогеназы. От NADH и FADH2 электроны и протоны передаются на убихинон и далее через цепь цитохромов к молекулярному кислороду. До сих пор точно неизвестно, каким образом расположены все переносчики электронов дыхательной цепи. Однако установлено, что в расположении дыхательных комплексов существует определённая асимметрия: некоторые из белков-переносчиков находятся ближе к той стороне внутренней мембраны, которая обращена к матриксу, а другие - к противоположной; некоторые белки пронизывают мембрану насквозь § Комплекс I (НАДН дегидрогеназа) окисляет НАД-Н, отбирая у него два электрона и перенося их на растворимый в липидах убихинон, который внутри мембраны диффундирует к комплексу III. Вместе с этим, комплекс I перекачивает 4 протона из матрикса в межмембранное пространство митохондрии. § Комплекс II (Сукцинатдегидрогеназа) не перекачивает протоны, но обеспечивает вход в цепь дополнительных электронов за счёт окисления сукцината. § Комплекс III (Цитохром bc1 комплекс) переносит электроны с убихинола на два водорастворимых цитохрома с, расположенных на внутренней мембране митохондрии.Убихинол передаёт 2 электрона, а цитохромы за один цикл переносят по одному электрону. При этом туда также переходят 2 протона убихинола и перекачиваются комплексом. § Комплекс IV (Цитохром c оксидаза) катализирует перенос 4 электронов с 4 молекул цитохрома на O2 и перекачивает при этом 4 протона в межмембранное пространство. Комплекс состоит из цитохромов А и А3, которые, помимо гема, содержат ионы меди. Ингибиторы I комплекса — барбитураты, ротенон, пиерицидин Ингибитор II комплекса — малонат. Ингибитор III комплекса — антимицин А, миксотиазол, стигматтелин Ингибиторы IV комплекса — сероводород, цианиды, угарный газ, оксид азота. Дыхательная цепь включает множество белков-переносчиков Всего цепь переноса электронов (англ. electron transport chain) включает в себя разнообразные белки, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ. 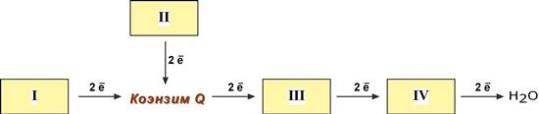 Блок-схема дыхательной цепи Строение ферментативных комплексов дыхательной цепи 1 комплекс. НАДН-КоQ-оксидоредуктаза Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН, 42 белковых молекулы, из них не менее 6 железосерных белков. Функция Принимает электроны от НАДН и передает их на коэнзим Q (убихинон). Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. Железосерные белки (FeS-белки) – это белки содержащие атомы железа, которые соединены с атомами серы и с серой остатков цистеина. В результате образуется железо-серный центр. 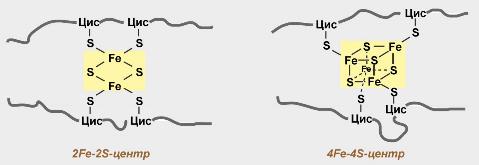 2 комплекс. ФАД-зависимые дегидрогеназы Данный комплекс как таковой не существует, его выделение условно. К нему относятся ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (β-окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса атомов водорода). Функция Восстановление ФАД в окислительно-восстановительных реакциях. Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q (убихинон). 3 комплекс. КоQ-цитохром c-оксидоредуктаза По другому данный комплекс называется цитохром с редуктаза. В его составе имеются молекулы цитохрома b и цитохрома c1, железо-серные белки. Комплекс представляет собой 2 мономера, в каждом из которых насчитывается 11 полипептидных цепей. Функция Принимает электроны от коэнзима Q и передает их на цитохром с. Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. Имеются разногласия по поводу количества переносимых ионов H+ при участии 3-го и 4-го комплексов. По одним данным, третий комплекс переносит 2 иона H+ и четвертый комплекс переносит 4 иона H+. По другим авторам, наоборот, третий комплекс переносит 4 иона H+ и четвертый комплекс переносит 2 иона H+. 4 комплекс. Цитохром с-кислород-оксидоредуктаза В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, состоит из 13 субъединиц. В комплексе имеются ионы меди, соединенные с белками комплекса через HS-группы цистеина, и формирующие центры, подобные тем, что имеются в железо-серных белках. Функция Принимает электроны от цитохрома с и передает их на кислород с образованием воды. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 5 комплекс Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы: одна группа формирует субъединицу Fo (произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс. другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ. Механизм работы АТФ-синтазы получил название вращательный катализ. Упрощенно считают, что для синтеза 1 молекулы АТФ необходимо прохождение через АТФ-синтазу приблизительно 3-х ионов Н+, и еще один ион H+ используется для транспорта неорганического фосфата в матрикс митохондрии и для антипорта АДФ (в митохондрию) ↔ АТФ (в цитозоль). Таким образом, для получения одной молекулы АТФ из АДФ требуется 4 иона Н+. Поскольку при прохождении одной пары электронов по всей дыхательной цепи выкачивается 10 ионов Н+, то окисление одного моля НАДН+Н+ приведет к образованию 2,5 молей АТФ. 3 вопрос: Разность редокс-потенциалов как движущая сила переноса электронов по главной цепи, высвобождение энергии в ходе движения электронов по дыхательной цепи. Поэтапное «контролируемое сгорание» достигается путём промежуточного включения дыхательных ферментов, обладающих различным редокс-потенциалом. Редокс-потенциал (окислительно-восстановительный потенциал) определяет направление переноса протонов и электронов ферментами дыхательной цепи (рис.1). Редокс-потенциал выражается значением электродвижущей силы (в вольтах), которая возникает в растворе между окислителем и восстановителем, присутствующих в концентрации 1,0 моль/л при 25˚ С (при рН=7,0 оба находятся в равновесии с электродом, который может обратимо принимать электроны от восстановителя). При рН=7,0 редокс-потенциал системы Н2 /2Н++2ē равен – 0,42 v. Знак – означает, что данная редокс-пара легко отдаёт электроны, т.е. играет роль восстановителя, знак + указывает на способность редокс-пары принимать электроны, т.е. играть роль окислителя. Например, редокс-потенциал пары НАДН∙Н+/ НАД+ равен – 0,32 v, что говорит о высокой её способности отдавать электроны, а окислительно-восстановительная пара ½О2 /Н2О имеет наибольшую положительную величину +0,81 v, т.е. кислород обладает наивысшей способностью принимать электроны. В процессе окисления АцКоА в ЦТК, восстановленные формы НАДН2 и ФАДН2 поступают в ДЦ, где энергия электронов и протонов трансформируется в энергию макроэргических связей АТФ. ДЦ - совокупность дегидрогеназ, которые транспортируют электороны и протоны с субстрата на кислород. Принципы функционирования ДЦ основаны на 1-ом и 2-ом законах термодинамики. Движущей силой ДЦ является разность ОВП. Суммарная разность всей ДЦ составляет 1,1 В. Пункты фосфорилирования должны иметь перепад ОВП = 0,25 - 0,3 В. 1. Пара НАД-Н имеет ОВП = 0,32 В. 2. Пара Q-b - / - /- - 0 В. 3. O2 - имеет +0,82 В. ДЦ локализуется во внутренней мембране митохондрий и имеет 2 пути введения электронов и протонов или 2 входа; ДЦ образует 4 комплекса. 1 вход: НАД-зависимый (поступают электроны и протоны со всех НАД-зависимых реакций). 2 вход: ФАД-зависимый НАД ---->ФП Q --->b--->c1--->c--->aa3---->1/2O2 Янтарная кислота ---->ФП 4 вопрос: Окислительное фосфорилирование, как механизм аккумуляции энергии, выделяющейся при работе главной дыхательной цепи. Окислительное фосфорилирование – это многоэтапный процесс, происходящий во внутренней мембране митохондрий и заключающийся в окислении восстановленных эквивалентов (НАДН и ФАДН2) ферментами дыхательной цепи и сопровождающийся синтезом АТФ.Впервые механизм окислительного фосфорилирования был предложен Питером Митчеллом. Согласно этой гипотезе перенос электронов, происходящий во внутренней митохондриальной мембране, вызывает выкачивание ионов Н+ из матрикса митохондрий в межмембранное пространство. Это создает градиент концентрации ионов Н+ между цитозолем и замкнутым внутримитохондриальным пространством. Ионы водорода в норме способны возвращаться в матрикс митохондрий только одним способом – через специальный фермент, образующий АТФ – АТФ-синтазу. По современным представлениям внутренняя митохондриальная мембрана содержит ряд мультиферментных комплексов, включающих множество ферментов. Эти ферменты называют дыхательными ферментами, а последовательность их расположения в мембране – дыхательной цепью или электрон-транспортной цепью (англ. electron transport chain). Принцип работы дыхательной цепи В целом работа дыхательной цепи заключается в следующем: Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи. Электроны движутся по ферментам дыхательной цепи и теряют энергию. Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство. В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды. Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу. При этом они теряют энергию, которая используется для синтеза АТФ. 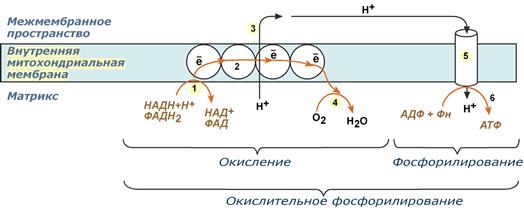 Общая схема окислительного фосфорилирования Таким образом, восстановленные формы НАД и ФАД окисляются ферментами дыхательной цепи. Благодаря этому происходит присоединение фосфата к АДФ, т.е. фосфорилирование. Поэтому весь процесс целиком получил название окислительное фосфорилирование. 5 вопрос: основные пути образования АТФ в клетке и пути ее использования Способы получения энергии в клетке В клетке существуют четыре основных процесса, обеспечивающих высвобождение энергии из химических связей при окислении веществ и ее запасание: 1. Гликолиз (2 этап биологического окисления) – окисление молекулы глюкозы до двух молекул пировиноградной кислоты, при этом образуется 2 молекулы АТФ и НАДН. Далее пировиноградная кислота в аэробных условиях превращается в ацетил-SКоА, в анаэробных условиях – в молочную кислоту. 2. β-Окисление жирных кислот (2 этап биологического окисления) – окисление жирных кислот до ацетил-SКоА, здесь образуются молекулы НАДН и ФАДН2. Молекулы АТФ "в чистом виде" не появляются. 3. Цикл трикарбоновых кислот (ЦТК, 3 этап биологического окисления) – окисление ацетильной группы (в составе ацетил-SКоА) или иных кетокислот до углекислого газа. Реакции полного цикла сопровождаются образованием 1 молекулы ГТФ (что эквивалентно одной АТФ), 3 молекул НАДН и 1 молекулы ФАДН2. 4. Окислительное фосфорилирование (3 этап биологического окисления) – окисляются НАДН и ФАДН2, полученные в реакциях катаболизма глюкозы, аминокислот и жирных кислот. При этом ферменты дыхательной цепи на внутренней мембране митохондрий обеспечивают образование большей части клеточного АТФ. Два способа синтеза АТФ В клетке постоянно происходит использование всех нуклеозидтрифосфатов (АТФ, ГТФ, ЦТФ, УТФ, ТТФ) как донора энергии. При этом АТФ является универсальным макроэргом, участвующим практически во всех сторонах метаболизма и деятельности клетки. И именно за счет АТФ обеспечивается фосфорилирование нуклеотидов ГМФ и ГДФ, ЦДФ, УМФ и УДФ, ТМФ и ТДФ до нуклеозидтрифосфатов. У других нуклеозидтрифосфатов существует некая специализация. Так, УТФ участвует в обмене углеводов, в частности в синтезе гликогена. ГТФ задействован в рибосомах, участвует в образовании пептидной связи в белках. ЦТФ используется в синтезе фосфолипидов. 1. Основным способом получения АТФ в клетке является окислительное фосфорилирование, протекающее в структурах внутренней мембраны митохондрий. При этом энергия атомов водорода молекул НАДН и ФАДН2, образованных в гликолизе и ЦТК, при окислении жирных кислот и аминокислот, преобразуется в энергию связей АТФ. 2. Однако также есть другой способ фосфорилирования АДФ до АТФ – субстратное фосфорилирование. Этот способ связан с передачей макроэргического фосфата или энергии макроэргической связи какого-либо вещества (субстрата) на АДФ. К таким веществам относятся метаболиты гликолиза (1,3-дифосфоглицериновая кислота, фосфоенолпируват), цикла трикарбоновых кислот (сукцинил-SКоА) и резервный макроэрг креатинфосфат. Энергия гидролиза их макроэргической связи выше, чем 7,3 ккал/моль в АТФ, и роль указанных веществ сводится к использованию этой энергии для фосфорилирования молекулы АДФ до АТФ. Классификация макроэргов Макроэргические соединения классифицируются по типу связи, несущей дополнительную энергию: 1. Фосфоангидридная связь. Такую связь имеют все нуклеотиды: нуклеозидтрифосфаты (АТФ, ГТФ, ЦТФ, УТФ, ТТФ) и нуклеозиддифосфаты (АДФ, ГДФ, ЦДФ, УДФ, ТДФ). 2. Тиоэфирная связь. Примером являются ацил-производные коэнзима А: ацетил-SКоА, сукцинил-SКоА, и другие соединения любой жирной кислоты c HS-КоА. 3. Гуанидинфосфатная связь – присутствует в креатинфосфате, запасном макроэрге мышечной и нервной ткани. 4. Ацилфосфатная связь. К таким макроэргам относится метаболит гликолиза 1,3-дифосфоглицериновая кислота (1,3-дифосфоглицерат). Она обеспечивает синтез АТФ в реакции субстратного фосфорилирования. 5. Енолфосфатная связь. Представитель – фосфоенолпируват, метаболит гликолиза. Он также обеспечивает синтез АТФ в реакции субстратного фосфорилирования в гликолизе. 6 вопрос: Ингибиторы ферментативных комплексов цепи дыхательных ферментов. Ряд веществ может ингибировать ферменты дыхательной цепи и блокировать движение электронов от НАДН и ФАДН2 на кислород. В результате прекращается движение электронов, выкачивание ионов Н+ и работа АТФ-синтазы. Синтез АТФ резко снижается, метаболизм в клетке нарушается вплоть до ее гибели. Выделяют три основных группы ингибиторов: действующие на I комплекс, например, амитал (успокаивающее и снотворное средство), ротенон (пестицид широкого спектра), действующие на III комплекс, например, антимицин А (экспериментальный антибиотик), действующие на IV комплекс, например, сероводород (H2S), угарный газ (СО), цианиды (-CN). 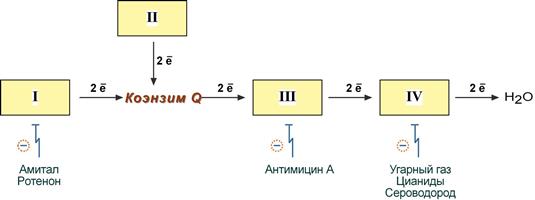 Ингибиторы ферментов дыхательной цепи Ротенон - растительный пестицид из семян и стеблей некоторых растений. Он малоопасен для человека, поскольку плохо всасывается в желудочно-кишечном тракте, и быстро разлагается на солнечном свете. Но умышленное поглощение ротенона может быть смертельным. Амитал, Амитал натрия - производное барбитуровой кислоты из серии средств, которые ранее широко использовались в качестве успокоительных и снотворных, но из-за ряда причин, в том числе узкого терапевтического диапазона, развития привыкания и зависимости, были заменены на более безопасные средства. Антимицины - группа вторичных метаболитов, синтезируемых бактериями рода Streptomyces, обладающих антигрибковой активностью. Как активный компонент используется в рыбоводстве. 7 вопрос: Разобщение окисления и фосфорилирования. Механизмы разобщения. Химические соединения – разобщители. Процесс окисления создает электрохимический потенциал, а процесс фосфорилирования его использует. Таким образом, электрохимический потенциал обеспечивает сопряжение (связывание) процессов окисления и фосфорилирования (окислительного фосфорилирования). Так как необходимый для сопряжения электрохимический потенциал создают I, III и IV комплексы дыхательной цепи, их называют пунктами сопряжения окисления и фосфорилирования. Повреждение внутренней мембраны митохондрий или увеличение ее проницаемости под действием разобщителей вызывает исчезновение электрохимического потенциала, разобщение процессов окисления и фосфорилирования, и прекращение синтеза АТФ. Разобщение дыхания и фосфорилирования называют явление исчезновения на мембране электрохимического потенциала под действием разобщителей и прекращение синтеза АТФ. Убедительные экспериментальные доказательства в пользу описанного механизма сопряжения дыхания и фосфорилирования были получены с помощью ионофоров. Молекулы этих веществ, как правило, липофильны и способны переносить ионы через мембрану. Например, 2,4-динитрофенол (протонофор) легко диффундирует через мембрану, в ионизированной и неионизированной форме, перенося протоны в сторону их меньшей концентрации в обход протонных каналов. Таким образом, 2,4-динитрофенол уничтожает электрохимический потенциал, и синтез АТР становится невозможным, хотя окисление субстратов при этом происходит. Энергия дыхательной цепи в этом случае полностью рассеивается в виде теплоты. Этим объясняется пирогенное действие разобщителей. Разобщающим действием обладают гормон щитовидной железы – тироксин, а также некоторые антибиотики, такие как валиномицин и грамицидин. Разобщителями являются вещества, которые могут переносить протоны (протонофоры) или другие ионы (ионофоры) через мембрану минуя каналы АТФ-синтетазы. В результате разобщения количество АТФ снижается, АДФ увеличивается, возрастает скорость потребления О2, окисления НАДН2, ФАДН2, а образовавшаяся свободная энергия выделяется в виде теплоты. Как правило, разобщители — липофильные вещества, легко проходящие через мембраны. Например, вещество 2,4-динитрофенол (переносит Н+), лекарство – дикумарол, метаболит – билирубин, гормон щитовидной железы – тироксин, антибиотики – валиномицин и грамицидин. Окислительное фосфорилирование. Вещества-разобщители процессов окисления и фосфорилирования Они не прекращают процессов окисления, но снижают синтез АТФ. Дыхательная цепь работает, а АТФ при этом синтезируется в меньшем количестве, чем в норме. Тогда энергия, получаемая при переносе электронов по цепи МтО, выделяется в виде тепла. Такое состояние, когда происходит окисление субстратов, а фосфорилирование (образование АТФ из АДФ и Ф) не идет, называется РАЗОБЩЕНИЕМ ОКИСЛЕНИЯ И ФОСФОРИЛИРОВАНИЯ. К такому состоянию может приводить действие веществ-разобщителей: 2,4-ДИНИТРОФЕНОЛ, открытый в 1944 году Липманом, при введении в организм повышает температуру тела и понижает синтез АТФ. Это вещество, наряду с другими, открытыми позже, пытались использовать для лечения ожирения, но безуспешно. Механизм действия веществ-разобщителей становится понятням только с точки зрения хемиоосмотической теории. Разобщители являются слабыми кислотами, растворимыми в жирах. В межмембранном пространстве они связывают протоны, и затем диффундируют в матрикс, тем самым снижая DmH+. Подобным действием обладает и йодсодержащие гормоны щитовидной железы – тироксин и трийодтиронин. При состояниях, сопровождающихся гиперфункцией щитовидной железы (например, Базедова болезнь), больным не хватает энергии АТФ: они много едят (нужно большое количество субстратов для окисления), но при этом теряют в весе. Большая часть энергии выделяется в виде тепла. На всех этапах трансформации энергии пищевых веществ в энергию АТФ часть энергии рассеивается в форме теплоты. При использовании АТФ для совершения работы значительная часть энергии также превращается в теплоту. Однако существуют специальные механизмы, участвующие в поддержании температуры тела. Разобщители - липофильные вещества, которые способны принимать протоны и переносить их через внутреннюю мембрану митохондрий, минуя ее протонный канал. Разобщители бывают: - естественные – продукты перекисного окисления липидов, жирных кислот с длинной цепью, большие дозы тиреоидных гормонов; - искусственные - динитрофенол, эфир, производные витамина K, анестетики, антибиотики (грамицидин, валиномицин). Динитрофенол способен диффундировать через митохондриальную мембрану как в ионизированной, так и в неионизированной форме и может переносить ионы водорода через мембрану. Поэтому динитрофенол уничтожает ΔрН митохондриальной мембраны. Потребление кислорода и окисление субстратов при этом продолжаются, но синтез АТФ невозможен. Поскольку энергия окисления при разобщении рассеивается в форме теплоты, то разобщители повышают температуру тела (пирогенное действие). Существует особая ткань, специализирующаяся на теплопродукции посредством разобщенного дыхания. Это бурый жир. Своим названием он обязан большому количеству митохондрий (они коричневого цвета). Около 10% всех белков этих митохондрий приходится на так называемый разобщающий белок. Бурый жир участвует в поддержании температуры тела. Островки бурой жировой ткани облегают крупные кровеносные сосуды, идущие к головному мозгу. Особенно много этой ткани у новорожденных. С возрастом ее количество уменьшается.  |
