Экзаменационный билет №9
1 Вопрос
1. Специфичность - одно из наиболее выдающихся качеств ферментов. Было сделано наблюдение, что очень близкие по структуре вещества - пространственные изомеры (альфа- и бета-метилглюкозиды) расщепляются по эфирной связи двумя совершенно разными ферментами. Таким образом, ферменты могут различать химические соединения, отличающиеся друг от друга очень незначительными деталями строения, такими, например, как пространственное расположение метоксильного радикала и атома водорода при 1-м углеродном атоме молекулы метилглюкозида. По образному выражению, нередко употребляемому в биохимической литературе, фермент подходит к субстрату, как ключ к замку. Специфичность действия фермента предопределяется строгим соответствием геометрической структуры субстрата и активного центра фермента.
В 50-е годы нашего столетия это статическое представление было заменено гипотезой Д. Кошланда об индуцированном соответствии субстрата и фермента. Сущность ее сводится к тому, что пространственное соответствие структуры субстрата и активного центра фермента создается в момент их взаимодействия друг с другом, что может быть выряжено формулой “перчатка - рука”. При этом в субстрате уже деформируются некоторые валентные связи и он, таким образом, подготавливается к дальнейшему каталитическому видоизменению, а в молекуле фермента происходят конформационные перестройки. Гипотеза Кошланда, основанная на допущении гибкости активного центра фермента, удовлетворительно объясняла активирование и ингибирование действия ферментов и регуляцию их активности при воздействии различных факторов. В частности, конформационные перестройки в ферменте в процессе изменения его активности Кошланд сравнивал с колебаниями паутины, когда в нее попала добыча (субстрат), подчеркивая этим крайнюю лабильность структуры фермента в процессе каталитического акта. В настоящее время гипотеза Кошланда постепенно вытесняется гипотезой топохимического соответствия. Сохраняя основные положения гипотезы взаимоиндуцированной настройки субстрата и фермента, она фиксирует внимание на том, что специфичность действия ферментов объясняется в первую очередь узнаванием той части субстрата, которая не изменяется при катализе. Между этой частью субстрата и субстратным центром фермента возникают многочисленные точечные гидрофобные взаимодействия и водородные связи.
Ряд факторов влияет на скорость ферментативной реакции, и некоторые из них оказывают глубокое влияние; таковы концентрация субстрата, концентрация фермента, концентрация ионов водорода или электролита, присутствие активаторов и ингибиторов и температура.
С увеличением концентрации фермента скорость реакции возрастает. При низких концентрациях фермента возрастание скорости прямо пропорционально концентрации фермента. Если количество фермента превышает определённую величину, то прямая пропорциональность нарушается, и скорость увеличивается медленнее, чем концентрация фермента.
Так как ферменты являются белками и имеют характер амфолитов, то следует ожидать, что концентрация ионов водорода (кислотность) будет оказывать значительное влияние на активность ферментов. Действительно, каждый фермент имеет свой оптимум pH для проявления своей максимальной активности. Оптимум pH может зависеть от типа применяющегося буфера – фосфатного, ацетатного, цитратного и т.п
Зависимость активности ферментов (скорости реакции) от температуры описывается колоколообразной кривой с максимумом скорости при значениях оптимальной температуры для данного фермента. Повышение скорости реакции при приближении к оптимальной температуре объясняется увеличением кинетической энергии реагирующих молекул.
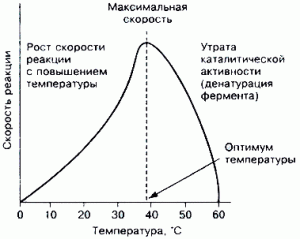
Закон о повышении скорости реакции в 2-4 раза при повышении температуры на 10°С справедлив и для ферментативных реакций, но только в пределах до 55-60°С, т.е. до температур денатурации белков. При понижении температуры активность ферментов понижается, но не исчезает совсем.
Вещества, которые оказывают влияние на активность ферментов, называют эффекторами. Это могут быть ингибиторы – соединения, тормозящие каталитический процесс, или активаторы – вещества, которые этот процесс ускоряют.
I класс – оксидоредуктазы - ферменты, катализирующие окислительно-восстановительные реакции.
Схематично действие ферментов I класса можно записать:
 A + B C + D A + B C + D
II класс – трансферазы – ферменты, катализирующие перенос химических группировок с молекулы одного вещества на молекулу другого:
 AB + C A + BC AB + C A + BC
III класс – гидролазы – ферменты, расщепляющие химические связи путем присоединения воды, т.е. путем гидролиза:
 AB + H2O A-H + B-OH AB + H2O A-H + B-OH
IV класс - лиазы – ферменты, катализирующие расщепление химических связей без присоединения воды:
 AB A + B AB A + B
V класс - изомеразы - ферменты, катализирующие изомерные превращения, т.е. перенос отдельных химических групп в пределах одной молекулы:
 A B A B
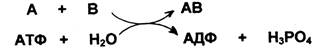
VI класс - синтетазы - ферменты, катализирующие реакции синтеза, протекающие за счет энергии гидролиза АТФ:
Каждый класс, в свою очередь, делится на подклассы, внутри подклассов выделены подподклассы. Каждый подподкласс содержит список индивидуальных ферментов в строго определенной последовательности, которая не изменяется, а лишь продлевается по мере открытия новых ферментов.
Классификацией ферментов тесно связана их индексация (нумерация). Индекс (шифр) каждого фермента состоит из четырех чисел, разделенных точками, и составляется по следующему принципу:
Первая цифра индекса указывает к какому из шести классов принадлежит данный фермент. Второе и третье числа индекса обозначают соответственно порядковые номера подклассов и подподклассов. Четвертое число индекса –порядковый номер индивидуального фермента внутри своего подподкласса.
Например, фермент слюны – амилаза, расщепляющий крахмал, имеет индекс 3.2.1.1., что свидетельствует о принадлежности этого фермента к классу гидролаз.
2 вопрос
К основным компонентам плазмы относятся вода (90—92%), белки (7—8%), минеральные вещества (0,9%) и глюкоза (0,1%). Плазма крови имеет слабощелочную реакцию, ее pH = 7,36.
В нормальной крови человека основную массу (80—90 %) составляют эритроциты двояковогнутой формы — дискоциты.
Плазмолемма эритроцита состоит из бислоя липидов и белков, представленных приблизительно в равных количествах, а также небольшого количества углеводов, формирующих гликокаликс. Большинство липидных молекул, содержащих холин (фосфатидилхолин, сфин-гомиелин), расположены во внешнем слое плазмолеммы, а липиды, несущие на конце аминогруппу (фосфатидилсерин, фосфатидилэтаноламин), лежат во внутреннем слое. Часть липидов ( 5 %) наружного слоя соединены с молекулами олигосахаров и называются гликолипидами. Распространены мембранные гликопротеины — гликофорины. С ними связывают антигенные различия между группами крови человека.
Цитоплазма эритроцита состоит из воды (60 %) и сухого остатка (40 %), содержащего около 95 % гемоглобина и 5 % других веществ. Наличие гемоглобина обусловливает желтую окраску отдельных эритроцитов свежей крови, а совокупность эритроцитов — красный цвет крови. При окрашивании мазка крови азур П-эозином по Романовскому —Гимзе большинство эритроцитов приобретают оранжево-розовый цвет (оксифильны), что обусловлено высоким содержанием в них гемоглобина.
Кислород, поступающий из альвеолярного воздуха в кровь, связывается с гемоглобином эритроцитов, образуя так называемый оксигемоглобин, и в таком виде доставляется к тканям. В тканевых капиллярах кислород отщепляется и переходит в ткани, где включается в окислительные процессы. Свободный гемоглобин связывает водород и превращается в так называемый восстановленный гемоглобин. Углекислый газ, образующийся в тканях, переходит в кровь и поступает в эритроциты. Затем часть углекислого газа соединяется с восстановленным гемоглобином, образуя так называемый карбгемоглобин, и в таком виде углекислый газ и доставляется к легким. Однако большая часть углекислого газа в эритроцитах при участии фермента карбоангидразы превращается в бикарбонаты, которые переходят в плазму и транспортируются к лёгким.
Лимфоциты- составляют 20-45% от общего числа лейкоцитов. Играют центральную роль во всех иммунологических реакциях. Продолжительность жизни достаточна велика, от нескольких месяцев до нескольких лет.
В – лимфоциты – (менее 10% лимфоцитов крови). Активизируются под действием антигена и дифференцируются в плазматические клетки, против конкретных антигенов соответствующие антитела.
Т – лимфоциты – (80% и более). Главная функция Т-лимфоцитов – участие в клеточном и гуморальном иммунитете. Т-лимфоциты уничтожают аномальные клетки своего организма, участвуют в аллергических реакциях, отторжении чужеродного трансплантата.
NK - клетки (натуральные киллеры) – 5 - 10% всех лимфоцитов, уничтожают трансформированные, инфицированные вирусами и чужеродные клетки.
Свертывание крови представляет собой сложную сеть биохимических реакций, активирующуюся при нарушении целостности сосудистой системы. Целью работы свертывания является управляемый локальный переход плазмы крови из жидкого состояния в желеобразное и, как результат, остановка кровотечения. Любые нарушения в тонком балансе этой системы ведут к тяжелым последствиям, связанным с тромбозами или с кровоточивостью.
Кислотно-щелочное равновесие в крови является жизненно важным параметром, нормальные значения которого составляют 7,35 – 7,45 по шкале рН. Отклонение рН ниже 7,35 свидетельствует об ацидозе. При смещении рН выше 7,45 возникае алкалоз.
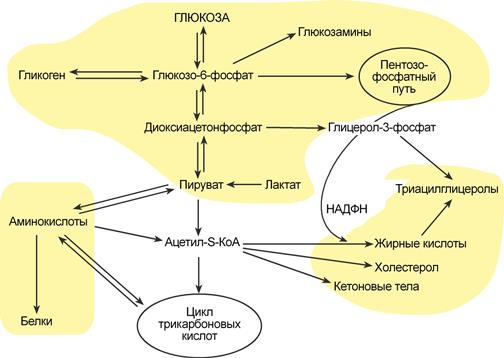
3 Вопрос
 |
 Скачать 282.18 Kb.
Скачать 282.18 Kb.



