1 зертханалы жмыс Бейорганикалы осылыстарды кластары Жмысты масаты
 Скачать 0.7 Mb. Скачать 0.7 Mb.
|
|
қолданбалы химия кафедрасы г) әлсiз қышқылдарды алу. Бiр пробиркаға 2-3 мл натрий карбонатының ерітiндiсiн, екiншi пробиркаға натрий ацетаты ерітiндiсiн құйыңыз. Екi пробиркаға да тұз қышқылы ертiндiсiн қосыңыз. Бiрiншi пробиркада қандай газ бөлiнедi? Иісiнен екiншi пробиркада қандай қышқыл түзiлгенiн байқауға болады? д) қиын еритiн тұздарды алу. Пробиркаға 1-2 мл қорғасын нитратын құйыңыз, содан кейін натрий хлоридін қосыңыз. Түзiлген тұнбаның түсiн байқаңыз. Тұнбаға калий иодидiн қосыңыз. Тұнба түсi қалай өзгередi? Алынған тұнбаға аммоний сульфидің қосыңыз. Тұнбаның түсін байқаңыз. ЕК-дi пайдаланып осы реакциялардың теңдеулерін жазыңыз. Жұмысты өңдеу Лабораториялық дәптерге барлық жасалған реакциялардың теңдеулерін молекулалық және иондық түрiнде жазыңыз. Әлсiз электролиттер мен қиын еритiн қосылыстардың (еру кестесі) формулаларының қасына Кд және ЕК мәнiн жазып қойыңыз. Бақылау сұрақтары
Қолданбалы химия кафедрасының 26.08.2014 ж. отырысында №1 бұйрықпен бекітілді қолданбалы химия кафедрасы № 7 зертханалық жұмыс Тұздар гидролизi  Жұмыстың мақсаты Тұздардың гидролиздену реакцияларын зерттеу, ортаның рН-өзгерiсін және гидролиздiң температура мен сұйылтуға тәуелді екенін байқау. Жұмыстың мазмұны а) Гидролиз кезiнде қышқылдық тұздардың түзiлуi. б) Гидролиз кезiнде негiздік тұздардың түзiлуi. в) Бiрнеше тұздардың бірге гидролизденуi. г) Температура мен сұйылтудың гидролизге әсерi. Жұмыстың теориялық негізі Гидролиз деп тұз иондары мен су иондарының арасындағы реакцияны айтады. Реакция нәтижесiнде әлсiз электролиттер түзiледі және ерітiндi ортасының рН өзгереді. I-жағдай. Күштi негiзден және әлсiз қышқылдан түзiлген тұздың гидролизi әлсiз қышқылдың анионы арқылы жүредi: СО32- + НОН Na2CO3 + HOH II-жағдай. Әлсiз негiзден және күштi қышқылдан түзiлген тұздың гидролизi әлсіз негіздің катионы арқылы жүредi: АI3+ + НОН АIСI3 + НОН III-жағдай. Әлсiз қышқылдан және әлсiз негiзден түзiлген тұздың гидролизi катион және анион арқылы жүреді. NН+4 + СН3СОО- + НОН NН4СН3СОО + НОН IV-жағдай. Әлсiз негiзден және әлсiз қышқылдан түзiлген тұздың гидролизi бiр саты бойынша жүретін қайтымсыз процес, егер реакция нәтижесiнде түзiлген заттың бiрi газ күйiнде болса: АI2S3 + 6HOH V-жағдай. Бiрнеше тұздардың бірге гидролизі нәтижесiнде суда ерімейтiн немесе суда кездеспейтiн қосылыстар түзiледi. АI2(SО4)3 + 3Nа2СО3 + 6HOH = 2АI(ОН)3 2АI3+ + 3СО32- + 6НОН = 2АI(ОН)3 қолданбалы химия кафедрасы Барлық тәжiрибеде жүрген гидролиз реакцияларының молекулалық және иондық теңдеулерін жазыңыз, ортаның рН-н және әлсiз электролиттердiң Кд-н көрсетiңiз (кесте). 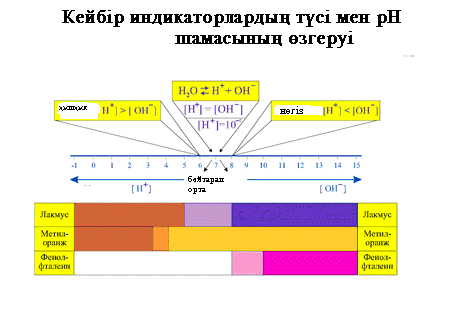  Қолданылатын реактивтер: Тұздар: калий карбонаты, натрий сульфиты, алюминий хлоридi, магний хлоридi, натрий ацетаты, сурьманың қаныққан ерiтiндiсi, дистилленген су, индикаторлар. Жұмыстың барысы 1- тәжiрибе. Гидролиз нәтижесiнде қышқылдық тұздардың түзiлуi. Екi пробиркаға 2-3 мл дистилденген су құйып, 1-2 тамшы фенолфталеин тамызыңыз және микрошпателмен төменгi тұздардың түйірлерін салыңыз: қолданбалы химия кафедрасы 1-шi пробиркаға калий карбонатын, 2-ге натрий сульфитiн. Әлсiз қышқылдардың диссоциациялану константасын пайдаланып гидролиз реакциясының теңдеуінің бiрiншi сатысын жазыңыз. Қандай тұздың ерiтiндiсiнде фенолфталеиннің бояуы ашық болады? Қандай ерiтiндiде ОН--иондарының концентрациясы жоғарылау болады? Қандай тұздың гидролиздену дәрежесi жоғары болады? 2- тәжiрибе. Гидролиз нәтижесiнде негiздік тұздардың түзiлуi Екi пробиркаға 3-4 мл дистилленген су құйып, келесi тұздарды ерітiңiз: 1-шi пробиркаға - магний хлоридiн, 2-шi пробиркаға - алюминий хлоридiн салып, универсалды индикатор қағазымен ерітіндінің ортасын анықтаңыздар. Қайсысының рН-ы жоғары болады? 3- тәжiрибе. Екi тұздың бiрге гидролизі Бiр пробиркаға 6-8 тамшы алюминий хлоридiн құйыңыз. Оған сонша тамшы натрий карбонатын құйыңыз. Пробиркада көмiртегi(IV) оксидiнiң бөлiнетiнін байқаңыз. Осы жағдайда алюминий гидроксидiнiң тұнбасы түзiледi. Не себептен алюминий карбонаты түзiлмейдi? 4- тәжiрибе. Температураның гидролиздену дәрежесiне әсерi Пробирканың жартысына 1/3 дейiн дистилленген су құйыңыз және оған микрошпателмен 2-3 түйір натрий ацетатын салыңыз. Ерiтiндiнiң рН мәнi қаншаға тең? Пробиркаға 1-тамшы фенолфталеин қосыңыз. Пробирканы ыстық су моншасына салыңыз. Фенолфталеиннің түсi қалай өзгередi? Гидролиз процесінің тепе-теңдiгi қандай бағытта ығысады? Осы құбылыстың себептерін көрсетіңіз. 5- тәжiрибе. Ерiтiндiнi сұйылтудың гидролиздену дәрежесiне әсерi Пробиркаға 2-3 тамшы сурьма(III) хлоридiн құйыңыз оған ақ тұнба сурьма хлороксидi - SbОСI пайда болғанша бiртiндеп тамшылатып су құйыңыз. Бұл тұнба гидролиздiң үшінші сатысында су молекуласы бөлiнiп шығуы нәтижесiнде пайда болады. Түзiлген тұнбаны қалай ерiтуге болады, яғни гидролиздiң иондық тепе-теңдiгiн қалай сол жаққа қарай ығыстыруға болады? Жұмысты өңдеу Лабораториялық дәптерге барлық жасалған реакциялардың теңдеулерін молекулалық және иондық түрiнде жазыңыз. Ортаның рН-ын көрсетіңіздер. Бақылау сұрақтары
Қолданбалы химия кафедрасының 26.08.2014 ж. отырысында №1 бұйрықпен бекітілді қолданбалы химия кафедрасы № 8 зертханалық жұмыс Тотығу-тотықсыздандыру реакциялары Ж  ұмыстың мақсаты Тотығу-тотықсыздандыру реакцияларын жүргiзу. Элементтердiң тотығу дєрежесiн анықтау арқылы реакцияны электрондық баланс немесе иондық-электрондық әдiстері бойынша теңестiру. Тотығу-тотықсыздандыру реакциясының жүру жағдайларына тәуелді екенін зерттеу. Жұмыстың мазмұны а) Натрий сульфитінің калий перманганатымен әртүрлі ортада тотығуы. б) Аммоний дихроматының молекула ішілік тотығуы. в) Иодтың сілтілік ортада диспропорциялануы. Жұмыстың теориялық негізі Әрекеттесуші заттардың құрамына кіретін атомдардың тотығу дәрежелері өзгере жүретін реакцияларды тотығу-тотықсыздану реакциялары деп атайды. Электрондарын беретін молекулаларды, атомдарды немесе иондарды тотықсыздандырғыштар деп атайды. Реакция кезінде олар тотығады. Электрондарын қосып алатын молекулаларды, атомдарды немесе иондарды тотықтырғыштар деп атайды. Реакция кезінде олар тотықсызданады. Барлық тотығу-тотықсыздандыру реакциялардың теңдеуiн екi жолмен: электрондық баланс және жартылай иондық әдiспен көрсету керек. Мысалы: Zn0 + 2HCl Тотықсыздандырғыш: Zn0 -2е Тотықтырғыш: 2Н+ +2е Қажетті химиялық реактивтер:
Жұмыстың жүру барысы 1-тәжірибе. Натрий сульфитінің калий перманганатымен қышқыл ортада тотығуы. Пробиркаға 2-3 тамшы калий перманганатын тамызып, сондай мөлшерде 2н күкірт қышқылын, сонан кейін натрий сульфитін толық түсі жойылғанша құйыңдар. Марганец қышқыл ортада қандай тотығу дәрежесін көрсетеді? қолданбалы химия кафедрасы 2-тәжірибе. Натрий сульфитінің калий перманганатымен нейтрал (бейтарап) ортада тотығуы Пробиркаға 2-3 тамшы калий перманганатын тамызып, сондай мөлшерде натрий сульфитін қосыңдар. Қандай өзгеріс байқалды? Тұнбаға қандай қосылыс түсті? Ерітіндінің түсі қандай? Марганецтің нейтрал ортадағы тотығу дәрежесі неге тең? 3-тәжірибе. Натрий сульфитінің калий перманганатымен сілті ортада тотығуы Пробиркаға 2-3 тамшы натрий гидроксидін тамызып, сондай мөлшерде натрий сульфитін қосыңдар. Содан кейін 2-3-тамшы калий перманганатының ерітіндісін құйыңдар. Ерітіндінің түсі қандай түске боялды? 4-тәжірибе. Аммоний дихроматының молекула ішілік тотығу-тотықсыздануы Құрғақ пробиркаға 2-3 шпатель аммоний дихроматын салып, реакция басталып кеткенше қыздырыңдар. Одан кейін қыздыруды тоқтатыңдар. Реакция нәтижесінде түзілген өнімдерге назар аударыңыздар: азот және су буы, қатты хром оксиді. 5-тәжірибе. Иодтың сілтілік ортада диспропорциялануы Пробиркаға иодтың 1-2 түйірін салып, оған 1-2 мл натрий гидроксидін қосыңыз. Ерітіндінің түсі қалай өзгереді? Сілтілік ортада фтордан басқа барлық галогендерге диспропорциялану реакциясы тән болғандықтан, осы жағдайда натрий иодиді мен натрий иодататы түзіледі. Жұмысты өңдеу Лабораториялық журналға тәжірибеде қарастырылған химиялық теңдеулерді жазып, электрондық баланс және жартылай иондық әдіспен теңестіріңдер. Тотықтырғыш пен тотықсыздандырғыштарды табыңдар. Бақылау сұрақтары:
Қолданбалы химия кафедрасының 26.08.2014 ж. отырысында №1 бұйрықпен бекітілді қолданбалы химия кафедрасы № 9 зертханалық жұмыс Металдардың кернеу қатары және гальваникалықэлемент 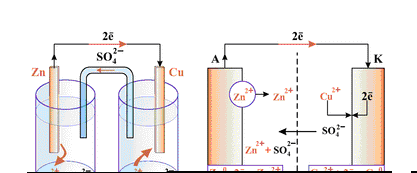 Жұмыстың мақсаты Металдардың кернеу қатарын және гальваникалық элементтің схемасы мен электр қозғаушы күшін оқып үйрену. Жұмыстың мазмұны а) металдардың кернеу қатары б) гальваникалық элементтің құрлысымен танысу Қолданатын реактивтер мен аспаптар а) мырыш түйіршігі; б) мырыш, темір, қалайы, кадмий, қорғасын, мыс және күміс тұздарының ерітінділері; в) милливольтметр, мыс-мырыш электроды, агар-агар көпіршесі Теориялық бөлімі Кернеу қатары металдардың химиялық активтiгiн сипаттайды. Бұл қатардан үш маңызды салдарлар шығады:
қолданбалы химия кафедрасы Металдардың кернеу қатары 1-кесте.
Металл иондарының тотықтыру қасиетінің күшеюі ®
Металдар атомдарының тотықсыздандыру қасиетінің күшеюі ® 2. Кернеу қатарындағы әрбір металл өзінен кейін тұратын металдарды олардың тұздарының ерітінділерінен ығыстырады. Мысалы: мыс өзінен кейін тұратын күмісті оның тұзынан ығыстырады Cu0 + 2AgNO3 = Cu(NO3)2 + 2Ag0 3. Кернеу қатарындағы сутегінен бұрын тұратын металдардың барлығы ерітінділерден сутек ионын молекулалық түрінде ығыстырады. Гальваникалық элемент Гальваникалық элементте тотығу-тотықсыздандыру реакциясының энергиясы электр энергиясына айналады. Электр қозғаушы күштi тотықтырғыш пен тотықсыздандырғыш потенциалдарының айырымы арқылы табады. Кернеу қатарында металдар неғұрлым бiр-бiрiнен алыс тұрса, соғұрлым э.қ.к. жоғары болады. Жұмыстың барысы |
