тундыру. 11 сабақ практ Тундыру. 11 саба Тндыру титрлеуі. Титранттары. Индикаторлары. Комплексонометриялы титрлеу. Титранттар. Индикаторлар
 Скачать 348 Kb. Скачать 348 Kb.
|
V координаталарына орналастырады. |
| V(АgNO3), мл | 10 | 50 | 90 | 99 | 99,9 | 100 | 100,1 | 101 | 110 |
| рCl | 1 | 1,5 | 2,3 | 3,3 | 4,3 | 5 | 5,7 | 6,7 | 7,7 |
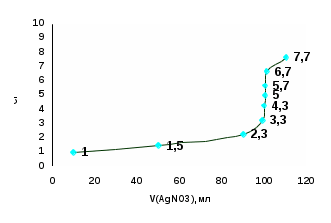
Титрлеу қисығын талдау. Титрлеу қисығының секіру интервалы ерітінділердің концентрациясына, тұнбаның ерігіштік көбейтіндісіне тәуелді. Ерітінділердің концентрациясы артқан сайын, секіру интервалы да артады. Мысалы, ерітінділердің концентрациялары 1н болса, онда секіру интервалы 3-7 аралығында, 0,1н болса 4-6 аралығында, ал 0,001н болса секіру интервалы болмайды. Неғұрлым тұнбаның ерігіштік көбейтіндісі - Кs төмен болса, соғұрлым секіру интервалы жоғары болады. Мысалы, КІ ерітіндісін АgNO3 ерітіндісімен титрлегенде (Кs = 8,3·10-17) секіру интервалы рІ = 4,7 - 11,4 аралығында, ал NaCl титрлегенде (Кs = 1·10-10) секіру интервалы рСІ = 4,3 - 5,7 аралығында жатады.
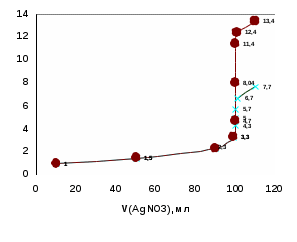
Тұндыру титрлеу тәсілінде Кs < 10-10 реакциялары пайдаланылады, тек осы жағдайда ғана титрлеу қисығының секіру интервалын анық байқауға болады. Келтірілген есептеулер көбіне жуықтап алынған мәндер, дұрысында тұнбаға түсу процестеріне адсорбция (қоса тұнбаға түсу) әсер етеді, бұл жағдайлар есепке алынбайды.
Титрлеудің соңғы нүктесін анықтау. Мор, Фаянс, Фольгард әдістері. Титрлеудің соңғы нүктесін анықтаудың бірнеше тәсілдері белгілі.
1) Индикаторсыз тәсіл немесе «Тең лайлану» (Гей-Люссак) тәсілі. Титрлеу аяқталуға жақындағанда ерітіндіден екі тамшы алып, біріншісіне NaCl екіншісіне АgNО3 қосады, егер эквиваленттік нүктеге жетпесе, ерітіндіде артық СІ- иондары болғандықтан, АgNО3 қосқан тамшы лайланады, ал NaCl қосқан тамшы өзгеріссіз қалады, эквиваленттік нүктеден кейін болса, ерітіндіде артық Аg+ иондары болғандықтан, NaCl қосқан тамшы лайланады, ал АgNО3 қосқан тамшы өзгеріссіз қалады. Ал эквиваленттік нүктеде түзілген АgCl-нің қаныққан ерітіндісінен (тұнба бетіндегі) алынған екі тамшы да біріншісіне NaCl екіншісіне АgNО3 қосқанда, екеуіде бірдей лайланады осы кезде титрлеуді тоқтатады.
«Тең лайлану» тәсілі ерітіндіден бірнеше сынама алуды қажет етеді, бірақ титриметриялық дәл тәсілдерге жатады, титрлеуді орындау аса ұқыптылықты қажет етеді. Сондықтан титрлеуді көбінесе индикаторлар пайдаланып орындайды.
2) Индикаторларды пайдаланып титрлеу тәсілдері. Бұл тәсілдерге Мор, Фаянс, Фольгард әдістері жатады.
Мор әдісі. Мор әдісінде (аргентометриялық әдіс) индикатор ретінде К2СrО4 ерітіндісі пайдаланылады. Титрлеуде жүретін реакция: NaCl + AgNO3 = AgCl↓ + NaNO3
Эквиваленттік нүктеде: К2СrО4 + 2AgNO3 = Ag2CrO4↓ + 2KNO3, Кs(Ag2CrO4) = 1·10-12
қызыл-қоңыр
Титрлеуде ақ түсті АgCl толық тұнбаға түскеннен кейін ғана Ag2CrO4 қызыл-қоңыр түсті тұнбасы түзіле бастайды. Себебі, тұнбалардың ерігіштіктері әртүрлі. Мысалы, 0,1 моль/л NаCl ерітіндісі АgNО3 ерітіндісімен титрленген, индикатор 0,01 моль/л К2СrО4 ерітіндісі. АgCl тұнбаға түсе бастау үшін ерітіндідегі күміс ионының концентрациясы болуы керек:
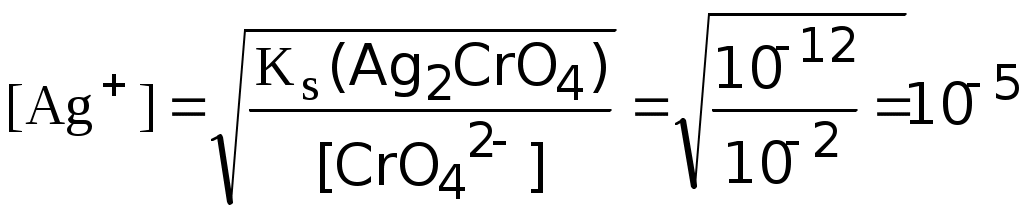 моль/л
моль/лСонымен Ag2CrO4 тұнбасына қарағанда АgCl бұрын тұнбаға түсе бастайды. АgNО3 ерітіндісімен титрлеп жатқандықтан ерітіндіде Аg+ иондарының концентрациясы артады, [Аg+][CІ-] = const. Титрлеудің соңында ерітіндідегі [Аg+] иондарының концентрациясы Ag2CrO4 тұнбаға түсуі үшін жеткілікті болады, яғни [Аg+] = 10-5 моль/л, осы кезден бастап Ag2CrO4 тұнбаға түсе бастайды. Ерітіндіні тұнбасымен араластырғанда қызыл-қоңыр түс пайда бола бастағанда титрлеуді аяқтайды. Бұл жағдайда CІ- иондары сан жағынан толық тұнбаға түседі. Мор әдісімен CІ-, Br- иондары анықталады, ал І-, SCN- иондарын анықтауға болмайды, себебі түзілген AgI және AgSCN тұнбалары индикаторды адсорбциялайды, нәтижесінде эквиваленттік нүктеге жетпей ерітінді боялады. Мор әдісінде хлорид иондары колбада, АgNО3 бюреткада болады, осы жағдайда ғана титрлеудің соңында ерітіндінің түсі күрт өзгереді. Мор әдісімен титрлеуді бейтарап және әлсіз сілтілік ортада орындайды (рН = 6,5 – 10,5), рН < 6,5 қышқыл ортада Ag2CrO4 тұнбасы түзілмейді, ал рН > 10,5 сілтілік ортада Аg+ ионы түсті оксид түзеді (Аg2О). Ерітіндінің ортасы қышқыл болған жағдайда NаНСО3 немесе Nа2В4О7·10Н2О ерітінділерін пайдаланылып бейтараптайды. Титрленетін ерітіндіде СrО42- иондарымен тұнба беретін катиондар болмауы тиіс, мысалы Ва2+, Рb2+, Ві3+ т.б. Кейбір аниондар да кедергі жасайды, мысалы РО43-, АsО43-, С2О42- т.б. бұл аниондар Аg+ иондарымен түсті тұнбалар түзеді. Осы жағдайлар Мор әдісінің пайдаланылуын шектейді. Жиі пайдаланылатын тәсілдердің бірі - роданометриялық әдіс Фольгорд әдісі. Бұл әдісінде индикатор ретінде Fe3+ иондарын пайдаланады. Әдіс Fe3+ иондарының SCN- иондарымен суда еритін қызыл түсті комплекс түзілуіне негізделген. Темір(ІІІ) концентрациясына байланысты түрлі комплекстер түзеді [Fe(SCN)]2+, [Fe(SCN)2]+, [Fe(SCN)6]3- түзілуі мүмкін. Темір(ІІІ) иондарының концентрациясы жоғары болса соңғы комплекс түзіледі. Титрлеу барысында: Аg+ + SCN- → АgSCN↓ ақ тұнба түзіледі. Кs(AgSCN) = 1,1·10-12. Бұл жағдай темір аммоний ашудасы NН4Fe(SO4)2·12Н2О индикаторын пайдаланып күміс тұздарын аммоний роданиді ерітіндісімен (немесе КSCN) титрлеуге мүмкіндік береді (тура титрлеу). Бромидтерді, хлоридтерді анықтау үшін кері титрлеу тәсілін пайдаланады. Мысалы, Вr- + Аg+ (артық мөлшерде) = АgВr↓ + Аg+ (қалдық) артық қалған қалдық - Аg+ иондарын NН4SCN ерітіндісімен титрлейді: Аg+ + SCN- = АgSCN↓.
Эквивалентті нүктеде: Fe3+ + 3SCN- = Fe(SCN)3 қызыл түсті ерітінді пайда болады. Хлоридтерді анықтаған кезде біраз уақыттан соң – ерітіндіні араластырғанда қызыл түс жойылады. Себебі, [Аg+][Cl-]=Кs(АgCl)=1,78· 10-10, [Аg+][SCN-] = Кs(АgSCN) = 1,1· 10-12
Қатынастарын тапқанда,
демек ерітінді түсізденбес үшін [Cl-] ионының концентрациясы [SCN-] ионы концентрациясынан 161 есе артық болу қажет. Іс-жүзінде индикатор ретінде NН4Fe(SО4)2·12Н2О алғанда НNО3 қосады темір аммоний ашудасының қаныққан ерітіндісі болу үшін. Фольгард әдісінде қышқылдық орта титрлеуге кедергі жасамайды, керісінше дәл нәтиже алуға мүмкіндік уғызады. Тирлеуге Ва2+, Рb2+, Вi3+ иондары кедергі жасамайды. Титрлеуге сынап тұздары және тотықтырғыштар кедергі жасайды, себебі сынап тұздары SCN- ионымен тұнбаға түсіреді, ал тотықтырғыштар оны тотықтырады, сонымен қатар, F- иондары да кедергі жасайды, себебі олар Fe3+ иондарымен түссіз комплекс түзеді. Егер орта сілтілік болса, міндетті түрде азот қышқылымен бейтараптайды, өйткені сілтілік ортада индикатор құрамындағы темір(ІІІ) иондары гидроксид түрінде тұнбаға түседі.
Адсорбциялық индикаторларды пайдаланып титрлеу немесе Фаянс әдісі. Адсорбциялық индикаторларды пайдаланып Мор әдісімен анықтауға болмайтын иодидтерді, тиоцианаттарды анықтауға болады. Адсорбциялық индикаторлар белгілі жағдайда тұнбаның беткі қабатында адсорбцияланып өзінің түсін өзгертетін әлсіз органикалық қышқылдар (бояғыштар). Адсорбциялық индикаторларға – эозин, флуоресцеин жатады. HInd ↔H+ + Ind-
Панет-Фаянс-Ган заңдылықтары бойынша тұнбаның бетіне ұқсас иондар немесе аттас иондар келіп адсорбцияланады. Мысалы, бромидтерді, иодидтерді, тиоцианаттарды АgNО3 ерітіндісімен титрлегенде индикатор ретінде эозинді пайдаланады. Ол әлсіз органикалық қышқыл болғандықтан титрленетін ерітіндіде (Ind-) күйінде болады да ерітіндіні қызқылт түске бояйды. Эквиваленттік нүктеге дейін реакция нәтижесінде түзілген АgВr тұнбасы ерітіндіге жүрген артық мөлшердегі Вr- иондарын өзінің бетінде адсорбциялайды да теріс зарядталған болшектер түзеді, бөлшектер теріс зарядталғандықтан эозин иондарын (Ind-) адсорбцияламайды. Эквивалентті нүктеден кейін АgВr өзінің бетінде бір-екі тамшы артық қосылған Аg+ иондарын адсорбциялайды да оң зарядталған болшектер түзеді, оң зарядталған болшектер ерітіндідегі эозин аниондарын (Ind-) өзінің бетіне адсорбциялап, тұнбаны қызыл-күлгін түске бояйды. Оны келесі схеме арқылы көрсетеге болады.
АgВr·Аg+/NО3- + Э- ↔ АgВr·Аg+/Э- + NО3-
бұл эквивалентті нүктеде. Осы кезде титрлеуді аяқтайды. Реакция нәтежесінде түзілген тұнбалардың бетінде бояғыш заттар адсорбцияланып өзінің түсін өзгертетін болғандықтан, олардыадсорбциялық индикаторлар деп атайды. Индикатор ионының анықталатын ионға қарағанда адсорбциялануы төмен болуы тиіс. Хлорид-иондарын анықтаған жағдайда индикатор ретінде бояғыш – флуоресцеинді қолданады. Эквивалентті нүктеде АgСІ тұнбасы өзінің бетінде осы қышқылдың анионын адсорбциялап ерітіндіні қызыл түске бояйды (Фаянс әдісі). Флуоресцеинді пайдаланғанда еске алатын бір жай ол әлсіз екендігі сондықтан, оның иондану процесі ерітіндігегі сутек иондарының концентрациясына тәуелді. Сутек иондарының концентрациясы өте жоғары болған жағдайда ерітіндіде флуоресцеин аниондары мүлдем болмауы мүмкін, сондықтан түсті қосылыс түзілмейді. Сондықтан титрлеуді бейтарап немесе әлсіз сілтілік ортада, рН = 7-10 аралығында орындаған жөн. Эозиннің қышқылдық қасиеті жоғары болғандықтан бромидтерді, иодидтерді және роданидтерді қышқыл ортада титрлеуге болады.
Комплексонометриялық титрлеу. Титранттар. Индикаторлар.
Полидентантты органикалық лигандаларды қолданып титрлеуді комплексонометрия деп атайды. Комплексонометриялық титрлеу анықталатын зат пен титрант арасында нашар диссоциацияланатын комплексті қосылыстың түзілу реакциясына негізделген. Бұл әдіспен көбінесе металл иондары анықталады. Металл ионы – комплекстүзушінің, титрант комплексон – лиганданың ролін атқарады. Комплексондар дегеніміз көп негізді аминополикарбон қышқылдары немесе олардың тұздары. Комплексондарды аналитикалық реагенттер ретінде қолдануды алғаш ұсынған Г. Шварценбах. Комплексондардың түрлері:
Комплексон - I – нитрилүшсірке қышқылы, N(СН2СООН)3 - Н3Y.
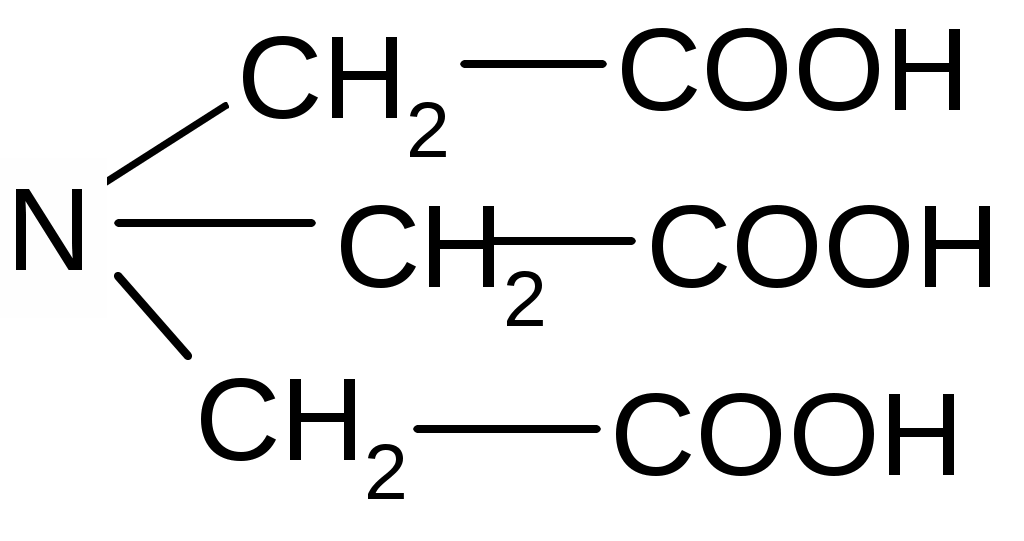
Комплексон – II – этилендиаминтетрасірке қышқылы (ЭДТСҚ) - Н4Y.
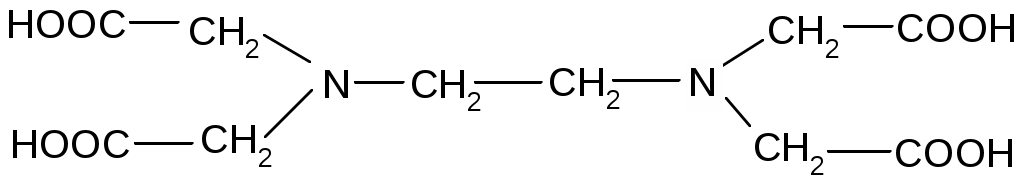
Комплексон – III – этилендиаминтетрасірке қышқылының динатрий тұзы (ЭДТА, натрий эдетаты, Тролон-Б) - Nа2Н2Y·2Н2О.
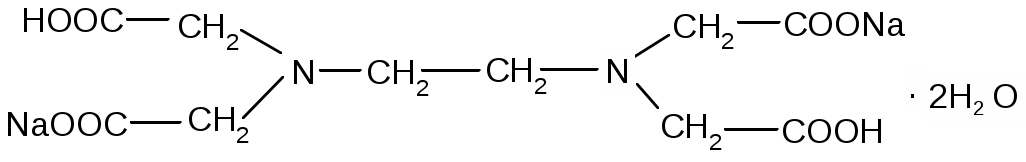
Барлық моноядролық комплекстерде натрий эдетаты алты дентантты лиганда, ол құрамы МY(n-4)+ октаэдрлі комплекс түзеді. Полидентантты лиганда металл ионымен стехиометриялық түрде 1:1 қатынаста әрекеттеседі.
М+ + Н2Y2- = МY3- + 2Н+
Са2+ + Н2Y2- = СаY2- + 2Н+
Аl3+ + Н2Y2- = АlY- + 2Н+
Тh4+ + Н2Y2- = ТhY + 2Н+
Практикада натрий эдетаты құрамында (СООН) және (N) топарының болуына байланысты кеңінен қолданылады. Ерітіндіде натрий эдетатының протондануы:
Н4Y
рК1 = 2,0; рК2 = 2,67; рК3 = 6,16; рК4 = 10,2.
Комплексонаттардың аналитикалық химияда қолданылуы.
1. Комплексонаттар суда және басқа да еріткіштерде жақсы ериді.
2. Олар көптеген металл катиондарымен оңай әрекеттеседі (әсіресе, сілтілік-жер металдарының иондарымен, бұл иондар көптеген комплекстүзушілермен комплекс түзбейді).
3. Кейбір комплексондардың талғағыштық қасиеттері бар. Осы қасиеттері оларды аналитикалық химияда титрант ретінде кеңінен қолдануға мүмкіндік береді.
Титрлеу қисығы. Титрлеу қисығындағы кез келген титрлеу нүктесінің тепе-теңдік концентрациясын есептеуде МY(n-4)+ комплексінің шартты тұрақтылық константа мәнін пайдаланады. f – pM координаттары бойынша қисық тұрғызады. Титрлеу қисығындағы секіру интервалының шамасы шартты тұрақтылық константа мәніне тәуелді. Титрлеуді жүргізу шартты тұрақтылық константа мәні
Титрлеудің соңғы нүктесін анықтау. Комплексонометрияда титрлеудің соңғы нүктесін жәй көзбен бақылап немесе физика-химиялық әдістерді пайдаланып анықтайды. Әдістерді таңдау әртүрлі факторларға тәуелді: дәлдігі, талғағыштығы, лайлы және боялған ерітінділерді титрлеу т.б. Жәй көзбен бақылап анықтағанда металл индикаторларды пайдаланады. Түсінің өзгеруі өзінің концентрациясына тәуелді индикаторларды металл индикаторлар деп атайды. Металл индикаторлар үлкен екі топқа бөлінеді: Біріншісі, өзінің түсі болмайтын, бірақ металл ионымен түсті комплекс беретін индикаторлар. Мысалы, темір(ІІІ) ионын анықтауда индикатор ретінде салицил қышқылын, тайрон қолданылады. Темір(ІІІ) ионының салицил қышқылымен комплексі (1:1) – қызыл түсті, тайронмен комплексі (1:1) – жасыл түсті. Висмут(ІІІ) ионын анықтағанда тиомочевина қолданылады, комплексінің түсі сары. Металл ионы мен индикатордан түзілген комплекстің түсінің өзгеруін байқау үшін индикатордың концентрациясы титрленетін металдың концентрациясынан 10 есе артық болуы тиіс. Индикаторлардың екінші тобына құрамында хромофор топтары бар индикаторлар жатады. Оларды металлохромды индикаторлар деп атайды. Металл ионымен ішкі комплексті қосылыстар түзетін құрамында хромофор топтары бар (әлсіз протолиттік қасиеті бар) органикалық қосылыстарды металлохромды индикаторлар деп атайды. Металлохромды индикаторлар көп протонды қышқылдар. Олар үш топқа бөлінеді:
I – топтағы индикаторлар, құрамында азо- тобы бар -N=N- үш негізді әлсіз қышқылдар – эриохром қара Т.
II – топтағы индикаторлар, үшфенилметан бояғыштар тобына жататын: ксиленол қызыл сарысы, пирокатехин күлгін, метилтимол көгі.
III – топтағы индикаторлар мурексид, дитизон, ализарин.
Индикаторларға қойылатын талаптар:
1. Металл индикаторлар рН-тың белгілі бір ауданында металл ионымен М:Ind = 1:1 қатынаста тұрақтырақ комплексті қосылыс түзуі тиіс, бірақ түзілген МInd комплексінің шартты тұрақтылық константасы осы металл ионының натрий эдетатымен түзетін шартты тұрақтылық константасынан кіші болуы тиіс.
2. Индикатордың металл ионымен беретін комплексі натрий эдетатымен әсер еткенде тез бұзылуы тиіс.
3. Титрлеудің соңғы нүктесінде ерітінді түсінің өзгеруі айқын болуы тиіс.
Комплексонометриялық титреу жағдайлары:
1. Эквиваленттік нүктеде анықталатын катион комплекс түрінде толық байланысуы тиіс. 2. Түзілген комплекстің тұрақсыздық константасы өте төмен болуы тиіс. 3. Анықталатын ионның индикатормен түзілген комплексінің тұрақтылығы, анықталатын ионның натрий эдетатымен беретін комплексінің тұрақтылығынан төмен болуы тиіс. 4. Натрий эдетатымен титрлеу рН-тың тұрақты бір мәнінде рН = 8-9 жүргізіледі (әдетте, аммиак буфері қатысында).
Титрлеу тәсілдері. I. Тура титрлеу. Көптеген металл катиондарын шамамен 30-ға жуығын тура титрлеу тәсілі арқылы натрий эдетатымен анықтауға болады. Мысалы, Са2+ ионын мурексид қатысында натрий эдетатымен тура титрлеу тәсілімен анықтайды. Эквиваленттік нүктеде қызыл-қошқыл түс индикатордың көк түсіне ауысады, яғни эквиваленттік нүктеде бос индикатор бөлініп шығады: СаInd- + H2Y2- = CaY2- + H+ + НІnd2-. Титрлеу нәтижесінде қышқыл түзіледі, ал қышқыл ортада кальцийдің натрий эдетатымен комплексі бұзылады, сондықтан титрлеуді рН-тың 10,3-тен кеме емес мәнінде жүргізеді. Егер шартты тұрақтылық константасының көрсеткіштері арасындағы айырмашылық төрт бірліктен артық болса, онда қоспадан бірнеше иондарды анықтауға болады.
II. Кері титрлеу.Натрий эдетатымен комплекстүзу реакциясы баяу жүргенде және қажетті металл индикаторлар болмаған жағдайда пайдаланылады. Кері титрлеуде натрий эдетатының артық мөлшері қосылады, артығын басқа металл иондарымен титрлейді. Мысалы, Cr(III) және Со(ІІІ) иондары натрий эдетатымен баяу әрекеттеседі, сондықтан натрий эдетатының артық мөлшерін қосып қыздырып, артығын темір(ІІІ) ионымен титрлейді немесе алюминийді анықтағанда рН
Al3+ + H2Y2-артық = AlY- + 2H+ + (n-1)H2Y2- қалдық (рН=5).
(n-1)H2Y2- қалдық + (n-1)Zn2+ = (n-1)ZnY2- + 2H+ (рН=0).
III. Орынбасу титрлеу тәсілі. Магний ионы басқа иондарға қарағанда натрий эдетатымен тұрақтылығы төмен комплексті қосылыс түзеді. Осы комплекске анықталатын кальций ионын Са2+ қосқанда магний ионын ығыстырып шығарады. Реакция теңдеуін жалпы түрде берсек: М1n+ + M2Y(4-m)- = M1Y(4-n)- +M2m+. Ығысып шыққан металл ионын натрий эдетатымен титрлейді. Мысалы, Ва2+ ионын анықтағанда Zn2+ комплекстен ығыстырып шығарады, рН>10 аммиак буфері қатысында. Сутек ионы алмасқан қышқылдық-негіздік титрлеу реакцияларында қышқылдық-негіздік индикаторлар қатысында күшті сілтімен (а) титрлейді немесе йодометриялық реакцияларда (в): М2+ + Н2Y2- =
а) 2Н+ + 2ОН- = 2Н2О индикатор метил қызыл;
в) 3М2+ + 3Н2Y2- +JO3- +5J- =
Әдебиет
Міндетті:
1. Патсаев Ә.Қ., С.Ж. Жайлау, Ш.С. Шыназбекова, Б.Қ. Махатов Аналитикалық химия /Алматы, 2012ж., 473б.
2. Молдакалыкова А.Ж. Аналитикалық химия пәнінен сапалық анализ бөлімі бойынша лабораториялық жұмыстар. Оқу құралы. /Алматы, 2008.
3. Чекотаева К.А., Карлова Э.К. Аналитикалық химия пәнінінң сандық талдау тәсілдері. /Москва, 2017ж.
4. Ю.Я. Харитонов. Аналитическая химия. Общие теоретические основы. Качественный анализ./М.:ГЭОТАР – Медиа, 2014.- 688с.
5. Тебенькова Е.Н. Курс лекций по аналитической химии. Учебное пособие по аналитической химии для студентов по специальности 33.02.01 Фармация./г. Набережные челны, 2016г. - 157 с.
Қосымша:
1.Чекотаева К.А., Молдакалыкова А.Ж., Карлова Э.К. Аналитическая химия/ Учебно-методическое пособие по самостоятельной работе студентов. – Алматы, 2009. – с. 183
2. Васильев В.П., Кочерина А.Н., Орлова Г.Д. Аналитическая химия. Сборник вопросов, упражнении и задач. М., Дрофа, 2003.
Электрондық ресурстар:
Интернет-ресурс көздері, электрондық кітаптар мен оқулықтар:
https://library.psu.kz/fulltext/transactions/3818_khulajanov_kh_analitikalikh_himiya_fizikalikh-himiyalikh_taldau_adisteri.pdf
http://library.atu.kz/show/khhtie/az213.pdf
http://kazneb.kz/bookView/view/?brId=1104854&simple=true&lang=kk
www.chem.msu.su; http://shopedu.ru/shop/tablitsyi/star/120
