химия. пять заданий. 16. Как тепловой эффект химической реакции зависит от температуры Выведите дифференциальную форму уравнения Кирхгофа
 Скачать 168.76 Kb. Скачать 168.76 Kb.
|
|
Тема 1 «Химическая термодинамика» 16. Как тепловой эффект химической реакции зависит от температуры? Выведите дифференциальную форму уравнения Кирхгофа. Тепловые эффекты химических реакций и других процессов зависят от температуры и эта зависимость устанавливается законом Кирхгофа. Пользуясь им, можно определять тепловой эффект процесса при любой температуре расчетным путем. Получим уравнения Кирхгофа в дифференциальной форме. Для этого возьмем частные производные от теплоты процесса по температуре, соответственно, при постоянных P и V. Тогда с учетом уравнений 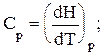 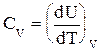 получим: 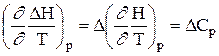 ; ;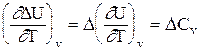 . .Два последних уравнения представляют собой дифференциальную форму закона Кирхгофа. Запишем уравнения Кирхгофа, перейдя к полным дифференциалам: Здесь ΔСp и ΔСv – изменение теплоемкости системы в результате протекания процесса при Р = const и V = const. Формулировка закона Кирхгофа: температурный коэффициент теплового эффекта процесса равен изменению теплоемкости в результате протекания этого процесса. Рассмотрим химическую реакцию аА + вВ еЕ + dD, для нее изменение теплоемкости при Р = const: где a, b, d, e, ν – стехиометрические коэффициенты в уравнении реакции. Анализ уравнений Кирхгофа показывает, что - если DСр > 0, то - если DСр < 0, то - если DСр = 0, то Это значит, что если изменение теплоемкости в ходе реакции положительно, то с ростом температуры тепловой эффект реакции возрастает; если изменение теплоемкости в ходе реакции отрицательно, то с ростом температуры тепловой эффект уменьшается; если в ходе процесса суммарная теплоемкость системы постоянна, то тепловой эффект реакции не зависит от температуры. Тема 2 «Химическое равновесие» 16. Что такое энергия активации? Как влияет на скорость химических реакций величина энергии активации? Энергия активации – это энергия, которая должна быть передана соединениям, чтобы вызвать химическую реакцию. Иными словами, энергия активации – это разность между средней энергией молекул при данной температуре и той энергией, которой они должны обладать, чтобы вступить в химическую реакцию. Значение энергии активации влияет на скорость химической реакции: - энергия активации маленькая (менее 50 кДж) – скорость увеличивается, реакция протекает быстро, так как столкновение частиц происходит легко; - энергия активации большая (более 120 кДж) – химическая реакция происходит медленно, так как количество столкновений невысокое. В общем случае, зависимость скорости (константы скорости) реакции от температуры выражается уравнением Аррениуса, где присутствует энергия активации:  где k – константа скорости реакции; R – универсальная газовая постоянная (8,31 Дж/моль·К); Т – абсолютная температура Кельвина (К); Еакт – энергия активации (Дж/моль); А – предэкспоненциальный коэффициент, учитывающий вероятность и число столкновений. Тема 3 «Фазовое равновесие» 16. Опишите способы перегонки растворов с неограниченно растворимыми жидкостями и их общие закономерности. Покажите с помощью диаграмм кипения «температура – состав», какой компонент может быть выделен перегонкой в чистом виде. При простой перегонке исходная смесь доводится до кипения, образующийся при этом пар отводят из системы и конденсируют. В полученном конденсате содержание более летучего компонента системы выше, чем в исходном растворе. Пусть жидкость исходного состава Y1 закипает при температуре Т1 (рисунок 1) и образуется пар состава Х1. Этот пар отводят и конденсируют. При дальнейшем нагревании в паре повышается содержание вещества В, а в растворе его количество уменьшается. 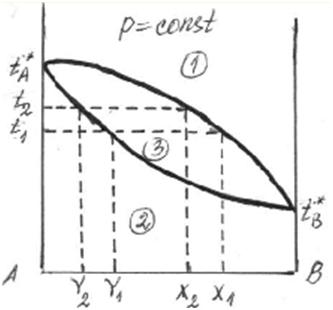 Рисунок 1 – Диаграмма кипения идеального бинарного раствора Это приводит к изменению состава жидкости до Y2 и повышению температуры кипения до Т2. При этой температуре последние порции отобранного и сконденсированного пара имеют состав Х2. Общий состав раствора, полученного в результате конденсации паров, имеет среднее значение между Х1 и Х2. Как видно из диаграммы, полученный конденсат по сравнению с исходным раствором существенно обогащен компонентом В. Если продолжать нагревание жидкости, то ее последние порции при t → tА* будут представлять почти чистый компонент А. Выделить практически чистый компонент В в процессе простой перегонки невозможно. Простая перегонка применяется, если не требуется полностью разделить раствор на чистые компоненты. Она возможна в том случае, когда температура компонентов сильно различаются. Таким образом, путем простой (однократной) перегонки и конденсации удается получить небольшое количество каждого компонента в практически чистом виде. Также различают: 1) фракционная перегонка При простой (однократной) перегонке основная масса компонентов все же остается пока в жидкой смеси. Для увеличения выхода чистых веществ следует повторить процессы испарения, конденсации и опять испарения, а затем объединить чистые фракции. 2) ректификация Представляет собой сочетание простой и фракционной перегонки. В лабораториях ее осуществляют с помощью дефлегматоров, а в промышленности используют ректификационные колонны. Тема 4 «Электрохимия» 16. Опишите принцип кондуктометрического титрования. Приведите типы кривых титрования для случаев сильных и слабых кислот и оснований, а также их смесей. Широкое применение нашла косвенная кондуктометрия или кондуктометрическое титрование (KT). КТ основано на изменении электропроводности титруемого раствора вблизи точки эквивалентности, вследствие резкого изменения ионного состава раствора в этот момент. КТ применяют для установления конца кислотно-основного, окислительно-восстановительного, осадительного титрования разбавленных, сильно разбавленных, мутных или окрашенных растворов, когда переход окраски обычных индикаторов не происходит или не виден. К достоинствам метода относится возможность титрования очень разбавленных растворов (меньше 10-4 моль/л) с погрешностью, не превышающей 2%. Кривая титрования гидроксида натрия соляной кислотой (или наоборот) имеет вид представленный на рисунке 2. Аналогичные процессы приводят к этому же виду кривые титрования других сильных оснований сильными кислотами или наоборот. 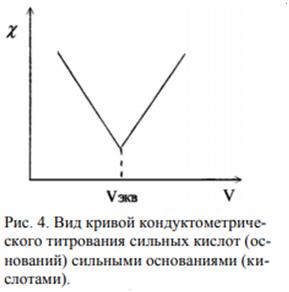 Рисунок 2 – Вид кривой кондуктометрического титрования сильных кислот (оснований) сильными основаниями (кислотами) При титровании слабых оснований (слабых кислот) сильными кислотами (сильными основаниями), вследствие слабой диссоциации веществ титруемых растворов и связывании в воду Н+ и ОН- ионов, добавляемых с титрантом, электропроводность до точки эквивалентности растет очень слабо. Избыток титранта после ТЭ приводит к появлению в титруемом растворе несвязанных Н+ (ОН-) ионов и к резкому росту электропроводности (рисунок 3, а). При титровании смеси сильной и слабой кислот (основания) описанные выше процессы приводят к двум изломам на кривой титрования, позволяющим зафиксировать обе ТЭ (рисунок 3, б). Различия в подвижностях ионов позволяет проводить их кондуктометрическое определение титрованием. 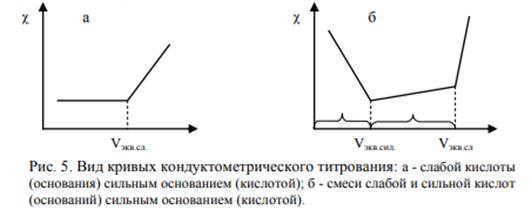 Рисунок 3 – Вид кривых кондуктометрического титрования: а) слабой кислоты (основания) сильным основанием (кислотой); б) смеси слабой и сильной кислот (оснований) сильным основанием (кислотой) Тема 5 «Химическая кинетика. Катализ» 16. Что такое температурный коэффициент скорости реакции? Как его рассчитать? Сформулируйте правило увеличения скорости реакции с увеличением температуры на 10оС. Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции, числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10°С. Температурный коэффициент различных реакций различен. При обычных температурах его значение для большинства реакций находится в пределах от 2... 4. Правило Вант-Гоффа – эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале. Формулируется оно следующим образом: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два-четыре раза. Уравнение, которое описывает это правило: 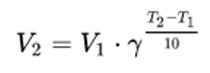 где V2 – скорость реакции при температуре T2, V1 – скорость реакции при температуре T1, γ – температурный коэффициент реакции. Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400 oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например, белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса. Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле: 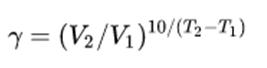 Литература 1. Афанасьев Б.Н. Физическая химия: Учебное пособие / Б.Н. Афанасьев, Ю.П. Акулова. – СПб.: Лань, 2012. 2. Глинка Н.Л. Общая химия: Учебник для академического бакалавриата / Н.Л. Глинка. – Люберцы: Юрайт, 2016. 3. Попова А.А. Физическая химия: Учебное пособие / А.А. Попова, Т.Б. Попова. – СПб.: Лань, 2015. 4. Пустовалова Л.М. Физико-химические методы исследования и техника лабораторных работ / Л.М. Пустовалова, И.Е. Никанорова. – Ростов-на-Дону: Феникс, 2018. {\displaystyle \gamma =(V_{2}/V_{1})^{10/(T_{2}-T_{1})}} |
