17. Роль воды в химических реакциях
|
На экране
Текст «Роль воды в химических реакциях»
|
Вода – это уникальное вещество, созданное природой. Она ввиду особенностей своего состава и строения обладает рядом свойств, благодаря которым она проявляет большую химическую активность. В реакциях вода может выступать в качестве реагента, катализатора, реакционной среды, осуществлять транспортировку веществ.
|
Текст «Вода – это уникальное вещество»

|
Очень большое количество реакций протекает в водной среде. Способность веществ растворяться в воде или в другом растворителе называется растворимостью. По растворимости в воде все вещества делят на три группы: растворимые (растворимость составляет более 1 г вещества на 100 г воды); малорастворимые (растворимость составляет от 0,01 до 1 г вещества на 100 г воды); практически нерастворимые (растворимость составляет менее 0,01 г вещества на 100 г воды). Растворимость веществ в воде отражена в таблице растворимости кислот, оснований и солей.
|
Схема «Классификация веществ по растворимости в воде»
   Вещества Вещества
|
растворимые
|
малорастворимые
|
практически нерастворимые
|
растворимость составляет более 1 грамма вещества на 100 грамм воды
|
растворимость составляет от 0,01 до 1 грамма вещества на 100 грамм воды
|
растворимость составляет менее 0,01 грамма вещества на 100 грамм воды
|
|
Растворение – это сложный физико–химический процесс, в ходе которого происходит взаимодействие частиц растворителя и растворяемого вещества. Физическая сторона процесса: после контакта частиц растворителя и растворенного вещества, частицы растворенного вещества отрываются от поверхности растворяемого вещества и распределяются по всему объему растворителя благодаря диффузии. Химическая сторона процесса: взаимодействие молекул растворителя с частицами растворяемого вещества, которое приводит к образованию устойчивых соединений.
|
Текст «Растворение – это сложный физико–химический процесс, в ходе которого происходит взаимодействие частиц растворителя и растворяемого вещества.
Физическая сторона процесса: после контакта частиц растворителя и растворенного вещества, частицы растворенного вещества отрываются от поверхности растворяемого вещества и распределяются по всему объему растворителя благодаря диффузии.
Химическая сторона процесса: взаимодействие молекул растворителя с частицами растворяемого вещества, которое приводит к образованию устойчивых соединений»
|
Если в качестве растворителя выступает вода, то взаимодействие растворенного вещества с водой приводит к образованию соединений, которые носят название гидраты, а сам процесс называют гидратацией. Если увеличить содержание растворенного вещества, то из раствора выпадают кристаллы, содержащие в своем составе воду, которую называют кристаллизационной, а сами эти кристаллы называют кристаллогидратами.
|
Текст «Гидраты – устойчивые соединения, которые образуются в процессе химического взаимодействия растворенного вещества с молекулами воды.
Гидратация – процесс образования гидратов.
Кристаллогидрат – кристалл, содержащий в своем составе воду.
Кристаллизационная вода – вода, входящая в состав кристаллогидрата»
|
К наиболее известным и широко используемым кристаллогидратам относятся кристаллическая сода, медный купорос, железный купорос, глауберова соль, гипс и другие.
|
Таблица «Примеры кристаллогидратов»
Название
|
Формула
|
Внешний вид
|
Кристаллическая сода
|
Na2CO3*10H2O
|

|
Медный купорос
|
CuSO4*5H2O
|

|
Железный купорос
|
FeSO4*7H2O
|

|
Глауберова соль
|
Na2SO4*10H2O
|
 
|
Гипс
|
CaSO4*2H2O
|
|
|
Гидратная теория растворов была предложена русским ученым Д.И. Менделеевым.
|
Т екст «Менделеев Дмитрий Иванович (1834 – 1907гг.) - русский химик» екст «Менделеев Дмитрий Иванович (1834 – 1907гг.) - русский химик»
|
Некоторые вещества способны в воде распадаться на ионы (диссоциировать), они называются электролитами. Электролиты по-разному диссоциируют в воде. Способность электролита к диссоциации характеризуется величиной – степенью электролитической диссоциации, которая указывает отношение числа молей вещества, которое диссоциировало, к общему количеству растворенного вещества.
|
Текст «Электролиты – вещества, которые в растворах распадаются на ионы - диссоциируют.
Степень электролитической диссоциации – величина равная отношению числа молей вещества, которое диссоциировало, к общему количеству растворенного вещества»
|
В зависимости от величины степени диссоциации все электролиты делят на сильные, у которых степень диссоциации приближается к единице, и слабые, у которых степень диссоциации приближается к нулю. К сильным электролитам относят щелочи, растворимые соли, некоторые кислоты, к слабым – нерастворимые соли, ряд неорганических и почти все органические кислоты.
|
Схема «Классификация электролитов в зависимости от величины степени электролитической диссоциации»
Электролиты
 
|
сильные
степень диссоциации→1
|
слабые степень диссоциации→0
|
|
В водных растворах сильные электролиты практически полностью диссоциируют на ионы, поэтому уравнение диссоциации записывается как необратимый процесс. Например, гидроксид калия полностью диссоциирует на ион калия и гидроксид-ион; серная кислота полностью диссоциирует на два иона водорода и сульфат-ион.
|
Текст «Диссоциация сильных электролитов:
KOH = K+ + OH-
H2SO4 = 2H+ + SO42-»
|
Уравнение диссоциации слабых электролитов записывается как обратимый процесс. Например, фтороводородная кислота незначительно диссоциирует на ионы водорода и ионы фтора, уксусная кислота слабо диссоциирует на ацетат-ион и ион водорода, даже вода в некоторой степени подвергается диссоциации на ион водорода и гидроксид-ион.
|
Текст «Диссоциация слабых электролитов:
HF ↔ H+ + F-
CH3COOH ↔ CH3COO- + H+
Н2О ↔ H+ + OH-»
|
Изначально теория, которая объясняет электропроводность растворов, была предложена шведским ученым С. Аррениусом в 1887 году, однако русские ученые И. А. Каблуков и В.А. Кистяковский дополнили эту теорию.
|
С . Аррениус шведский ученый . Аррениус шведский ученый
|
И. А. Каблуков
р усский ученый усский ученый
|
В.А.Кистяковский
р усский ученый усский ученый
|
|
Суть теории электролитической диссоциации заключается в том, что электролиты в растворах и расплавах диссоциируют на противоположно заряженные частицы – ионы. В зависимости от того, какие ионы образуются в результате диссоциации, электролиты делят на кислоты, основания и соли.
Кислоты – электролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка. Например, соляная кислота диссоциирует на катион водорода и анион хлора, азотная кислота диссоциирует на катион водорода и нитрат-анион.
Основания – электролиты, которые диссоциируют на катионы металла и гидроксид – анионы. Например, гидроксид натрия диссоциирует на катион натрия и гидроксид-анион, гидроксид бария диссоциирует на катион бария и два гидроксид-аниона.
Соли – электролиты, которые диссоциируют на катионы металла и анионы кислотных остатков. Например, сульфат цинка диссоциирует на катион цинка и сульфат-анион, хлорид кальция диссоциирует на катион кальция и хлорид-анион.
|
Текст «Классификация электролитов в зависимости от образуемых в результате диссоциации ионов»
   Электролиты Электролиты
|
кислоты
|
основания
|
соли
|
диссоциируют на катионы водорода и анионы кислотного остатка
|
диссоциируют на катионы металла и гидроксид – анионы
|
диссоциируют на катионы металла и анионы кислотных остатков
|
HCl=H++Cl-
HNO3=H++NO3-
|
NaOH=Na++OH-
Ba(OH)2=Ba2++2OH-
|
ZnSO4=Zn2++SO42-
CaCl2=Ca2++Cl-
|
|
В органической химии реакции, где вода выступает в роли реагента, носят название реакции гидратации (реакции присоединения воды). Например, гидратация этилена: при взаимодействии этилена с водой образуется этанол, гидратация ацетилена: ацетилен при взаимодействии с водой образует уксусный альдегид.
|
Текст «Реакции гидратации:
С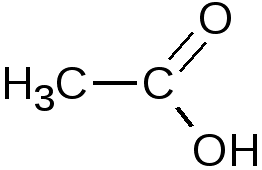 Н2=СН2 + Н2О → СН3-СН2ОН Н2=СН2 + Н2О → СН3-СН2ОН
НС=СН + Н2О → »
|
В неорганической химии вода также может выступать в качестве реагента. Щелочные и щелочноземельные металлы активно реагируют с водой с образованием щелочей и выделением водорода. Например, при взаимодействии калия с водой образуется гидроксид калия и водород, при взаимодействии кальция с водой образуется гидроксид кальция и водород.
|
Текст «Взаимодействие щелочных и щелочноземельных металлов с водой:
2К + 2Н2О = 2КОН + Н2↑
Са + 2Н2О = Са(ОН)2 + Н2↑»
|
Галогены также способны к взаимодействию с водой, но в данном случае нет общей схемы реакции, так как при взаимодействии разных галогенов с водой, образуются разные продукты. Пример, при взаимодействии фтора с водой образуются плавиковая кислота и кислород, а при взаимодействии хлора с водой образуются соляная и хлорноватистая кислоты.
|
Текст «Взаимодействие галогенов с водой:
2F2 + 2Н2О = 4HF + O2↑
Cl2 + Н2О = HCl + HClO»
|
Вода также взаимодействует с основными и кислотными оксидами с образованием соответствующих гидроксидов - щелочей и растворимых кислот. Например, при взаимодействии воды с оксидом кальция образуется гидроксид кальция, при взаимодействии воды с оксидом углерода четвертой валентности образуется угольная кислота.
|
Текст «Взаимодействие воды с основными и кислотными оксидами:
Н2О + СаО = Са(ОН)2
Н2О + СО2 = Н2СО3»
|
Кроме этого вода является участником процессов электролиза и сама под действием электрического тока образует водород и кислород.
|
Текст «Электролиз воды:
 2Н2О электролиз 2Н2 + О2» 2Н2О электролиз 2Н2 + О2»
|
 Скачать 247.5 Kb.
Скачать 247.5 Kb.