билеты по органической химии. билеты по орг химии 13-14. 1)Ароматические углеводороды, строение, изомерия, номенклатура. Правило ароматичности Хюккеля. Ароматические углеводороды (Арены)
 Скачать 1.63 Mb. Скачать 1.63 Mb.
|
|
Билет №13     Билет №14 1)Ароматические углеводороды, строение, изомерия, номенклатура. Правило ароматичности Хюккеля. Ароматические углеводороды (Арены) – это органические соединения, в молекулах которых имеется одно или несколько бензольных колец. Бензольное кольцо, или ядро, – циклическая группа атомов углерода с особым характером связей. Общая формула — CnH2n-6 1. Представители: МОНОЯДЕРНЫЕ 1. С6H6 – бензол, родоначальник гомологического ряда аренов 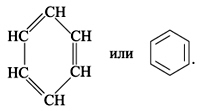 2. С6H5 – CH3 – толуол (метилбензол) 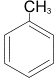 3. С6H5 – CH=СH2 – стирол (винилбензол) 4. Ксилол (орто-, пара- , мета-ксилол) МНОГОЯДЕРНЫЕ (КОНДЕНСИРОВАННЫЕ) 1. Нафталин 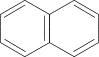 2. Антрацен  2. Строение ароматических углеводородов
Первую структурную формулу бензола предложил в 1865 г. немецкий химик Ф.А.Кекуле: 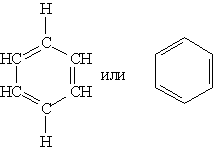 Каждый атом С в молекуле бензола находится в состоянии sp2-гибридизации. Он связан с двумя соседними атомами С и атомом Н тремя σ -связями. В результате образуется плоский шестиугольник, где все шесть атомов С и все σ -связи С–С и С–Н лежат в одной плоскости (угол между связями С–С равен 120o). Гомологи бензола. Номенклатура и изомерия Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): С6Н5—R (алкилбензол), R—С6Н4—R (диалкилбензол) и т.д. Общая формула гомологического ряда бензола СnH2n-6 (n не менее 6). Номенклатура. Широко используются тривиальные названия (толуол, ксилол, кумол и т.п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень): С6Н5—СH3 С6Н5—С2H5 С6Н5—С3H7 метилбензол этилбензол пропилбензол (толуол) Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими. Для дизамещенных бензолов R-С6Н4—R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками: орто— (о-) заместители у соседних атомов углерода кольца, т.е. 1,2; мета— (м-) заместители через один атом углерода (1,3); пара— (п-) заместители на противоположных сторонах кольца (1,4). Ароматические одновалентные радикалы имеют общее название «арил«. Из них наиболее распространены в номенклатуре органических соединений два: С6Н5— фенил и С6Н5-СH2— бензил. Изомерия (структурная): 1) положения заместителей для ди-, три— и тетра-замещенных бензолов (например, о-, м— и п-ксилолы,; 2) углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода; 3) изомерия заместителей, начиная с С2Н5. Например, молекулярной формуле С8Н10 соответствует 4 изомера: три ксилола СH3—С6Н4—СH3 (о-, м-, п-) и этилбензол С6Н5—С2H5. Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует.  2)Имидазол, получение конденсацией формальдегида, глиоксаля и аммиака. Ароматический характер. Отличие от пиррола. Нахождение в природе. Имидазо́л — органическое соединение класса гетероциклов, пятичленный цикл с двумя атомами азота и тремя атомами углерода в цикле, изомерен пиразолу.  Хим. формула C3H4N2 Хим. формула C3H4N2Структурная ф-ла : Имидазол получают конденсацией глиоксаля с аммиаком в присутствии формальдегида: 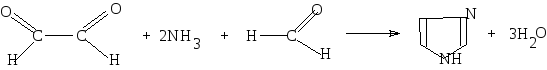 Ароматический хар-р проявляется в устойчивости к окислению , в отсутствии тенденции к реакциям присоед-я , а также в легкости с которой он вступает в реакции электрофильного замещения. В отличии от пиррола , имидазол яв-ся крист в-вом с выской t кип. и плавления . Обладает более сильными основными св-вами и одновременно проявляет слабые к-ые св-ва. 3) Провести превращения : CH3COOH HO-SO2Cl NH3 H2O HONO HCl C6H5N(CH3)2 анилин ————>? ————> п-изомер ——>?——>?———>?——>? —————>? -H2O -H2O   |
