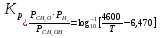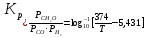|
|
Курсовая работа. Получение формальдегида
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Казанский национальный исследовательский технологический университет»
(ФГБОУ ВО «КНИТУ»)
Кафедра «Технология основного органического и нефтехимического синтеза»
Курсовая работа
по дисциплине «Промышленная органическая химия»
на тему «Получение формальдегида»
Выполнил:
студент гр.417-М11
Ишмухаметова Л.А.
Проверил:
доцент кафедры ТООНС
Тагашева Р.Г.
Казань 2017
Содержание
Введение…………………………………………………………………………………………2
Свойства и применение формальдегида…………………………………………….....3
Промышленные методы получения…………………………………………………....5
Производство формальдегида из метанола…………………………………...5
Каталитическое окисление метанола на серебряном катализаторе………………………………………………………....…..7
Каталитическое окисление метанола на оксидных катализаторах……………………………………………………….…...8
Восстановление окислов углерода…………………………………………….11
Окисление природного газа и низших алканов……………………………....13
Сравнение методов получения формальдегида………………………………………15
Заключение………………………………………………………………………………….….16
Список использованной литературы…………………………………………………………17
Ведение
Формальдегид впервые синтезирован А.М. Бутлеровым в 1859 г из йодистого метилена. В 1860 г. Гофман открыл реакцию дегидрирования метанола над платиной в формальдегид; в дальнейшем эта реакция легла в основу промышленных методов получения формальдегида. Научно обоснованное производство формальдегида начинается с работ академика Е. И. Орлова, под руководством которого в 1909 - 1910 гг. был сооружен первый в России формалиновый завод. К началу второй мировой войны производство формальдегида из метанола во всех крупнейших промышленных странах получило законченное технологическое оформление.
После многочисленных исследований окисления метана и его гомологов молекулярным кислородом в присутствии или в отсутствии катализаторов в Канаде и США приступили к промышленному окислению низших метановых углеводородов кислородом воздуха в ацетальдегид, формальдегид и другие продукты.
Промышленный метод окисления метана с гомогенными катализаторами был осуществлен только в Германии в 1941—1942 гг. Несмотря на развитие процессов окисления углеводородных газов, основным источником получения формальдегида продолжает оставаться метанол, на долю которого в США в 1948 г. приходилось 80% произведенного формальдегида, в то время как на долю углеводородных газов всего 20%. Однако сам метанол производился в США в 1948 г. на 77% из окиси углерода, полученной конверсией углеводородных газов, и лишь на 23% из окиси углерода, получаемой из кокса.
1 Свойства и применение.
Формальдегид (метаналь, муравьиный альдегид) СН2О – бесцветный газ с резким раздражающим специфическим запахом, с температурой кипения -190С, температура плавления -1180С, плотность (в жидком состоянии при -200С) 0,8153 г/см3.
Чистый формальдегид в жидком и газообразном состояниях легко полимеризуется даже при низкой температуре, вследствие чего в технике предпочитают иметь дело с его водными растворами (формалин) или с полимерными формами (триоксан, параформ).
Формальдегид хорошо растворяется в воде, в спирте, ограниченно растворим в бензоле, эфире, хлороформе, не растворим в алифатических углеводородах.. В водном растворе он находится в виде равновесной смеси из гидрата формальдегида СН2 (ОН)2 и низкомолекулярных полиоксиметиленгликолей ОН(СН20)nН. Водный раствор формальдегида (33-40% об. НСНО) выпускается под названием формалина. Для предотвращения более глубокой полимеризации формальдегида и выпадения осадка, который может отлагаться в аппаратуре, в формалин добавляется 6-15% обема метанола. Легко полимеризуется, особенно при нагревании и в присутствии полярных примесей, образутся твердый полимер линейного строения(параформ) с оксиметиленовыми звеньями:
nHCHO + H2O ↔ H-(-O-CH2-)n-OH
где n = 8 – 100.
Процесс полимеризации обратим, поэтому параформ легко деполимеризуется под воздействием щелочных и кислотных реагентов, что используется на практике для хранения и транспортировки формальдегида. Токсичен, ПДК составляет 0,05 мг/м3.
Формальдегид широко присутствует в природных процессах и встречается даже в космическом пространстве.
Как и все летучие органические вещества, чистый формальдегид может находиться в одном из трёх состояний – твёрдом, жидком или газообразном. Однако в этих состояниях фактически формальдегид может присутствовать в виде целого ряда модификаций, принципиально различающихся и по химическим, и тем более по физическим свойствам. Так, твёрдому состоянию могут отвечать и разнообразные модификации высокополимерного продукта – полиформальдегида, и циклические олигомеры (триоксан, тетраоксан) и мономерный формальдегид. Все эти модификации могут находиться и в жидком состоянии, правда, при различной температуре. В парах формальдегид может присутствовать в основном в виде циклических олигомеров и мономера. И хотя все без исключения модификации сохраняют тот «неповторимый отпечаток» формальдегида, который присущ и большинству химических производных последнего, аномально большое число реально существующих модификаций часто затрудняет понимание поведения формальдегида в химических и физических превращениях. Специфическими являются и растворы формальдегида в воде и спиртах.
Формальдегид вырабатывается в очень больших масштабах (мировое производство в 1980 году составляло свыше 2 млн.т, в 2016 году в России было произведено 687 673,7 тонн).
Большая часть формальдегида используется для изготовления фенолоформальдегидных, карбамидоформальдегидных, меламиноформальдегидных, амидоформальдегидных смол применяемых в производстве древесностружечных и древесноволокнистых плит, фенопластов и аминопластов (напр. стеклопластиков) и др. композиционных материалов, клеев, лаков, шлифовальных материалов и т.д..
Формальдегид применяется при изготовлении изопрена, полиацетальных смол, пентаэритрита, триметилопропана, уротропина, этриола, дифенилметанизоцианата (МДИ) и некоторых др. химикатов.
Водный раствор формальдегида (метандиол), стабилизированный метанолом, — формалин — вызывает денатурацию белков, поэтому он применяется в качестве дубителя в кожевенном производстве и дубления желатина при производстве кинофотоплёнки. Основным потребителем формальдегида (70-75%) является промышленность пластмасс. Из формальдегида производят основы для маслорастворимых лаков, клеи для фанеры, ионообменные смолы для водоочистки, дивинил и изопрен, многоатомные спирты и непредельные альдегиды. Так же на основе формальдегида производятся взрывчатые вещества, красители и медикаменты. Формалин используют в сельском хозяйстве для протравливания семян перед посевом. Формальдегид применяется в качестве средства фумигации, в частности при хранении и транспортировке зерна. В пищевой промышленности зарегистрирован под кодом E240.
2 Промышленные методы получения.
В промышленности формальдегида получают окислительным дегидрированием метанола или окислением углеводородных газов.
При производстве формальдегида из метанола в качестве основного продукта получается достаточно чистый формальдегид, содержащий некоторое количество метанола и следы муравьиной кислоты, в то время как при производстве его путем окисления углеводородов образуется смесь альдегидов, спиртов, кетонов, жирных кислот и других продуктов, которые нужно подвергнуть дальнейшей очистке.
Производство формальдегида из метанола.
Получение формальдегида из метанола было разработано раньше других путей производства формальдегида и до сих пор остается главным способом получения его в промышленности. Этот способ заключается в пропускании смеси метанола и воздуха над нагретым неподвижным катализатором при атмосферном давлении с дальнейшим поглощением отходящих газов водой для получения водного раствора формальдегида. В настоящее время этот процесс осуществляется двумя путями. По первому, применяют серебряный или медный катализатор и богатую смесь метанола с воздухом. В этом методе, отходящие газы содержат 18-20% водорода и менее 1% кислорода, а также небольшие количества метана и окислов углерода. По второму способу, предусматривающему применение окисных катализаторов, например окисей железа и молибдена, используются бедные смеси метанола с воздухом и получаются растворы формальдегида, практически свободные от непрореагировавшего метанола. В этом случае отходящие газы содержат непрореагировавший кислород и почти не содержат водорода.
Каталитическое дегидрирование или каталитическое окисление спиртов в карбонильные соединения с тем же числом атомов углерода представляет общий метод получения альдегидов и кетонов.
Каталитическое дегидрирование метанола, протекающее на меди, никеле и платине по уравнению:
CH3OH↔CH2O + H2 – 20 ккал
Требует затраты тепла, предъявляет повышенные требования к чистоте исходного спирта и дает небольшие выходы формальдегида. Поэтому в технике предпочитают каталитически окислять метанол кислородом воздуха по уравнению:
CH3OH + ½ O2 → CH2O + H2O + 38 ккал
В условиях проведения промышленного процесса протекает либо первая реакция, сопровождающаяся окислением водорода в количестве, соответствующем присутствующему в смеси кислородом:
H2 + ½ O2 → H2O + 58 ккал,
либо сочетание всех трех реакций. Последние две реакции окисления в этом случае поставляют тепло для первой реакции, сдвигают ее равновесие вправо и поддерживают катализатор в активном состоянии. Хотя кислорода вводят в процесс меньше, чем требуется по теории, тем не менее наблюдаются побочные реакции окисления, уменьшающие выход формальдегида и загрязняющие продукт. Эти реакции можно в значительной степени подавить точной регулировкой температуры и при работе с металлическими катализаторами введением паров воды.
Процесс, протекающий на серебряном катализаторе, целиком определяется эндотермической реакцией дегидрогенизации, а горение водорода лишь возмещает недостачу тепла. Температура на серебряном контакте является важным фактором, в большей степени определяющим выход формальдегида, чем точнее соотношение метанол – воздух в рабочей смеси. Однако, допустимая концентрация кислорода имеет определенный предел, так как нагревание не должно приводить к такому повышению температуры, при котором происходит уже значительное разложение метанола или формальдегида.
Для того, чтобы получать высокие выходы продукта, необходимо путем соответствующей регулировки температурного и технологического режима свести к минимуму следующие нежелательные реакции: а) пиролитическое разложение формальдегида; б) дальнейшее окисление формальдегида в муравьиную кислоту, окислы углерода и воду:
а) CH2O → CO +H2
б) СH2O + ½ O2 → HCOOH или CO + H2O
CH2O + O2 → CO2 + H2O
Термическое разложение формальдегида при 3000С протекает с небольшой, но измеримой скоростью, быстро возрастающей при повышении температуры выше 4000С.
Существует два принципиально различных направления в проведении окисления метанола:
а) частичное окисление метанола на металлических катализаторах
(медь, серебро, платина) воздухом, взятым в недостатке;
б) полное окисление метанола избытком воздуха на окисных катализаторах.
В обоих случаях следует обращать внимание на взрывоопасность смесей метанола с воздухом и работать в безопасных пределах. При 60° и ниже пределы воспламенения равны 6—8÷25—З7% объемы. СНЗОН в воздухе. При повышении температуры эти пределы несколько расширяются.
При частичном окислении метанола к воздушно-спиртовой смеси, содержащей более 35% объема. СН30Н‚ добавляют водяной пар и пропускают над катализатором (преимущественно серебро) при 600—650°. При этом на 45% протекает дегидрирование и на 55 % окисление, так что суммарный процесс слабо экзотермичен. В отходящих газах содержатся водород и немного кислорода. Выход СН2О равен 83—92% на прореагировавший спирт и 60—73% на пропущенный. В полученном формалине содержится значительное количество метанола.
Каталитическое окисление метанола на серебряном катализаторе.
Сущность метода состоит в парофазном окислении гидрировании метанола кислородом воздуха в адиабатическом реакторе с последующим поглощением продуктов реакции водой. В процессе подается метаноло-воздушная смесь состава выше верхнего предела взрываемости (36,4% - объемные доли) и с недостатками кислорода по химическому уравнению окисления метанола в формальдегид, т.к. катализатор – окислительно - дегидрирующийся:
СН3ОН+2О2 →СН2О+Н2О+Q(147,4кДж/моль);
СН3ОН→СН2О+Н2 –Q(93,4кДж/моль);
Н2 +2О2 →Н2О+Q(241,8кДж/моль).
Вместе с тем протекают побочные реакции, что снижает выход формальдегида и повышает расход метанола. Выход формальдегида достигает 80 – 85%, при степени конверсии метанола 85 – 90%. Так как окислительное дегидрирование проводят при недостатке кислорода, процесс глубокого окисления, не получает значительного развития. В то же время само дегидрирование, инициируемое кислородом, протекает быстрее, поэтому процент побочных реакций не велик. Этим способом можно получить формалин двух марок: ФМ – 37% с содержанием метанола до 10% и ФБМ – 50% с содержанием метанола менее 1%. Транспортировке и хранению подлежит формалин марки ФМ, т.к. метанол стабилизирует его.
Каталитическое окисление метанола на оксидных катализаторах.
На практике в качестве оксидных катализаторов наибольшее распространение получила смесь оксидов железа (III) и молибдена (VI) с атомным соотношением молибдена и железа от 1,7 до 2,5. Катализатор готовят соосаждением соли трехвалентного железа, например нитрата или хлорида, с молибдатом аммония. При нагревании и прокалке исходная смесь превращается в твердый раствор оксида молибдена (VI) в молибдате железа. Окисление метанола на оксидных катализаторах протекает по окислительно-восстановительному механизму:
CH3OH +2MoO3 → CH2O + H2O + Mo2O5
Mo2O5 + ½ O2 → 2MoO3
или CH3OH + ½ O2 → CH2O + H2O ΔH = 147 кДж/моль
На оксидных катализаторах процесс проводят при 523-673 К и степени конверсии метанола 98-99%. Метод окислительного дегидрирования метанола на оксидном катализаторе реализован в промышленности фирмой "Монтэдисон".
Образование формальдегида путем дегидрогенизации метанола изучалось в 1910 г. Сабатье и Мэлье, которые показали обратимость этой реакции. Позднее Ньютон и Долж количественно исследовали это равновесие и нашли, что
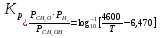
Расчет равновесия при атмосферном давлении, показывает, что дегидрогенизация метанола с образованием формальдегида и водорода должна достигать 50% при 4000С, 90% при 5000С и 99% при 7000С. Однако получать такие выходы с помощью одной лишь реакции дегидрогенизации нелегко, так как в отсутствие воздуха эта реакция идет медленнее, чем распад формальдегида до окиси углерода и водорода.
Водяные пары оказывают благоприятное и, несомненно, специфическое действие на процесс получения формальдегида на металлических катализаторах. Такое влияние водяных паров впервые отмечалось Трилла в 1903 г позднее об этом же сообщал Томас, изучавший процесс получения формальдегида в присутствии водяных паров на серебряном катализаторе. Основной эффект, который отмечается в этих работах, состоит в понижении температуры реакции и повышении выхода формальдегида, что, по-видимому, обусловлено подавлением нежелательных реакций. Уль и Купер приводят аналогичные данные, полученные при прибавлении водяного пара во всем возрастающих концентрациях к смеси, содержавшей около 40% метанола и 60% воздуха.
По первоначальному методу, с помощью которого Гофман впервые получал формальдегид, смесь воздуха и паров метанола, образовавшаяся при просасывании воздуха через резервуар с жидким метанолом, пропускалась через склянку с нагретой платиновой спиралью. Раз начавшись, реакция в дальнейшем поддерживалась за счет собственного тепла, что было заметно по накалу спирали. При проведении этого процесса иногда наблюдались взрывы, для устранения которых Фольгард предложил схему с использованием спиртовки, наполненной метанолом и снабженной фитилем, соприкасающимся с платиновой спиралью. В дальнейшем Каблуков нашел, что платину можно заменить платинироцанным асбестом, помещенным в нагретую трубку. Нагревая метанол в сатураторе на водяной бане, Толленс регулировал соотношение воздуха и паров метанола в смеси и обнаружил, что оно оказывает непосредственное влияние на выход формальдегида. Наряду с другими, менее значительными усовершенствованиями, такой прием регулировки состава рабочей смеси был применен к процессу, видоизмененному Лёвом, который заменил платиновую спираль медной сеткой. Лёв пропускал сильный ток сухого воздуха через холодный метанол (около 18°) И направлял полученную смесь в трубку длиной 30 см из тугоплавкого стекла, в которой помещался цилиндр Из крупной медной сетки длиной 5 см. Часть трубки, где находился медный катализатор, была обернута латунной сеткой и осторожно нагревалась. При пропускании рабочей газовой смеси через катализатор он нагревался до свечения, яркость которого зависела от скорости потока. Продукты реакции по выходе из стеклянной трубки пропускались через большой пустой сосуд и две склянки, наполовину заполненные водой. При непрерывном ведении процесса получающиеся растворы содержали до 15—20% формальдегида. В условиях когда метанол был нагрет до 45—500, а реакционная газовая смесь пропускалась над медным катализатором, помещенным во избежание взрыва между асбестовыми диафрагмами, превращение метанола в формальдегид достигало 30%.
После этих первых Исследований, Дополненных в 1886 г. экспериментальным доказательством возможности непрерывного процесса, стала реальной организация промышленного производства формальдегида. Трудно проследить в деталях ход развития промышленных методов, так как практические достижения нередко держались в секрете..
В 1889 г. во Франции и в Германии Августу Трилла были выданы первые патенты на способ производства формальдегида. Процесс, отличавшийся лишь незначительными улучшениями по сравнению с методами Лёва и и Толленса, состоял в следующем. Метанол в распыленном состоянии пропускался через нагреваемую снаружи медную трубку, заполненную коксом и битым кирпичом, причем и кокс и медь служили катализаторами.
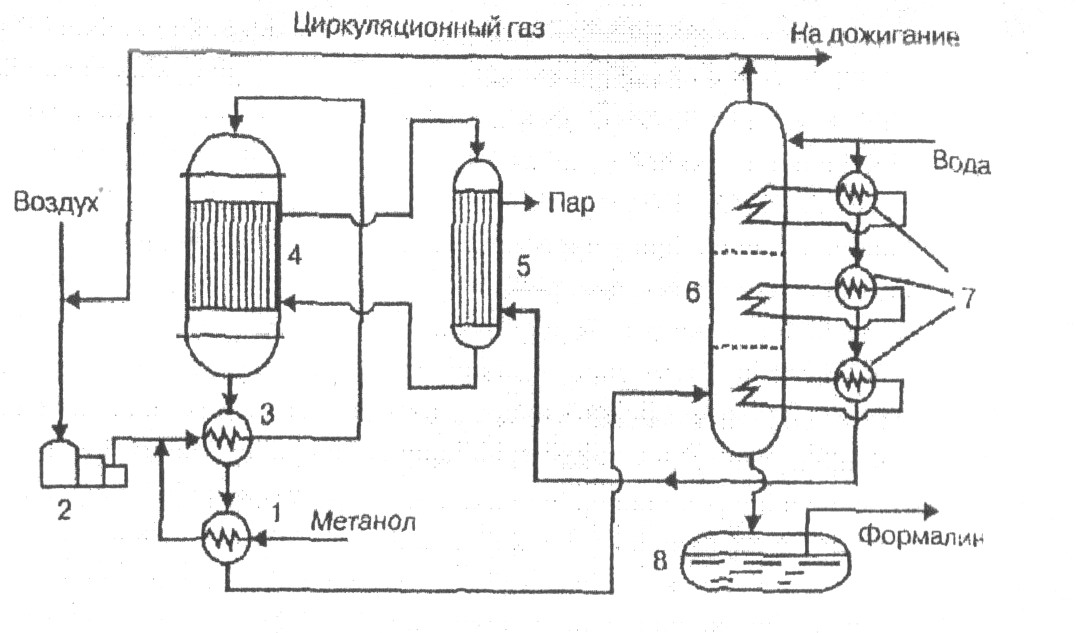
Рисунок 1-Технологическая схема окисления метанола.
1,3 — теплообменники, 2 — турбокомпрессор, 4 — реактор, 5 — котел-утилизатор, 6 — абсорбер, 7 — выносные теплообменники, 8 — сборник формалина.
Съем тепла и тепловой режим в реакторе обеспечивается хладоагентом, циркулирующим через котел-утилизатор 5. Реакционная смесь, выходящая из реактора 4, охлаждается в теплообменниках 3 и 1 и поступает в абсорбер 6, орошаемый водой. Тепло абсорбции отводится и утилизируется в выносных теплообменниках 7, подогревающих обессоленную воду, подаваемую на абсорбцию и питающую котел-утилизатор 5, вырабатывающий технологический пар. Образующийся формалин выводится из нижней части абсорбера и поступает в сборник 8. Часть отходящих из верхней части абсорбера б газов смешивается с воздухом перед входом его в реактор для снижения взрывоопасности смеси воздуха с парами метанола, а остальное количество их направляется в печь для дожигания (на схеме не указана) и выбрасывается в атмосферу. Из нижней части абсорбера вытекает формалин— водный раствор формальдегида, содержащий 37,6% НСНО и около 10% СН3ОН. Метиловый спирт стабилизирует формальдегид, предотвращая его полимеризацию. Формалин направляют на склад как товарную продукцию. Для получения концентрированного формальдегида формалин подвергают ректификации. Производство формальдегида по этой схеме работает по замкнутому циклу и в нем отсутствуют отходы, сточные воды и вредные газовые выбросы.
Восстановление окислов углерода.
Производство формальдегида прямым восстановлением окислов углерода водородом всегда привлекало внимание исследователей своей экономичностью и простотой, так как окислитель дешев и имеется в изобилии, а процесс энергетически выгоден.
Ипатьев и Монро предполагают, что синтез метанола из двуокиси углерода и водорода под давлением проходит через промежуточную стадию образования формальдегида, дальнейшее превращение которого в метанол может идти двумя путями: часть метанола получается непосредственной гидрогенизацией, а часть – путем превращения формальдегида по реакции Канницаро.
С медно-алюмоокисным катализатором реакция протекает при температурах 282 – 4870С и давлениях 117 – 410 атм.
Однако на пути промышленного использования этого метода лежат значительные трудности, а именно:
1) необходимость разделять очень сложные смеси продуктов окисления;
2) необходимость работать при большом избытке воздуха или углеводорода (в невзрывоопасных пределах), что удорожает выделение продуктов реакции из разбавленных газов и снижает производительность оборудования;
З) трудность задержания процесса окисления углеводородов на промежуточных стадиях, поскольку процесс имеет склонность самопроизвольно доходить до образования не представляющих ценности конечных продуктов —двуокиси углерода и воды.
Константа равновесия реакции восстановления окиси углерода:
CO + H2 ↔ CH2O
Была определена Ньютоном и Доджем. Согласно их опытам, проводившимся при 2500С,
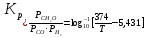
Выход формальдегида, вычисленные по этой формуле, приведены в таблице 1, составленный Кохом.
Таблица 1. Выход формальдегида, вычисленные по данным для равновесия
CO +H2 ↔ CH2O
Температура
|
Выход CH2O в мольных процентах при давлении
|
0С
|
Абс.
|
1 атм
|
100 атм
|
1000 атм
|
10000 атм
|
27
|
300
|
0,002
|
0,16
|
1,6
|
13
|
127
|
400
|
0,001
|
0,06
|
0,6
|
5,5
|
227
|
500
|
0,0005
|
0,01
|
0,3
|
3
|
Для достижения практически приемлемых выходов процесс нужно вести при очень высоких давлениях. Помимо этого, прошлось бы применять особо активный и селективно действующий катализатор, который позволил бы достигать равновесия достаточно быстро и в то же время избежать гидрогенизации образовавшегося формальдегида. Данный путь синтеза формальдегида представляется невыгодным.
При гомогенном газофазном окислении углеводородов молекулярным кислородом получается сложная смесь продуктов, число которых значительно, даже если исходным сырьем служит чистый метан. С увеличением молекулярного веса углеводорода число продуктов окисления растет. Присутствие примесей усложняет состав продуктов окисления, и, как правило, предпочитают окислять чистые углеводороды, а не их смеси. На практике исследователи уделяли основное внимание окислению метана, этана, пропана и бутана, поскольку молекулярный вес последних невелик, а само-получение их в чистом виде достаточно легко и экономично, особенно двух последних.
Окисление пропана и бутана имеет и другие преимущества по сравнению с окислением метана и этана. Во-первых, пропан и бутан окисляются при более низких температурах. Во-вторых, пропан и бутон легче отделяются от других газообразных продуктов окисления, чем метан и этан, что исключительно важно, так как обычно окисление проводят при избытке углеводорода, который необходимо возвращать в процесс. В—третьих, при получении чистых исходных газов пропан и бутан легче отделять от метана и этапа, а также друг от друга, чем метан от этана.
Наибольшая трудность в осуществлении промышленного окисления низших метановых углеводородов заключается в разделении продуктов реакции. Ацетальдегид и формальдегид (представляющие основной интерес) отделяются от остальных продуктов достаточно легко. Однако себестоимость их значительно снизится, если будет налажено выделение других, весьма ценных продуктов. Последнее очень трудно осуществить, ибо эти смеси дают большое число азеотропов; приходится использовать все виды техники разделения: простые, азеотроппые и экстрактивные перегонки, экстракцию жидкостей жидкостями, ионный обмен и др. Достаточно указать, что на заводе в г. Эдмондтон (Канада), где окисляют пропан и бутан, для разделения продуктов реакции установлено более 25 колонн.
Окисление природного газа и низших алканов
Получение формальдегида прямым окислением природных газов с точки зрения доступности, низкой стоимости сырья и простоты технологии является предпочтительным по сравнению с довольно сложным многостадийным синтезом формальдегида через метанол. Однако на практике получение формальдегида окислением метана сопряжено с целым рядом трудностей, связанных в основном с недостаточной устойчивостью формальдегида в условиях реакции. Некаталитическое окисление метана с заметной скоростью происходит при температуре выше 873 К. В то же время термическое разложение формальдегида наблюдается уже при 673 К. Кроме того, образовавшийся формальдегид в присутствии кислорода легко подвергается дальнейшему окислению. Поэтому на практике окисление метана проводят при малых степенях конверсии, причем
и в этих условиях селективность образования формальдегида невысока. В силу этих обстоятельств рассматриваемый метод не получил большого промышленного распространения. Гомогенное окисление метана представляет собой типичную свободнорадикальную реакцию. В отсутствие инициатора реакция характеризуется наличием индукционного периода. Для его устранения или уменьшения к метано-воздушной смеси добавляют вещества, легко распадающиеся на свободные радикалы - чаще всего азотную кислоту или оксид азота, а также озон, пероксид водорода, летучие алкилы свинца, диметиловый эфир и др. В некоторых случаях в качестве окислителя можно применять диоксид углерода. Механизм окисления метана может быть описан следующей схемой:
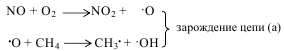
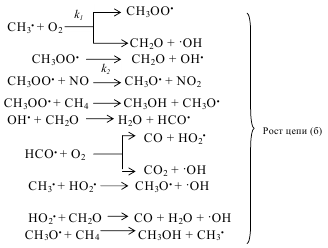
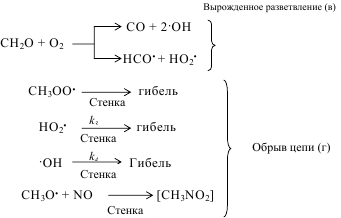
Энергия активации суммарной реакции (а) равна 117, а реакции (б) 301±13 кДж.
Превращение метана ускоряется при добавлении к исходной смеси продуктов окисления.
Для интенсификации процесса окисления можно использовать гетерогенные катализаторы, в частности кварц, алюмосиликаты и другие, и проводить процесс при 773-973 К. Для повышения активности алюмосиликаты пропитывают кислотами, например, фосфорной или борной. Как правило, степень конверсии метана в процессе окисления не превышает 20% при селективности по формальдегиду 30-40%. Получение формальдегида инициированным гомогенным газофазным окислением природного газа осуществлено в Германии. В качестве инициатора применяется смесь оксидов азота. Исходный природный газ смешивается с воздухом в соотношении 1:3,7. Полученную газовую смесь нагревают до 673 К за счет тепла продуктов окисления, после чего к ней добавляют 0,08% оксидов азота. Нагретую смесь направляют в трубчатый стальной реактор печного типа, футерованный керамикой. Температура реактора доводится до 873 К за счет сжигания части отходящих газов. Продукты реакции охлаждаются до 473 К в теплообменнике и поступают в скруббер, орошаемый водой, в котором поглощается формальдегид с примесями метанола и муравьиной кислоты. Полученный раствор нейтрализуют и направляют на ректификацию. В качестве погона ректификационной колонны отбирают формалин, содержащий 34% формальдегида и 3% метанола. Выход
формальдегида за проход (в расчете на свежий метан) равен 3-5% при селективности по формальдегиду 10%. Из побочных продуктов 97% составляют оксиды углерода.
Окисление углеводородов С2-С4 имеет много общих характеристик с окислением метана, хотя имеются и специфические особенности. Технология этого процесса была реализована фирмой "Селаниз Кемикал" (США).
3 Сравнение методов получения формальдегида
Метод
|
Достоинства
|
Недостатки
|
Каталитическое окисление метанола на серебряном катализаторе
|
Практически нет ограничений по мощности единичной установки.
Простота конструкции реактора.
Низкая металлоемкость и энергоемкость.
Высокая производительность.
|
Высокий расходный коэффициент по сырью.
Наличие в формалине до 8-11% метанола.
Повышенное содержание муравьиной кислоты в обезметаноленном формалине.
Расход драгоценного металла - серебра
|
Каталитическое окисление метанола на оксидном катализаторе
|
Низкий расходный коэффициент по сырью.
Товарный формалин содержит не более 0,6-1% метанола и не выше 0,02% муравьиной кислоты
|
Повышенный расход энергии и воздуха.
Ограничения по единичной мощности установки.
Сложность эксплуатации и ремонта реактора.
Повышенная металлоемкость
|
Окисление природного газа и низших алканов
|
Низкая стоимость сырья.
Простота технологии
|
Недостаточная устойчивость формальдегида в условиях реакции.
|
Восстановление окислов углерода.
|
Дешевый окислитель.
Энергетически и экономически выгодный.
|
Необходимость разделять очень сложные смеси продуктов окисления;
Необходимость работать при большом избытке воздуха или углеводорода.
Трудность задержания процесса окисления углеводородов на промежуточных стадиях.
|
Заключение
Из всего вышесказанного можно сделать вывод о том, что развитие производства формальдегида довольно перспективно. Разнообразный характер применения формальдегида объясняется дешевизной и доступностью сырья. Для получения формальдегида есть развитая сырьевая база, а технология изготовления его сравнительно проста.
Чистый формальдегид в жидком и газообразном состояниях легко полимеризуется даже при низкой температуре, вследствие чего в технике используют его водные растворы (формалин) или полимерные формамы (триоксан, параформ).
Формальдегид является токсичным веществом, запускающим мутагенные процессы в человеческом организме, провоцирует развитие онкологических заболеваний, аллергии, угнетает деятельность нервной системы, купирует нормальную деятельность дыхательной системы.
При контакте с концентрированным техническим формалином происходит глубокий некроз кожи участка, подвергнутого воздействию вещества, может развиться почечная и печеночная недостаточность.
Список использованной литературы
Огородников С.К. Формальдегид. – Л.: Химия, 1984. – 280 с.
Соколов Р.С. Химическая технология. Учебное пособие для ВУЗов. Т.2. – М.: Гуманит. изд-во ВЛАДОС, 200. – 448 с.
Основы химии и технологии мономеров. Учебное пособие / Н.А. Платэ, Е.В. Сливинский. М.Наука, 2002, 696 с.
Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. – М.:Альянс, 2013. – 592 с.
Уокер Дж.Ф. Формальдеид. Пер. со 2-го изд. (Нью Йорк: American Chemical Society Monograph Series, 1953 ) – M.: Госхимиздат, 1957. - 608 с.
Динцес А.И., Потоловский Л.А. Основы технологии нефтехимического синтеза. – М.: Гостоптехиздат, 1960, 852 с.
|
|
|
 Скачать 209.51 Kb.
Скачать 209.51 Kb.