Шпаргалка К Экзамену По Коллоидной Химии Для Дневников (Зименкова Л. П.). Шпаргалка К Экзамену По Коллоидной Химии Для Дневников (Зименков. 1Коллоидная химия. Свойства коллоидных систем. Признаки объектов коллоидной химии
 Скачать 295.5 Kb. Скачать 295.5 Kb.
|
|
1Коллоидная химия. Свойства коллоидных систем. Признаки объектов коллоидной химии. Коллоидная химия – наука о поверхностных явлениях и дисперсных системах. Поверхностные системы – это процессы, происходящие на границе раздела фаз в межфазном поверхностном слое и возникающие в результате взаимодействия сопряженных фаз. Причина возникновения поверхностных явлений – существование на границе ненасыщенного поля межатомных, межмолекулярных сил, которые возникают из-за разного состава и строения соприкасающихся фаз. Дисперсные системы – гетерогенные системы, состоящие из двух и более фаз, одна из которых дисперсная раздроблена, а другая дисперсионная среда - непрерывная часть системы. Свойства коллоидных систем: 1Рассеяние света; 2Медленная диффузия; 3Малое осмотическое давление; 4Коллоидные растворы способны к диализу (с помощью мембраны могут быть определены от примесей); 5Способность к коагуляции (разрушение); 6Возможность явления электрофореза (перемещение частиц под действием внешнего электрического поля). Признаки коллоидной системы: - гетерогенность; -дисперсность. 2. Классификация коллоидных систем. 1)d-дисперсность, размер частиц дисперсной фазы а) Наносистемы d=1-10 нм, б)Высокодисперсные d=10нм-1 мкм, в)Грубодисперсные d=1-100 мкм. 2) Фракционный состав а) Монодисперсные(один радиус), б)Полидисперсные. 3) Кон-я частиц дисперсной фазы. 4)Характер распределения фаз : а) Сплошное-континуальное б) Сетка тонких прослоек-сетчатое-биконтинуальное. 5)Взаимодействие между частицами дисперсной фазы(по кинетическим фазам) а)свободно-дисперсные(малая концентрация V, ж или г дисперсионная среда), б)связно-дисперсные(Vбольшая-биконтинуальные, ТВ.д.ср). 6) Взаимодействие между ч.д.ф и дис.средой: а)Лиофильные (хорошо растворяются, самопроизвольно диспергируются, термодинамически устойчива)-р-ры коллоидных ПАВ, р-ры ВМВ, б)Лиофобные-обладают избытком энергии, для них х-на коагуляция, получают непроизвольно, ТД неустойчивы, самопроизвольно разрушаются. 7) Агрегатное состояние фаз(т/ж –континуальные золи, суспензии,пасты, биконтинуальные гели, т/г – дымы, пыли, порошки, т/т – композитные материалы, горные породы, сплавы. Ж/Ж – эмульсии(молоко, нефть), Ж/Г – туманы, облака, газовые эмульсии, Ж/Т – клетки в человеке. Г/Ж – газированная вода, жидкие пены, Г/Г – нет, Г/Т – почвы, хлеб, сыр, твердые пены, пемза,капиллярные системы с газообразными вещ-ми. 3. Получение КС Диспергационные методы. Дисперг методы-Это способы получ лиофобных золей путем дробления крупных кусков до агрегатов коллоидных размеров. В зав-ти от вида внешн. работы, которая соверш над грубодисперсной системой, подразделяют на: 1)мех. Диспергир - это мех дробление грубодисперсн сист путем: раздробления, удара, истирания, расщепления. Измельчение частиц до мелких размеров с помощью шаровых мельниц. Шар мельница-это полый цилинр сосуд,заполненный частично шарами того же материала и при медленном вращении шары перекатыв, истирая и дробя материал. Работами Ребиндера устан явл понижения сопротивл тв тел упругим и пластич деформац, а также мех разруш пол влиянием адсорбции ПАВ. ПАВ облегчают дисперг и способств значительному повышении степени дисперсности. Мех дисперг –это оч энергоемкий процесс. 2)Физ дисперг - дисперг ультразвуком, происходит за счет разрывающих усилий. Они возник в жик или тв теле при прохождении через них ультразвуковых колеб с частотой более 20.000Гц в сек. При прохождении звук волны в сист возникают местные, быстро чередующиеся сжатия и расширения в-ва, котор приводят к его разрушению.Этот метод применим только при дисперг малопрочных в-в (сера, крахмал и тд). 3)Физ-хим способ-метод пептизации. Измельчен материал или промытый осадок в-ва, получ в рез-те хим реакции осаждения, промыв небольшим кол-вом р-ра пептизатора, образ высокодисперсная сист.Не могут пептизироваться плотные, тяжелые осадки,а наоборот, рыхлые, свежеприготовленные. Фактич пептизация –это не дисперг. Пептизир осадок-это уже диспег материал, доведенный до коллоидн степени измельчения, в котор частицы в рез-те слипания образ крупный агрегат. Пептизация-это наруш связей между слипшимися частицами. Чем слабее эти связи, тем легче происх пептиз. 4.Конденсационные методы получения дисперсных систем. Системы с размером частиц -100 нм получают кондесационными методами.В основе конденсационных методов лежит процесс образования дисперсной фазы из веществ, находящихся в молекулярном или ионном состоянии – создание пересыщенного раствора, из которого должна быть получена коллоидная система. Физические методы конденсации: 1) охлаждение паров жидкостей или твердых тел при адиабатическом расширении или смешивании их с большим объемом воздуха; 2) замена на другой растворитель,в котором диспергируемое вещество хуже растворяется. (туман, смог). Замена растворителя приводит к образованию золя в тех случаях, когда к исходному раствору добавляют другую жидкость, которая хорошо смешивается с исходным растворителем, но является плохим растворителем для растворенного вещества. Химические методы конденсации основаны на выполнении различных реакций, в результате которых из пересыщенного раствора осаждается нерастворенное вещество, не только обменные, но и окислительно-восстановительные реакции, гидролиза и т.п.Дисперсные системы можно также получить методом пептизации, который заключается в переводе в коллоидный «раствор» осадков, частицы которых уже имеют коллоидные размеры. 5.Очистка коллоидных систем: диализ, ультрафильтрация. Для очистки коллоидных растворов от примесей используют такие методы, как фильтрация, диализ, электродиализ, ультрафильтрация. Фильтрация (основана на способности коллоидных частиц проходить через поры обычных фильтров.При этом более крупные частицы задерживаются. Элементарный процесс фильтрования может происходить только при условии, что имеет место разность давлений жидкости над перегородкой и под ней. Диализ - удаление с помощью мембран низкомолекулярных соединений из коллоидных растворов и растворов ВМС. При этом используют свойство мембран пропускать молекулы и ионы малого размера и задерживать коллоидные частицы и макромолекулы. Жидкость, подвергаемую диализу, отделяют от чистого растворителя соответствующей мембраной. Малые молекулы и ионы диффундируют через мембрану в растворитель и при его достаточно частой замене почти нацело удаляются из диализуемой жидкости. Проницаемость мембраны для низкомолекулярных веществ обусловливается тем, что малые молекулы и ионы или свободно проходят через капилляры, пронизывающие мембраны, или растворяются в веществе мембраны. Электродиализ позволяет в несколько десятков раз увеличить скорость диализа низкомолекулярных электролитов. С этой целью в диализаторе создают постоянное электрическое поле с падением потенциала 20—250В/см и выше. Ультрафильтрация применяется для очистки систем, содержащих частицы коллоидных размеров (золи, растворы ВМС, взвеси бактерий и вирусов). Суть метода - в продавливании разделяемой смеси через фильтры с порами, пропускающими только молекулы и ионы низкомолекулярных веществ. 6. Межмолекулярное взаимодействие. Молекулярные силы (силы Ван-дер-Ваальса). Межмолекулярное взаимодействие может иметь разный характер: 1)Химические связи - образуются путем перекрывания электронных орбиталей и потому сугубо специфичны. 2)Водородные связи возникают между молекулами, содержащими функциональную группу OH (кислоты, щелочи, вода, спирты). 3)Силы Ван-дер-Ваальса. Молекулярные связи, которые действуют между любыми молекулами. Силы межмолекулярного воздействия при поляризации молекул и образования диполей. К этим силам относят: а) ориентационные – возникают между полярными молекулами в результате взаимодействия дипольных моментов. Из-за диполь-дипольного взаимодействия молекулы приобретают определенную ориентацию относительно друг друга. б) индукционные – у полярных и неполярных молекул. Диполь-неполярные молекулы возникают в электрическом поле или под действием поля полярной молекулы. в) дисперсионные силы действуют между всеми молекулами и возникают из-за непрерывного движения электронов в атомах, приводящего к образованию мгновенных диполей. Электрическое поле мгновенного диполя 1-ого атома индуцирует дипольный момент другого атома, что приводит к возникновению сил притяжения. Различие между химическими и молекулярными связями: 1) по величине энергии( Емол=5-50 кДж/моль, Ехим=80-800) 2) по радиусу действия rхим=10-10м,rмол>10-9м, 3)молекулярные силы не специфичны, 4)мол силы аддитивны, хим силы насыщаемые. 7. Поверхностное натяжение. Зависимость поверхностного натяжение от различных факторов. Методы измерения поверхностного натяжения. Пов.нат. – численно = работе обратимого изотермич. обр-я ед пов-ти. ПН-частная производная от любого ТД потенциала по площади поверх. Раздела фаз при соотв. Сonst параметрах. ПН – колич. Равно поверхностной силе, действ.на ед.длины контура, огранич. Поверхность жидк.Сила ПН направлена тангенциально пов-ти раздела фаз. [σ]=Дж/м2=Н/м. Ф 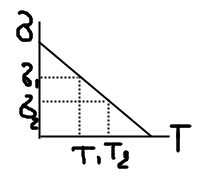 акторы: 1) температура: с ув-ем T пов.нат. уменьшается: усиливается тепловое дв-е мол-л, кот.ведет к ослаблению межмол. вз-я => ум-ся внутр.давл => ум-ся пов.нат. акторы: 1) температура: с ув-ем T пов.нат. уменьшается: усиливается тепловое дв-е мол-л, кот.ведет к ослаблению межмол. вз-я => ум-ся внутр.давл => ум-ся пов.нат. 2) природа фазы: чем больше межмол. вз-е внутри фазы, тем больше пов.нат на границе раздела фаз. 3) природа граничащих фаз: чем больше межмол. вз-е между контактирующими фазам, тем меньше пов.нат на границе раздела этих фаз. Если жид. Раств-ся друг в друге, то пов.нат на границу ж1/ж2 приблизит-но равны разности пов.нат взаимно насыщ.жид-й на границе с возд. 4) влияние добавок: 1.ПНАВ; 2.ПИАВ (р-ры электролитов, кот. в воде дисс-ют с обр-ем ионов, ионы гидротируются, т.к. Еион/н2о>Eн2о/н2о, поэтому ионы интенсивно втяг-ся вглубь р-ра и әσ/әС>0. 3.ПАВ(орган. мол-лы с несимметрич.дефильным строением из непол. УВ-рад и пол группы. Молекула ПАВ из-за дефильного строения по-разному взаим.с мол-ми воды в рас-ре полярная часть легко гидратируется, а неполярный УВ-радикал слабо взаим с водой, но при этом мешает диполям воды взаим.друг с другом. Энергия сист увелич. Поэтому энергетич выгоднее удалить неполярные радикалы из объема с образ.ориентированного слоя,в кт полярная часть обращена к воде, а неполярная в воздух). Методы определения: 1) статч: осн. на изуч. утстойч. равновес. сост, к кот.самопроизв.прих.сист. 1.метод капиллярного поднятия (рис+формула) 2. м.висячей или лежачей капли: осн.на изуч-и формы капель в поле силы тяж. Ведется учет отклон-я их формы от сферич. (рис) 3. м.уравновеш-я пластинки: толщ.d закреп.на коромысле весов погруж.в исслед.жид.,кот.хорошо.смач.её пов-ть. σ=F/2d.Суммарный вес жидк.и сила F, кт надо приложить для уравновешивания пластинки не зависит от формы миниска и при угле Q=0 равен ПН. 2)полустатич: осн. на изуч. усл, при кот сист. теряет равновесие. 1. метод наиб.давл.в пузырьке газа σ =1/2ΔPmax*r0(рис).Растет пузырек воздуха 2. метод отрыва кольца σ=F/4πr*K (рис). Усилие по отрыву от кольца пропорционально ПН. 3.сталагмометрич: осн. на опред. веса капель,отрыв.под дейст.силы тяж. в момент отрыва капли её вес уравновеш.силами пов.нат, умнож.на d капилл. Р=2πr0σ/K (рис) 3) днамческие: метод колеблющихся струй: изуч.св-ва поверх.жид.через малые пром-ки врем после их образ-я. С пом-ю эллиптич.отв-я образ.струю в форме эллиптич.цил. под д-ем сил пов.нат.,кот стрем.придать ф-му цил с круговым сечением и инерционных сил устан поперечное колеб.струи.Большая и малая ось эллипса постоянно меняются. 8. Внутренняя поверхностная энергия. Поверхностная энергия – это избыток энергии в тонком слое вещества у поверхности соприкосновения фаз по сравнению с энергией вещества внутри фазы. Полная поверхностная энергия складывается из работы образования поверхности, т.е. работы, необходимой для преодоления сил межмолекулярного взаимодействия при перемещении молекул из объема фазы в поверхностный слой, и теплового эффекта, связанного с этим процессом. В соответствии с термодинамическими зависимостями удельная полная п.э. равна: dU=- T (∂σ/∂T)+σ/ при V=const уравнение Гиббса-Гельмгольца. σ уменьшается линейно с ростом Т. И в линейной области ∂σ/∂T = const, ∂2σ/∂T2=0, дифференциальное уравнение по Т дает: ∂U/∂T=∂σ/∂T-∂σ/∂T-Т(∂2σ/∂T2), ∂U/∂T=0. Таким образом, величина U является температурным инвариантом. Благодаря этому свойству удельная поверхностная энергия – одна из важнейших характеристик межмолекулярных сил в чистых жидкостях. 9. Физическая адсорбция и хемосорбция. Количественные характеристики адсорбции. Адсорбция – процесс самопроизвольного изменения концентрации компонентов системы между поверхностным слоем и объемной фазой. В зависимости от характера сил, действующих между частицами адсорбата и адсорбента, различают физическую и химическую (хемосорбцию). Физическая адсорбция происходит под влиянием сил Ван-дер-Ваальса и по своей природе аналогична процессам конденсации паров адсорбата. Хемосорбция обусловлена перекрыванием электронных орбиталей частиц адсорбата и адсорбента, т.е. вызывается их химическим взаимодействием. Теплота хемосорбции соизмерима с теплотами химических реакций.Qфиз<=20 кДж/моль,Qхим=80-800кДж/моль. Хемосорбция необратима, физическая обратима. Физическая малоспецифична, химическая специфична (адсорбция происходит, только если возможна хим. реакция). Физ. адсорбция сопровождается образованием полислоев, химическая монослойна. Скорость физ велика, мгновенно. У хим меньше. Тувелич – Афиз уменьш – Ахим увелич. Количественные характеристики: 1)а - Абсолютная адсорбция-число моль и гр адсорбата приход.на ед.поверхности или массы адсорбента 2)г – Избыточная (Гиббсова) адсорбция - Избыток адсорбата в поверхностном слое по сравнению с его количеством в таком же объеме фазы, приходящейся на единицу поверхности, или массы адсорбента. Энергетические характеристики адсорбции: интегральная теплота – общее кол-во тепла,кт выделяется при адсорбции,отнесенное к массе адсорбента и равна убыли энтальпии Q=-дельтаН. Диф.теплота – q = убыли энальпии при изменении адсорбции на dA. 10.Адсорбция паров и газов на однородной поверхности. Изотерма адсорбции Ленгмюра. Основные положения теории Ленгмюра, которая описывает данный вид адсорбции: 1.Адсорбция мономолекулярна, 2.Адсорбция локализована, 3.Энергетическая однородность пов-ти(все центры адсорбции обладают равной энергией и адсорбированные молекулы не взаимодействуют друг с другом). Ур-е Ленгмюра Г=Г∞bc/1+bc. Отклонения от ур-я Ленгмюра при физ.адсорбции связаны с образ.полислоев, при хим. – с неоднородностью поверхн. Условия применимости: 1)линейность в координатах,2)не зависит от температуры, 3) с увеличением Т в экспоненциально падает. 11.ПАВ и ПИВ.Поверхн активность.Прав Дюкло-Траубе.Ур-ие Гиббса. ПИВ- р-ры электролитов, кот. в воде дисс-ют с обр-ем ионов, ионы гидротируются, т.к. Еион/н2о>Eн2о/н2о, поэтому ионы интенсивно втяг-ся вглубь р-ра и әσ/әС>0. ПАВ-орган молек с несимметр дефильным строением сост из неполярного углевод радикала и полярной группы. Молекула ПАВ из-за дефильного строения по-разному взаим.с мол-ми воды в рас-ре полярная часть легко гидратируется, а неполярный УВ-радикал слабо взаим с водой, но при этом мешает диполям воды взаим.друг с другом. Энергия сист увелич. Поэтому энергетич выгоднее удалить неполярные радикалы из объема с образ.ориентированного слоя,в кт полярная часть обращена к воде, а неполярная в воздух. Правило Д-Т:С увелич длины углеводородного радикала на одну группу СН2 поверх активность растет в гомологич ряду в 3-3,5 раза. 1 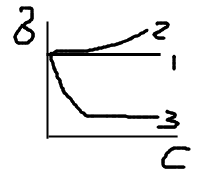 2. Изотермы адсорбции и поверхностного натяжения растворов ПАВ. Уравнение Шишковского. 2. Изотермы адсорбции и поверхностного натяжения растворов ПАВ. Уравнение Шишковского.Ур-е Шишковского σ=σ0-Вln(1+AC) 13. Представления о неоднородности поверхности. Изотермы Адсорбции Темкина и Фрейндлиха.Причина неоднородности могут иметь разную природу: а)биографическая неоднородность это первонач выход на поверхность раздела фаз различных кристаллографич. граней, ребер, узлов. б)индуцированная неоднородность – связана с процессом адсорбции из-за электростатич адсорбции из-за электростатич взаимодействия адсорбир частиц,изменения электронной структуры адсорбента из-за изменения концентрации свободных электронов.Для случая неоднородности уравнение изотермы Темкина 14. Представления о полимолекулярной адсорбции. Изотерма адсорбции БЭТ. Теория Поляни. Теория Поляни,основные положения: 1)адсорбция обусловлена чисто физическими силами взаимодействия, в адсорбционном пространстве действуют только дисперсионные силы, не зависящие от температуры. 2)вблизи пов-ти адсорбента образуется непрерывное силовое поле. 3)все адсорбированное вещество находится в жидком состоянии. 4)за меру интенсивности адсорбционного взаимодействия принят адсорбционный потенциал, т.е. работа по переносу одного моль газа с поверхности жидкого адсорбата в равновесную газовую фазу. Адсорбционный потенциал: ε= RTln(P0/P). Допущение, что практически все адсорбированное вещество находится в жидком состоянии позволяет заменить зависимость адсорбционного потенциала от расстояния на функцию объема жидкого адсорбата. Зависимость ξ как функция R или V называется потенциальной кривой адсорбции или характеристической кривой, поскольку вид кривой не зависит от температуры. Для количественного описания изотерм различных типов используется теория БЭТ: 1.адсорбция многослойна, 2. первый слой адсорбата образуется в результате действия вандерваальсовых сил между адсорбатом и адсорбентом, последующие – конденсации наиболее «холодных» молекул пара, обладающих кинетической энергией, меньшей QL, 3. возможно построение последующих слоев при незаконченном первом. Основные положения:1)поверхность энергетически однородна,2)адсорбция локализована,3)теплота адсорбции const в слоях и равна теплоте конденсации. |
