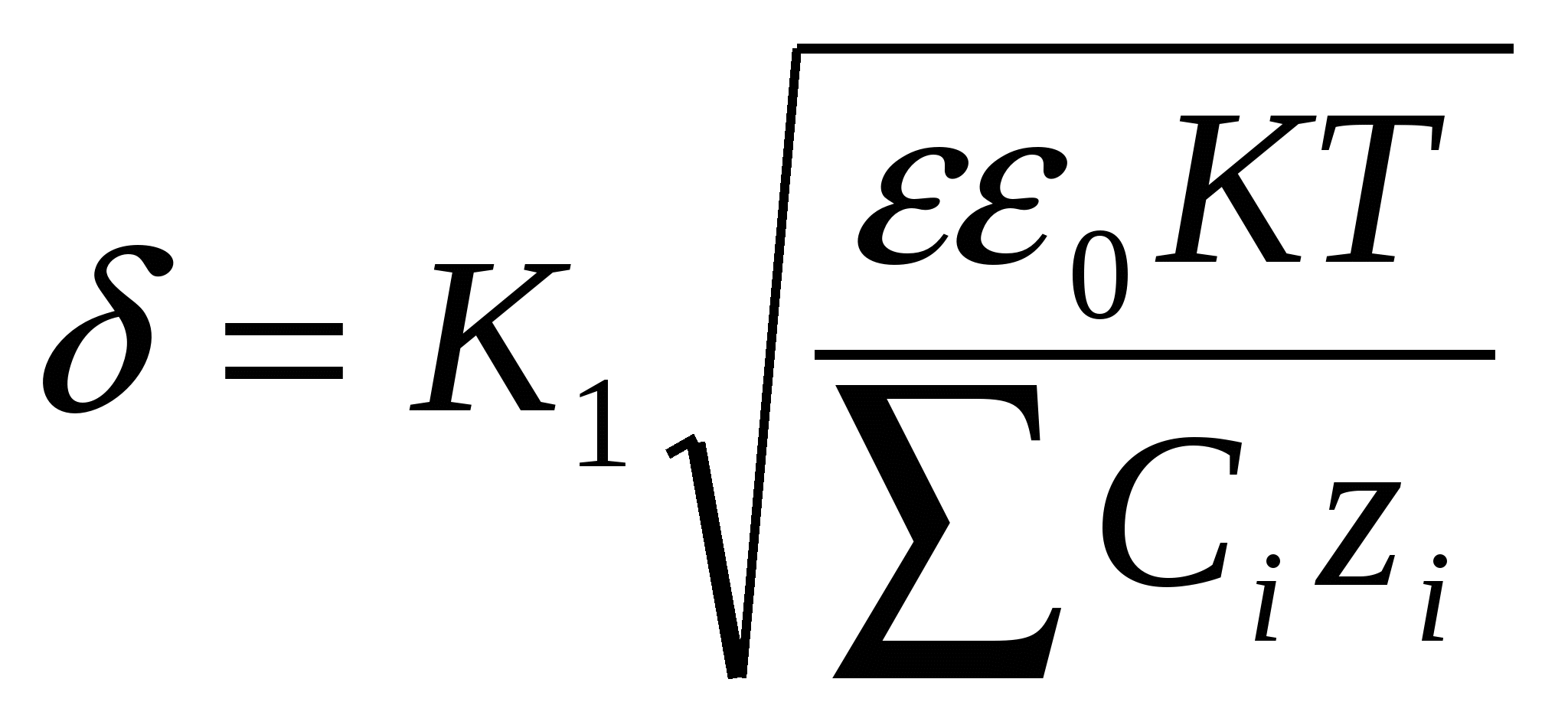29. Электрокинетические свойства дисперсных систем. Механизм образования ДЭС. Строение ДЭС. Примеры образования ДЭС. Электрокинетические явления. Прямые: - электрофорез(перемещение дисперсной фазы под действием внешн.электрич.поля) – электроосмос (перенос дисп.среды через неподвижн.капиляр –пористую перегородку под действием внешн.электрич поля). Обратные – потениальное оседание,потенциальное течение.Явл. основаны на ДЭС на границе ТВ. И жидк.фаз. Механизм образования. Возникает из-за пространственного разделения зарядов, которые могут возникать разными путями.1)поверхностная ионизация(переход ионов из одной фазы в другую)2)ионизация молекул в-ва ТВ. Фазы за счет диссоциации поверхностных функциональных групп 3)адсорбция ионов (молекул)а)не входящих в кристалл.решетку: органич ионн;с большой адсорбционной способностью б)избирательная ад-ция по правилу Панета-Фаенса 4)поляризация поверхности за счет внешн Эл.поля.Строение. На поверхности частиц дисперсной фазы врзникае заряд из-за ад-ции потенциал. – определ ионов, или поверхн.ионизации цепи.Величина и знак полного термодин потенциала φ0 на поверхности частицы зависит от колва и знака адс-ныхх ионов, этот потенциал притяг противоположно заряж ионы раствора, часть из них сразу примыкает к заряж.поверхности, частично ослабляя ее заряд -> адсорбционный слой.Его можно считать плоск. Конденсатором, в котором потенц смягчается линейно.Др.часть противоионов под действ теплового движения распространяется в глубь фазы,обазуя диф.слой.Ионы там распред.неравномерно-потенц.смягчается по экспоненте.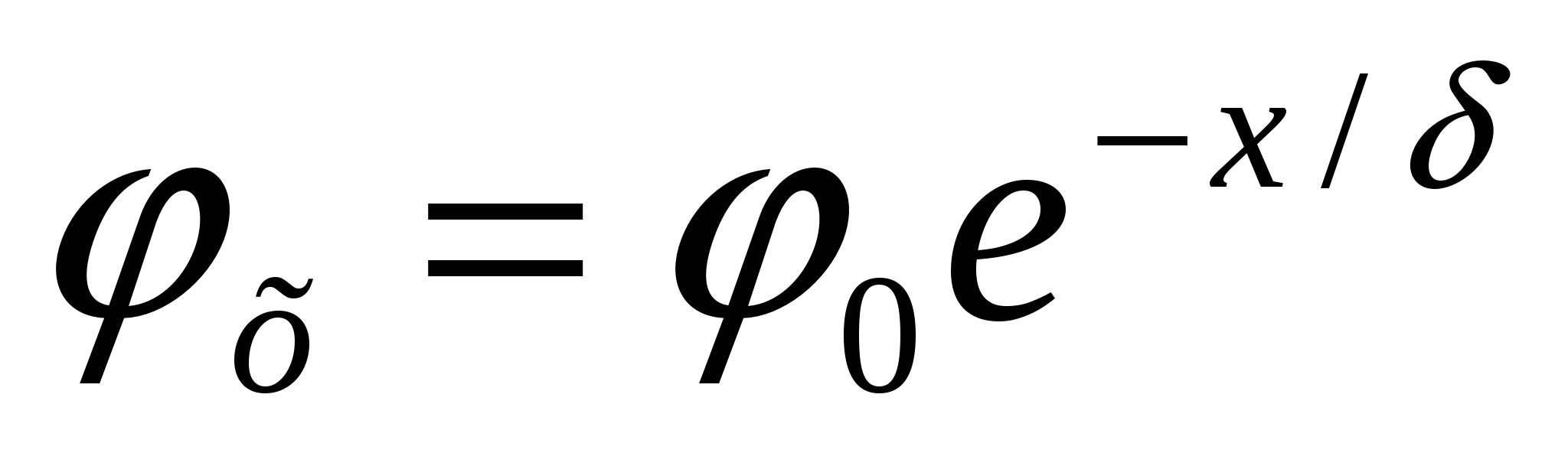 За толщ. Диф. Слоя принято считать расстояниена кот потенциал φ0 уменьшится в е раз. За толщ. Диф. Слоя принято считать расстояниена кот потенциал φ0 уменьшится в е раз.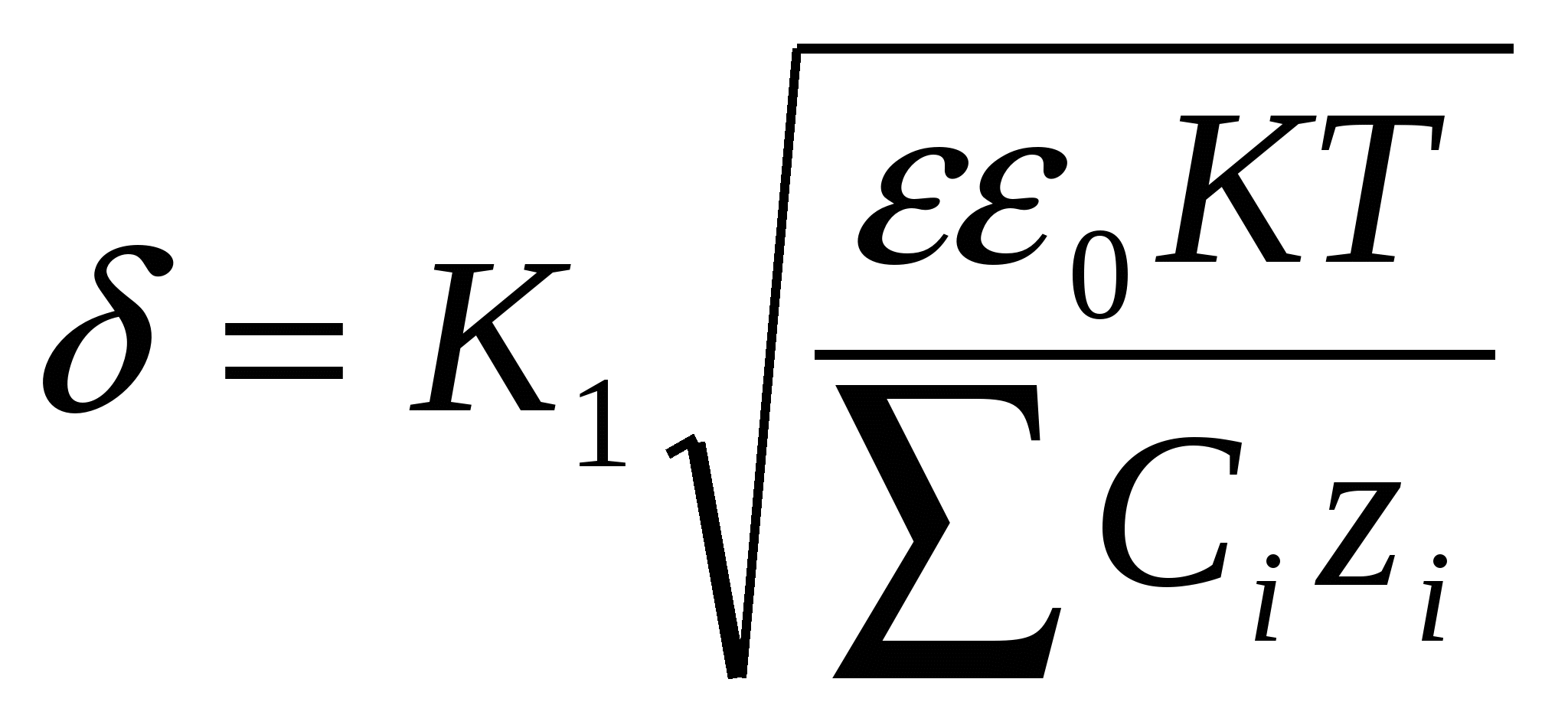
30Электрокинетич потенциал.Влияние разл факторов на вел электрокин потенциала.
Дзета потенциал-важнейшая характеристика ДЭС,котор опред скор перемещ частиц,для фазы и дисперсн среды и устойчивость золей.1Влияение индиф ионов-индиф ионы не влияют на 0.а)ионы ,сходн с противоионами ДЭС:С=(изоэлектрич состояние)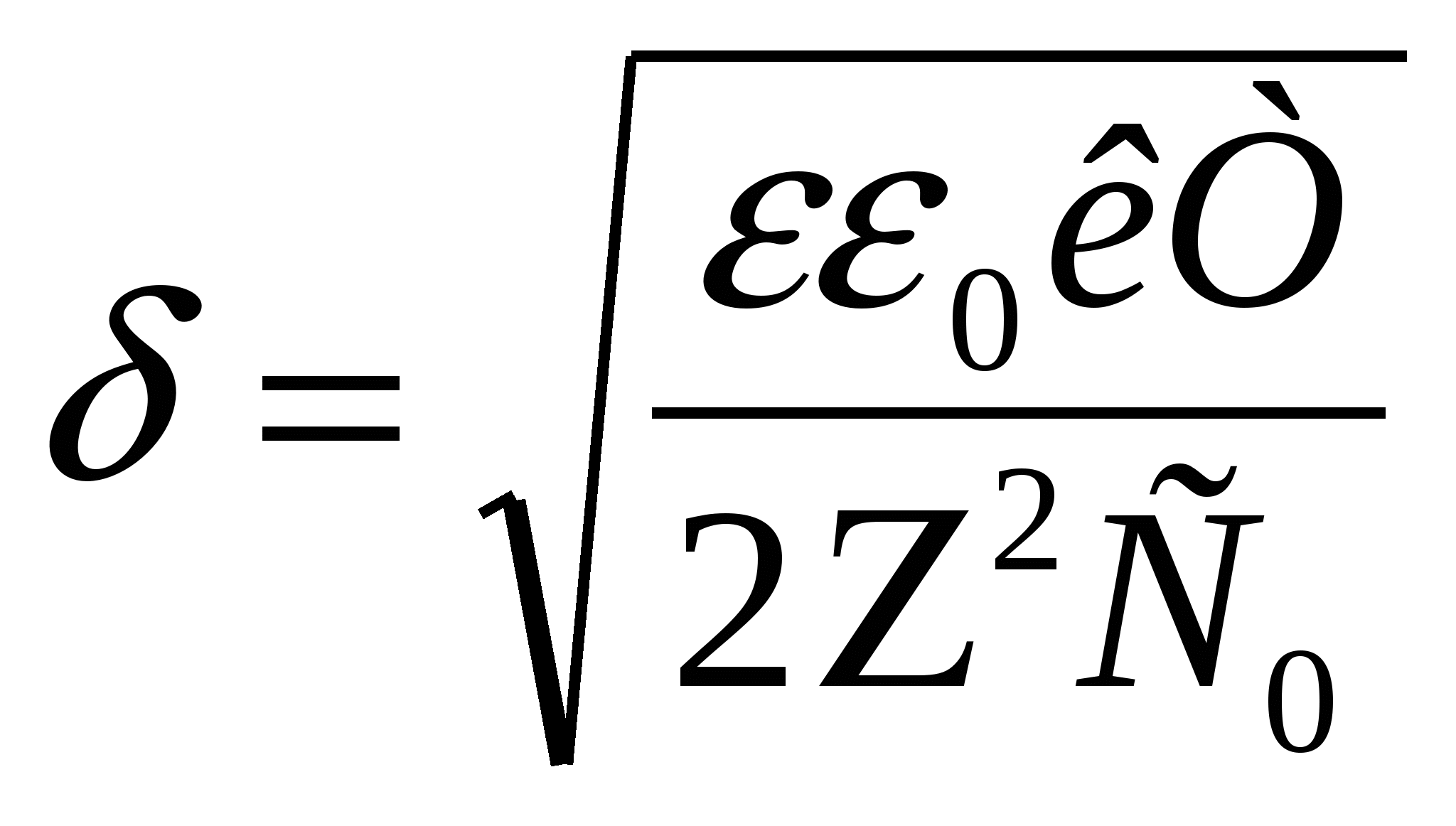 б)специф адсорбир противоионы,вызыв перезаряд плотной части.2)влиян неиндиф ионов:а)заряд ионов совпад со знаком 0.С увелич концентр ионов дзета потенц возрастает засчет увелич 0потенц,при дальн увелич конц ионов дзета-потенц уменьш из-за сжатия диффуз слоя до изоэлектр состояния.б)заряд ионов противополож 0.Добавл таких ионов ведет к полной перестройке ДЭС, уменьш до 0 и даже перезарядки поверх частицы.3)Влияние тем-ры:с увелич Т увелич(с увелич тем-ры часть противоинов перех из адсорб слоя в дифф.При дальнейшем процессы десорбции захват более глуб обл ДЭС,часть потенц опред ионов перех в р-р 0,.Т0.(нарисовать рисунки))). б)специф адсорбир противоионы,вызыв перезаряд плотной части.2)влиян неиндиф ионов:а)заряд ионов совпад со знаком 0.С увелич концентр ионов дзета потенц возрастает засчет увелич 0потенц,при дальн увелич конц ионов дзета-потенц уменьш из-за сжатия диффуз слоя до изоэлектр состояния.б)заряд ионов противополож 0.Добавл таких ионов ведет к полной перестройке ДЭС, уменьш до 0 и даже перезарядки поверх частицы.3)Влияние тем-ры:с увелич Т увелич(с увелич тем-ры часть противоинов перех из адсорб слоя в дифф.При дальнейшем процессы десорбции захват более глуб обл ДЭС,часть потенц опред ионов перех в р-р 0,.Т0.(нарисовать рисунки))).
31. Коагуляция дисперсных систем. Факторы, влияющие на электролитную коагуляцию дисперсных систем. Быстрая и медленная коагуляция.
Коаг-я – процесс слипания частиц с обр-ем крупных агрегатов. В р-те коаг.сист.теряет седиментац-ю устойч-ть,т.к. частицы стан-ся слишком круп-ми и не могут уч-ть в броун.дв-и. 2 стадии: 1. срытая к-я: частицы укрупняются, но не терю сед.уст-ти; 2. явная: ч.тер.сед.уст-ть. если плот-ть ч. Больше пл-ти дисперсионной среды, - осадок. Факторы: изм-е Т, действие электрич и электромагн.полей, д-е видимого света,облуч-е элем-ми част-ми, мех.возд-е, доб-е электролитов.
Быстрая к-я: Смолуховский: 1. рассм. Сист монодисп.; 2. все столкновения эффект-е; 3. рассм-ся только столкн-я первич.частиц; 4. кин-ка коаг.подобна кин-ке бимол-ной р-и –(dv/dt)=kv2, k – const скор-ти коаг. Для х-ки быс.к-и исп период коаг-и θ – время, через кот. концентр-я колл-х ч-ц ум-ся в 2 раза. vt=v0/2 t=θ θ=1/kv0 cогласно теор.быстр.коаг, k зав-т от коэфф.дифф: k=16πDr.
Медл.к-я: связ. с неполной эфф-ю столкн-я вследствие сущ-я энерг.барьера. Фукс. kкм=kкб*Р*е^(-ΔUк/kt), kкм – конст.скор медл.коаг; kкб- //-// быстрой к-и, Р – стерич.фактор, ΔUк – потенц.барьер к-и, k – пост.Больцмана=R/Na.
32.Коагуляция д.систем. нейтрализационная и концентрационная к. К.смесью электролитов. Защита коллоидных частиц.
Устойчивость д.системы характеризуется неизменностью во времени ее основных параметров: дисперсности и равновесного распределения дисперсной фазы в среде. Коагуляция – процесс слипания частиц, образования более крупных агрегатов с потерей седиментационной и фазовой устойчивости и последующим разделением фаз – разрушением дисперсной системы.
При Еб<=кТ наступает коагуляция. Все без исключения электролиты вызывают коагуляцию при увеличении концентрации их в растворе до некоторого критического значения Ск, называемого порогом коагуляции. Обратная величина называется коагулирующей способностью. Коагуляцию вызывают противоионы. Увеличение концентрации ведет к уменьшению толщины диффузного слоя и понижению ζ-потенциала. Коаг.способность ионов зависит от радиуса иона . чем больше радиус иона тем меньше он в гидротированном состоянии (гидротир.радиус), тем выше адсорбционная способность иона, а следовательно при меньших концентрациях укомплектовыва-
ется адсорбц.слой и вызывается коагуляция. В гомологич.рядах электролитов с органич.ионами коагул.способность увеличивается с удлинением радивала в соответствии с правилом Траубе, заключающее-
ся в том, что поверхностная активность увеличивается в 3-3,5 раза при удлинении углеводород. цепи на СН2. коагулирующая способность ионов зависит от их заряда – правило Шульца-Гарди.: γ=1/zn.
Если в результате введения электролита происходит адсорбция ионов на поверхности частиц и снижается потенциал поверхности до некоторой ритической величины, говрят о нейтрализационной коагулции. Адсорбционной способностью обладают ионы, способные достраивать кристаллическую решетку частиц, или поливалентные ионы, обладающие специфическим адсорбционным потенциалом. (т.е. неиндифферентные ионы : при увеличении С0 φ0 и ζ уменьшаются). Процесс концентрационной коагуляции заключается в том, что в присутствии электролита сжимается диффузная обкладка двойного электрического слоя, но потенциал поверхности частиц остается неизменным (т.е. индифферентные ионы ).
Коллоидная защита: повышение агрегативной устойчивости лиофобных золей, увеличение порога и неподчинение правилу Шульца-Гарди – белков, углеводов и ПАВ. Количественно выражается защитным числом МГ сухого вещества, которое защищает 10 мл золя при добавлении к нему 1 мл 10 % раствора NaCl. Механизм защиты: макромолекулы адсорбируются на поверхности частиц, создавая адсорбционные сольватные слои, которые повышают лиофильность коллоидных частиц, они обеспечивают большое расклинивающее давление при сближении двух частиц. Такой принцип: получение золей серебра, белки крови защищают капельки холестерина.
33. Классификация и общая характеристика ПАВ. Свойства коллоидных ПАВ. Числа ГЛБ. Применение ПАВ.
ПАВ – это вещества, добавление которых в гетерогенную систему уменьшает поверхностное натяжение на границе раздела фаз. При этом во всем интервале концентраций вплоть до насыщенного раствора ПАВ находятся в молекулярно-дисперсном состоянии, т.е. системы являются гомогенными. Отличие коллоидных ПАВ от обычных заключается только в длине углеводородного радикала.
Свойства ПАВ:1)Способность значительно снижать поверхностное натяжение на границе раздела фаз. 2)Самопроизвольное мицеллообразование. 3)Солюбилизация (растворение в мицеллах ПАВ нерастворимых в дисперсионной среде в-в) Классификация коллоидных ПАВ:1)По растворимости:
а) водорастворимые; б) жирорастворимые. 2) По взаимодействию с растворителем: а) истиннорастворимы; б) коллоидные ПАВ. 3)По степени диссоциации:− Ионногенные:1. Катионные ПАВ (поверхностно-активный катион):а) соли аминов; б) соли аммониевых оснований; в) алкилпиридиновые основания. Наиболее токсичные. 2. Анионные ПАВ: а) карбоновые кислоты и их соли. Используются как моющие средства, но не в кислых или солевых растворах. б) алкилсульфаты; в) алкиларилсульфонаты.
Соли сильных кислот могут быть и в кислых и в солевых растворах. 3. Амфолитные ПАВ. Содержат 2 функциональные группы. Одна имеет кислотный характер, другой основный характер. −Неионогенные. В растворах не распадаются на ионы. Обладают хорошим моющим действием. Свойства можно регулировать, изменяя длину цепочки, которая определяет гидрофильные свойства. Разлагается биологически.
ГЛБ – гидрофильно-липофильный баланс. Числа ГЛБ характеризуют соотношение между гидрофильными и гидрофобными свойствами: чем выше число ГЛБ, тем больше баланс сдвинут в сторону гидрофильных (полярных) свойств ПАВ. Групповые числа гидрофильных групп – положительны, гидрофобных групп – отрицательны. Применение ПАВ:1)ПАВ – основа синтетических моющих средств – детергентов. 2)ПАВ входят в состав смазочных жидкостей. 3)ПАВ – стабилизаторы микрогетерогенных систем: суспензий, эмульсий, пен, порошков. 4)Мицеллярный катализ, т.е. проведение различных реакций, в растворе ПАВ выше ККМ. 5)Высококонцентрированные растворы некоторых ПАВ формируют упорядоченные структуры – жидкие кристаллы, широко используемые в современной технике. 6)ПАВ применяются в пищевой промышленности.
34. Строение мицелл ПАВ. Механизм термодинамика мицеллообразования. Солюбилизация.
Мицеллообразование, самопроизвольная ассоциация молекул ПАВ в р-ре. В результате в системе ПАВ-р-ри-тель возникают м и ц е л л ы-ассоциаты характерного строения, состоящие из десятков дифильных молекул, имеющих длинноцепочечные гидрофобные радикалы и полярные гидрофильные группы. В т.наз. прямых мицеллах ядро образовано гидрофобными радикалами, а гидрофильные группы ориентированы наружу. Число молекул ПАВ, образующих мицеллу, наз. числом агрегации; по аналогии с мол. массой мицеллы характеризуются и т. наз. мицелляр-ной массой. Обычно числа агрегациит составляют 50-100, мицеллярные массы равны 103-105. Образующиеся при мицеллообразовании мицеллы полидисперсные и характеризуются распределением по размерам или числам агрегации.
Мицеллообразование характерно для разл. видов ПАВ-ионогенных (анион-и катионактивных), амфолитных и неионогенных и обладает рядом общих закономерностей, однако оно связано и с особенностями строения молекул ПАВ (размер неполярного радикала, природа полярной группы), так что правильнее говорить о мицеллообразовании данного класса ПАВ.
Мицеллообразование происходит в определенном для каждого ПАВ интервале т-р.
Одним из наиболее характерных свойств мицеллярных растворов ПАВ можно считать их способность растворять нерастворимые в воде вещества. Такое свойство по предложению Мак-Бена получило название «солюбилизация». Поскольку солюбилизация может проявляться не только в водных, но и в неводных растворах, то по определению Мак-Бена, данному им в 1948 г., солюбилизация – это растворение под действием ПАВ нерастворимых в данной жидкости веществ. Процесс солюбилизации можно рассматривать как распределение труднорастворимого вещества между истинным раствором и мицеллами ПАВ. Очевидно, что абсолютно нерастворимые вещества не будут и солюбилизироваться, так как их переход от частиц или капель в мицеллы должен происходить через молекулярный раствор.
35Влиян разл факторов на ККМ.Методы опред ККМ.Факторы:1)длина УВ-радикала(Для Н2ОR,тем ККМ.,для др RККМ),для соседних гомологов отнош ККМ
3,2.2)полярная группа.RTlnKKM=a-bn,а-пост,характ энерг растворения функц групп полярных частей. B-пост,характ энерг растворения,приход на 1 гр СН2.При равном R то в-во имеет большую ККМ,у котор лучше дмссоц его полярная гр.3)Влияние добавок электролитови пол орг в-во. В р-ра ионогенных ПАВ с эл-та вызывает ККМ.Повыш мицелообраз объясн сжатием дифф слоя под давл диссоц ионов ПАВи часть дегидротац ионов ПАВнизкомолек соед. С высомолек дисп соедККМ.4)влияние тем-ры:НПАВусил тепл движ и препятствует агрегации ККМ.Методы основ на регистр разного измен физ-хим св-вр-рав ПАВ в зав-ти от С.
36. Порошки, аэрозоли. Методы получения. Стабилизация и разрушение аэрозолей. Основные свойства этих дисперсных систем. Практическое значение порошков и аэрозолей. Аэрозоль- микрогетерогенная система, в которой частички твердого вещества или капельки жидкости взвешены в газе.Туман,дым,пыль,смог.Пролучают из грубодисперсных и и истинных растворов. Конденсационно:1-адиобатическое расширение газа 2-смешение газов и паров,имеющих разные температуры 3-охлаждение газовой смеси,содержащей пар 4 – врезультате хим.реакций сгорания топлива,фосфора, окисления металлов металлургических процессах.Диспергационные – приизмельчении,распылении твердых и жидких тел в газовой среде и при переходе порошковообразных веществ во взвешенное состояниепод действ.воздушн.потоков. Верхний предел размеров не определен, но не крупнее 100мкм.Частицы могут существовать сами по себе или объединяться в цепочки-флокулы.Имея малые размеры,обладают развитой поверхностью,на которой протекает адсорбция,горение и т п,обуславливает также гигроскопичность и взаимодействие с электрич зарядами.Рассеяние и поглощение света., малая концентрация частиц дисп фазы,малая вязкость и плотность дисп среды. Не возникае ДЭс,заряд частиц носит случ хар-тер,изменяется во времени по величине и знакук,очень мал,,агрегативная неустоичивость. Применяются в различн областях техники, в с\х,здравоохр.,быту
37.Суспензии. Методы получения. Агрегативная и седиментационная устойчивость разбавленных суспензий. Основные свойства суспензий. Способы разрушения разбавленных суспензий. Области применения. Суспензии-это дисп.системы, в к-рой дисп.фазой явл. частицы твердого в-ва размером >10-5см, дисп.средой – жидкость. Методы пол-ния: со стороны грубодисперст.систем – диспергацион., со стороны ист.р-ров – конденсационные. Седим.устойчивость- способность системы протоивостоять действию силы тяжести. Агрегат.устойчивость – способность сохранять неизменной во времени степень дисперстности. Свойства: 1) молекулярно-кинетич(диаметр 10-5-10-2, дифузионно-седиментац.устойчивость);2) оптич(длины волн видимой части спектра лежат в пределах от 4*10-5см(фиолетовый свет) до 7*10-5см(красный),3)электрокинемат(образование на пов-ти ДЭС и возник-ие электрокинемат.потенциала. Способы разрушения: 1)механич.(отделение в-ва дисп.фазы от дисп.среды, благодаря седимент.неустойчивости суспензий), 2)термич(изменеие тем-ры суспензий), 3)химич. (исп.химич.реагенты),4)электрич(исп.,когда частицы в суспензиях стабилизированы ионогенными в-вами).
38.Лиозоли. Методы получения. Особенности стабилизации и коагуляции лиозолей. Особые свойства. Практическое применение.Общие усорвия получения-нерастворимость или очень малая растворимость вещества дисперсно фазы в дисп среде и наличие стабилизаторов.Диспергацион.методы получения:механическое измельчение,в коллоидных мельницах,диспергирование ультрозвуком,электрическое диспергирование.Концентрационные методы – пресыщенность исходной системы,конденсация из паров,иметод замены растворителя,химическая концентрация.Под устойчивостью понимают постоянство во времени дисперстности и распределения частиц дисперсной фазы по объему дисперсной среды. Коагуляция – нарушения агрегативной устойчивости (слипание, выпадение в осадок). Факторы агрегативной устойчивости – а)электростатический,возникают электростатич силы ооталкиванием с ростом дзета потенц.а)кин. Структурно-механич фактор возникает при адсорбции пав б)адсорбционно-сольватный.поверхн частиц лиофильна б)кин. Гидродинамический возникает при росте вязкости скорость и кин энергия малы, в)энтропийный любая сисма стремится к стабилизации. Ионный фактор – перекрывание диффузных слоев. Бывает скрытая коагуляция и явная. Ее вызывает 1)любой электролит, если его концентрация привышает критическую.Порог коагуляции – этто мин колво электролита,вызывающая коагуляция 1л золя. 2)противоионы 3) коаг способность ионов зависит от радиуса иона и заряда. Св-ва:1)умень поверхн натяж на границе фаз 2)мицеллообразование 3)солюбилизация-раств в мицеллах ПАВ нерастворимых в дисперсной среде в-в
39. Пены. Методы получения. Устойчивость и разрушение пен. Практическое значение пен. Пены – грубодисп.высококонц.сист., в кот.дисперсной фазой явл.пузырьки газа, а дисперсионной средой – жидкость в виде тонких пленок. Методы пол-я: из грубодисп.сист, исп-я диспергационные методы (осн.на дроблении газа на пузырьки при подаче его в р-р пенообразователя. Обычно неб-е порции газа вводят в р-р и дробят их до мелких пузырьков. Легче всего этого добиться, продувая газ через трубку, опущенную в жид-ть) и из истинных р-ров с пом-ю конденсационных методов (будущая газовая фаза вначале присутствует в виде отдельных мол-л, из кот.затем образ-ся пузырьки). Устойчивость: пены - т/д-ки неустойчивы. Их обр-ние сопровождается увелич.свободной энергии. Избыт.энергия вызывает самопроизв-ые процессы,к-ые ведут к уменьшению дисперсности и разрушению её как дисп.системы. min значение свободн.энергии достигается при полном разделении пены на 2 сплошные фазы:ж-ть и газ. Пены обладают относит.устойчивостью: 1)кинемат.(седиментационная)-способность системы противостоять силе тяжести; 2)агрегативная-способность сохранять неизменными размеры частиц дисп.фазы и их индивидуальность. Способы разр-ния: 1)хим.пеногасители- треботания к ним: быстро гасить пену и долгое время препятствовать новому вспениванию р-ров;не изменять св-в в-в, не замедлять технолог.процесс;не изменять свои св-ва при хранении и нагревании в процессе пеногашения. 2)нехимич.способы: физич.(термич.,акустич.,электрич.) и механич. Примение: 1)пищев.продукты;2)пеносушка-сушка с предварительным вспениванием, обесп-ет получение сух.продуктов; 3)лекарства; 4)пенные аппараты для проведения процессов в г/ж системах.
40. Эмульсии. Методы получения. Особые свойства эмульсий. Особенности стабилизации и коалесенции эмульсий. Эмульсией называется дисперсная система, состоящая из двух жидких фаз. Условие образования дисперсной системы – практически полная или частичная нерастворимость вещества дисперсной фазы в среде. Поэтому вещества, образующие различные фазы, должны сильно различаться по своей полярности. Как правило, эмульсии являются грубодисперсными системами, поскольку маленькие капельки быстро исчезают вследствие изотермиической перегонки. Получают э. путем механического диспергирования, а также выдавливанием вещества дисперсной фазы через тонкие отверстия в дисперсионную среду под большим давлением. Также применяют конденсационные методы замены растворителя и взаимной конденсации паров. Так как электростатические силы малы(из-за диффузного распределения поверхностного заряда в обеих жидкостях, и лишь часть межфазного скачка потенциала приходится на дисперсионную среду, что сильно снижает высоту возникающего в ней потенциального барьера), то высока эффективность столкновений незащищенных капелек.
При столкновении капелек происходит легкое и полное их слипание, называемое коалесценцией. Поэтому разбавленные эмульсии могут существовать в метастабильном состоянии лишь в очень благоприятных условиях (малая концентрация электролита). Влияние электролитов соответствует правилу Шульце- Гарди, многозарядные ионы изменяют знак заряда частиц, в устойчивых эмульсиях наблюдается заметный электрофорез.
Длительное существование эмульсии обеспечивается в условиях стабилизации, связанной с образованием адсорбционно- сольватного или адгезионного слоя на межфазной границе. Вещества, стабилизирующие эмульсию, называются эмульгаторами. Стабилизирующее действие эмульгатора заключается не только в снижении σ, но и в образовании структурно механического барьера. (ГЛБ эмульгатора). Таким образом, стабилизация прямых эмульсий осуществляется гидрофильными веществами, обратных – гидрофобными.
К разрушению системы приводит чисто механическое воздействие. Методы вытеснения эмульгатора веществом, обладающим большей поверхностной активностью, но меньшей способностью к образованию структурированных слоев, а также увеличение концентрации электролита, дегидратация и т.д. |
 Скачать 295.5 Kb.
Скачать 295.5 Kb.