ИОННЫЙ ОБМЕН для учебного пособия. Ионный обмен
 Скачать 256.18 Kb. Скачать 256.18 Kb.
|
|
ИОННЫЙ ОБМЕН Значительное количество протекающих в природе и осуществляемых на практике процессов являются ионообменными. Ионный обмен лежит в основе миграции элементов в почвах и организме животных и растений. В промышленности его применяют для разделения и получения веществ, обессоливания воды, очистки сточных вод, концентрирования растворов и др. Обмен ионами может происходить как в гомогенном растворе, так и в гетерогенной системе. В данном случае под ионным обменом понимают гетерогенный процесс, посредством которого осуществляется обмен между ионами, находящимися в растворе и в твердой фазе, называемой ионитом или ионообменником. Ионит сорбирует ионы из раствора и взамен отдает в раствор ионы, входящие в его структуру. Ионный обмен - это процесс, в результате которого ионы, находящиеся в твердой фазе, обмениваются с ионами, находящимися в растворе. Нерастворимое твердое вещество может представлять собой какой-либо природный материал либо синтетическую смолу. Природные материалы, используемые для ионного обмена, включают цеолиты (комплексные алюмосиликаты натрия) и глауконитовый песок. Синтетические смолы представляют собой сложные полимерные вещества. Обычно они изготовляются в виде маленьких нерастворимых шариков. Способность ионитов к ионному обмену объясняется их специфической структурой. Ионит состоит из твердой нерастворимой в воде молекулярной сетки, к отдельным местам которой на поверхности и внутри ее массы присоединены химически активные функциональные группы атомов ионита. С электрохимической точки зрения каждая молекула является своеобразным твердым электролитом. В результате электролитической диссоциации ионита вокруг нерастворимого в воде ядра образуется ионная атмосфера, представляющая собой ограниченное пространство вокруг молекулы ионита, в котором находятся подвижные и способные к обмену ионы. Если эти подвижные ионы имеют положительный заряд, ионит называется катионитом, если отрицательный - анионитом 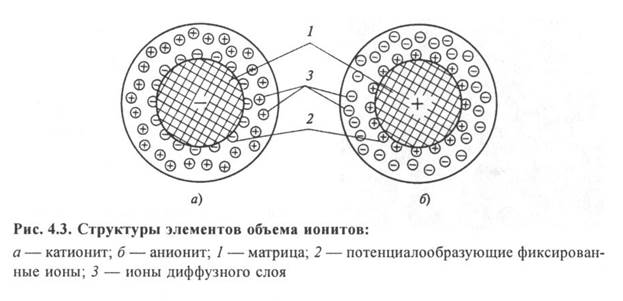 Реакции ионного обмена подчиняются правилам, действующим для реакции обычных электролитов:эквивалентность обмена ионов, обратимостьэтого процесса,селективность. Эквивалентностьзаключается в том, что обмен ионов между раствором и ионитом происходит в эквивалентных соотношениях так, чтобы соблюдался принцип электронейтральности раствора. Однако следует отметить, что суммарное количество ионов в растворе может меняться после ионирования вследствие протекания вторичных реакций (нейтрализации, образования малодиссоциируемых соединений). Если вода щелочная, то выделяющийся водород вступает во взаимодействие с ионами ОН–и образует малодиссоциируемое соединение – воду, при этом количество ионов в растворе уменьшается. Обратимостьпроцесса позволяет экономно использовать ионит в технологических схемах. Преимущественное направление реакции обмена определяется согласно закону действующих веществ. При истощении ионита можно, повысив в растворе концентрацию первоначальных обменных ионов, сдвинуть реакцию ионного обмена в направлении восстановления ионита в исходное состояние, т.е. произвести регенерацию ионита. Способность ионита к преимущественной сорбции одних видов ионов перед другими называетсяселективностью.Причиной, вызывающей селективность, является различие энергий притяжения различных ионов твердой фазой, обусловленной значениями радиусов сорбируемых ионов и их зарядов. При увеличении заряда иона (т.е. при повышении его валентности) увеличивается энергия притяжения его по закону Кулона противоположно заряженной твердой фазой. Поэтому с повышением валентности ионов селективность их сорбции ионитом возрастает. Соответственно: двухвалентные ионы сорбируются лучше чем одновалентные, а трехвалентные поглощаются лучше двухвалентных. Установлены ряды селективности для катионов и анионов, в которых каждый последующий ион сорбируется лучше, чем предыдущий. Например, для сильнокислотного катионита КУ-2 получен следующий ряд: H+<Na+<NH4+<Mg2+<Zn2+<Cu2+<Ca2+<Al3+… Для ионов высокоосновного анионита действует следующий ряд: ОН – Требования к качеству ионитов: Качество ионитов определяется рядом физико-химических и технологических свойств, важнейшими из которых являются: фракционный состав, насыпная плотность, химическая стойкость, механическая прочность, обменная емкость, кислотность или основность. Фракционным составом ионитов называется распределение частиц по размерам. Мелкозернистый катионит имеет более высокую емкость, чем крупнозернистый вследствие более развитой поверхности. С другой стороны, чем мельче зерна катионита, тем больше его гидравлическое сопротивление и расход электроэнергии на фильтрование воды, поэтому оптимальные размеры зерен ионитов 0,3¸2,0 мм. Коэффициент неоднородности засыпаемых в фильтр фракций не должен превышать kн = d80/d10 < 2, где d80 и d10 - диаметры сит, через которые могли бы пройти 80% или 10% общей навески. Во влажном состоянии иониты набухают и увеличивают свой объем, это следует учитывать при заполнении фильтров. Степень набухания зависит от материала ионита, ионной формы, рН и составляет 1,05¼2. Механическая прочность - способность зерен ионита противостоять истиранию и внешнему давлению. Этот показатель определяет допустимую высоту слоя ионита в фильтре. Механически прочные иониты должны иметь коэффицент истираемости (потерю массы) не более 0,5 % /год. Химическая стойкостьвыражается в способности противостоять растворяющему действию воды и регенерационных растворов. Под действием среды может происходить пептизация ионитов, т.е. переход их в коллоидный раствор. Химическая стойкость зависит от рН среды, природы и концентрации растворенных ионов и, что особенно важно, от температуры, с повышением которой пептизация усиливается. Допустимыми принято считать температуры воды около 30¼40°С, а при более высоких температурах (для обработки горячих конденсатов) необходимо использовать специальные термостойкие иониты. Обменная емкость является важнейшей характеристикой ионитов, характеризует число грамм-эквивалентов ионов, обмениваемых единицей объема ионита во влажном состоянии (г-экв/м3). Различают полную обменную емкость, емкость “до проскока” и рабочую. Полная обменная емкостьпоказывает количество ионов, которое может быть сорбировано ионитом при полной замене всех обменных ионов. Если фильтрование заканчивается в момент проскока поглощаемого иона, т.е. концентрация его в фильтрате близка к нулю, то обменная емкость ионита определяется как емкость “до проскока”. Однако на практике фильтрование часто прекращают в момент, когда концентрация поглощаемого иона в фильтрате составляет некоторое весьма малое значение. В этом случае обменная емкость определяется как рабочая, которая часто настолько мало отличается от емкости “до проскока”, что их можно принимать равными друг другу. Рабочая обменная емкость зависит от условий регенерации, обменного иона, природы поглощаемых ионов, значения рН, скорости фильтрования, геометрических характеристик слоя. |
