2. Конформация белковой молекулы (вторичная и третичная структуры). Типы внутримолекулярных связей в белках. Фибриллярные и глобулярные белки (примеры). Четвертичная структура белка. Примеры строения и функционирования олигомерных белков
 Скачать 66.86 Kb. Скачать 66.86 Kb.
|
|
2. Конформация белковой молекулы (вторичная и третичная структуры). Типы внутримолекулярных связей в белках. Фибриллярные и глобулярные белки (примеры). Четвертичная структура белка. Примеры строения и функционирования олигомерных белков. а) Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль. Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин, кератин, коллаген. Известно несколько типов вторичной структуры пептидных цепей, среди которых главными являются α-спираль и β-складчатый слой. α-Спираль - жёсткая структура, имеет вид стержня. Внутреннюю часть этого стержня создаёт туго закрученный пептидный остов, радикалы аминокислот направлены наружу. При этом СО-группа каждого аминокислотного остатка взаимодействует с NH-группой четвёртого от него остатка. На один виток спирали приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм (рисунок 2.1). 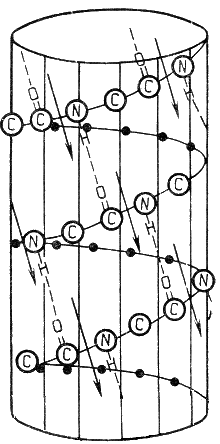 Рисунок 2.1. α-Спираль. Некоторые аминокислоты препятствуют свёртыванию цепи в α-спираль, и в месте их расположения непрерывность спирали нарушается. К этим аминокислотам относятся пролин (в нём атом азота входит в состав жёсткой кольцевой структуры и вращение вокруг связи N - Сα становится невозможным) , а также аминокислоты с заряженными радикалами, которые электростатически или механически препятствуют формированию α-спирали. Если в пределах одного витка (примерно 4 аминокислотных остатка) находятся два таких радикала (или более), они взаимодействуют и деформируют спираль. β-Складчатый слой отличается от α-спирали тем, что имеет плоскую, а не стержневидную форму. Образуется при помощи водородных связей в пределах одной или нескольких полипептидных цепей. Пептидные цепи могут быть расположены в одном направлении (параллельно) или в противоположных направлениях (антипараллельно) , напоминая меха аккордеона. Боковые радикалы находятся выше и ниже плоскости слоя.  Рисунок 2.2. β-Складчатый слой. Обратите внимание на то, что тип вторичной структуры белка определяется его первичной структурой. Например, в месте расположения остатка пролина (атомы пирролидинового кольца в пролине лежат в одной плоскости) пептидная цепь делает изгиб, и водородные связи между аминокислотами не образуются. Поэтому белки с высоким содержанием пролина (например, коллаген) не способны образовывать а-спираль. Радикалы аминокислот, несущие электрический заряд, также препятствуют спирализации. Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны. б) Виды связей: Гидрофобные связи возникают между неполярными гидрофобными радикалами и играют важную роль в образовании третичной структуры. Водородные связи образуются между полярными (гидрофильными) незаряженными группами радикалов, имеющими подвижный атом водорода и группами с электроотрицательным атомом. 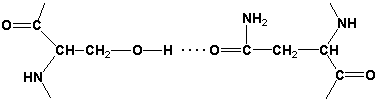 Ионные связи образуются между полярными (гидрофильными) ионогенными радикалами, имеющими противоположно заряженные группы. Дисульфидная связь – ковалентнаяобразуется двумя сульфгидрильными (тиольными) группами радикалов цистеина, находящимися в разных местах полипептидной цепи (инсулин, иммуноглобулины). По форме молекулы и особенностям формирования третичной структуры белки делят на глобулярные и фибриллярные. Глобулярные белки - имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную). К глобулярным белкам относятся: Альбумин - белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония. Глобулины - белки плазмы крови; по сравнению с альбумином оббладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония. Гистоны - входят в состав ядер клеток, где образуют комплекс с ДНК. Содержат много остатков аргинина и лизина. Фибриллярные белки - имеют нитевидную форму (фибриллы) , образуют волокна и пучки волокон. Между соседними полипептидными цепями имеется много поперечных ковалентных сшивок. Нерастворимы в воде. Переходу в раствор препятствуют неполярные радикалы аминокислот и сшивки между пептидными цепями. В организме выполняют главным образом структурную функцию, обеспечивают механическую прочность тканей. К фибриллярным белкам относятся: Коллаген - белок соединительной ткани. В его составе преобладают аминокислоты глицин, пролин, гидроксипролин. Эластин - более эластичен, чем коллаген, входит в состав стенок артерий, лёгочной ткани, в его составе преобладают аминокислоты глицин, аланин, валин. Кератин - белок эпидермиса и производных кожи, в его структуре преобладает аминокислота цистеин. г) Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами и двумя β-субъединицами. С каждой субъединицей связана молекула гема, содержащая железо. д) ОСОБЕННОСТИ СТРОЕНИЯ И ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ (гемоглобин) Многие белки содержат в своём составе только одну полипептидную цепь. Такие белки называют мономерами. К мономерным относят и белки, состоящие из нескольких цепей, но соединённых ковалентно, например дисульфидными связями (поэтому инсулин следует рассматривать как мономерный белок). В то же время существуют белки, состоящие из двух и более полипептидных цепей. После формирования трёхмерной структуры каждой полипептидной цепи они объединяются с помощью тех же слабых взаимодействий, которые участвовали в образовании третичной структуры: гидрофобных, ионных, водородных. Количество и взаиморасположение полипептидных цепей в пространстве называют "четвертичная структура белков". Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным. Олигомерные белки могут содержать разное количество протомеров. В состав олигомерных белков могут входить одинаковые или разные протомеры, например гомодимеры - содержащие 2 одинаковых протомера, гетеродимеры - 2 разных. Различные по структуре протомеры могут связывать разные лиганды. Взаимодействие одного протомера со специфическим лигандом вызывает конформационные изменения всего олигомерного белка и изменяет сродство других протомеров к лигандам (кооперативное изменение конформации протомеров). У олигомерных белков появляется новое по сравнению с одноцепочечными белками свойство — способность к аллостерической регуляции их функций. |
