смешение воздуха ТТД лаб. 2. теоретические основы процесса смешения газов в потоке
 Скачать 450.28 Kb. Скачать 450.28 Kb.
|
|
1. ЗАДАНИЕ 1. Из опыта на ЭВМ, моделирующего процесс смешения, определить температуру смеси двух изобарных потоков горячего и холодного воздуха, сравнить ее с температурой смеси, полученной расчетом процесса смешения без потерь теплоты в окружающую среду. 2. Определить потери теплоты воздуха в камере смешения в окружающую среду в расчете на 1 кг смеси. 3. Определить возрастание энтропии системы на 1 кг смеси за счет необратимости процесса смешения при отсутствии потерь теплоты в камере смешения в окружающую среду. 4. Определить возрастание энтропии системы на 1 кг смеси за счет необратимости теплообмена воздуха в камере смешения с внешней средой. 5. Определить полное увеличение энтропии системы на 1 кг смеси в процессе смешения двух изобарных потоков воздуха с учетом теплообмена воздуха в камере смешения с окружающей средой. 6. Изобразить процесс изобарного смешения двух потоков воздуха в Т,s- диаграмме, провести анализ изменения параметров воздуха и увеличения энтропии системы за счет необратимостей данного процесса. 2.ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА СМЕШЕНИЯ ГАЗОВ В ПОТОКЕ Смешение в потоке имеет место в случае объединения потоков различных веществ с различными параметрами в общий поток. Уравнение смешения двух потоков различных газов (жидкостей) при отсутствии их теплообмена с окружающей средой [1,2] имеет вид: 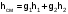 , (1) , (1)где hсм, h1, h2 – удельные энтальпии смеси газов и ее компонентов, g1, g2 – массовые доли компонентов смеси. При смешении потоков одного и того же газа с различными температурами, подчиняющегося уравнению состояния идеального газа Рv=RT, температура смеси может быть определена по формуле 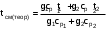 (2) (2) где g1, g2 – массовые доли смешивающихся потоков газа, представляют собой отношение расходов смешивающихся потоков к суммарному расходу смеси 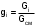 , (3) , (3)ср1, ср2 – массовые изобарные теплоемкости холодного и нагретого воздуха, определяются по уравнению изобарных теплоемкостей идеальных газов как постоянные величины (в работе воздух рассматривается как двухатомный идеальный газ с =28,96 кг/кмоль). Смешение является типичным необратимым процессом и, как всякий необратимый процесс, сопровождается увеличением энтропии системы. В экспериментальной установке смешиваются два потока воздуха при неизменном атмосферном давлении (рис.2.). При таком смешении, если не учитывать теплообмена с окружающей средой, возрастание энтропии системы sсм обусловлено необратимым теплообменом между нагретым и холодным воздухом. Величину sсм можно рассчитать по формуле: 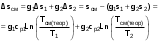 , (4) , (4)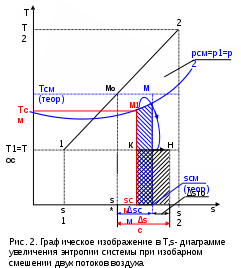 где s1, s2, sсм – энтропии потоков воздуха до смешения и после; s1, s2 – изменение энтропии каждого из смешивающихся потоков в изобарном процессе смешения. Графически sсм – возрастание энтропии системы на 1 кг смеси в диаграмме T,s выражается отрезком М-Мо (рис.2). Здесь кривая 12 соответствует изобаре смешивающихся потоков (все потоки имеют одинаковые давления как и в нашем опыте). Точка Мо, находящаяся на пересечении прямой 12 с изотермой Tсм(теор), имеет значение энтропии, соответствующее величине s*=g1s1+g2s2. Поскольку отрезки прямых Т2-Т1 и s2-s1 на осях координат по законам геометрии делятся координатами точки Мо в одинаковой пропорции. Пропорциональность этого деления определяется соотношением массовых долей потоков в соответствии с уравнением (2). Так как изобарные теплоемкости всех потоков одинаковы, получим расчетное выражение для температуры смеси в виде 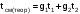 . .При наличии теплообмена с окружающей средой смесь охлаждается от Tсм(теор) до Tсм (процесс М-М1), отдавая теплоту окружающей среде с температурой Тос=Т1 (процесс К-Н) рис.2. Конечное состояние смеси соответствует точке М1 (рис.2). Увеличение энтропии системы за счет необратимости процесса теплообмена газа с окружающей средой sто определяется как сумма изменений энтропий газа sг и окружающей среды sос 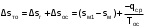 , (5) , (5)где 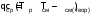 – теплота, отдаваемая 1 кг смеси газов окружающей среде – площадь под изобарой М - М1. – теплота, отдаваемая 1 кг смеси газов окружающей среде – площадь под изобарой М - М1.То же количество теплоты получает окружающая среда при Тос=const, но с обратным знаком (-qср) – площадь под изотермой окружающей среды К-Н. Расчетное выражение (5) увеличения энтропии системы за счет необратимости теплообмена газа с окружающей средой будет иметь вид 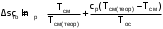 , (6) , (6)Полное возрастание энтропии системы sс в расчете на 1 кг смеси определяется как сумма возрастания энтропии за счет процесса смешения sсм и необратимого теплообмена sто 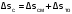 . (7) . (7)В диаграмме T,s (рис.2) полному увеличению энтропии системы соответствует сумма отрезков МоМ и МН по оси абсцисс. 3. Описание экспериментальной установки Установка, моделирующая процесс смешения, представлена на рис.2. 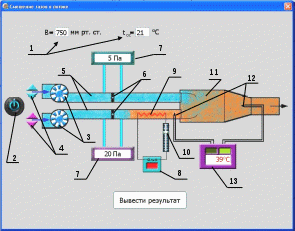  Рис. 2. Окно программы с экспериментальной установкой Обозначения элементов экспериментальной установки: 1 – окна установки параметров внешней среды; 2 – электрический включатель (тумблер) установки; 3 – вентиляторы, подающие воздух в установку; 4 – регуляторы вентиляторов расхода холодного и горячего воздуха; 5 – газопроводы холодного и горячего воздуха; 6 – расходомерные диафрагмы холодного и горячего воздуха; 7 – приборы, измеряющие перепад давлений на диафрагмах потоков холодного и горячего воздуха; 8 – включатель электрического нагревателя; 9 – электрический нагреватель; 10 – регулятор мощности электрического нагревателя; 11 – камера смешения; 12 – термопары, установленные в потоке горячего воздуха и на выходе из камеры смешения; 13 –прибор, показывающий температуры потоков горячего воздуха и на выходе из камеры смешения. Проведение эксперимента Эксперимент начинается активизацией в меню «Начать» кнопки «Работу» и установки на стенде (рис.6) необходимых параметров, для чего выполняются следующие действия: 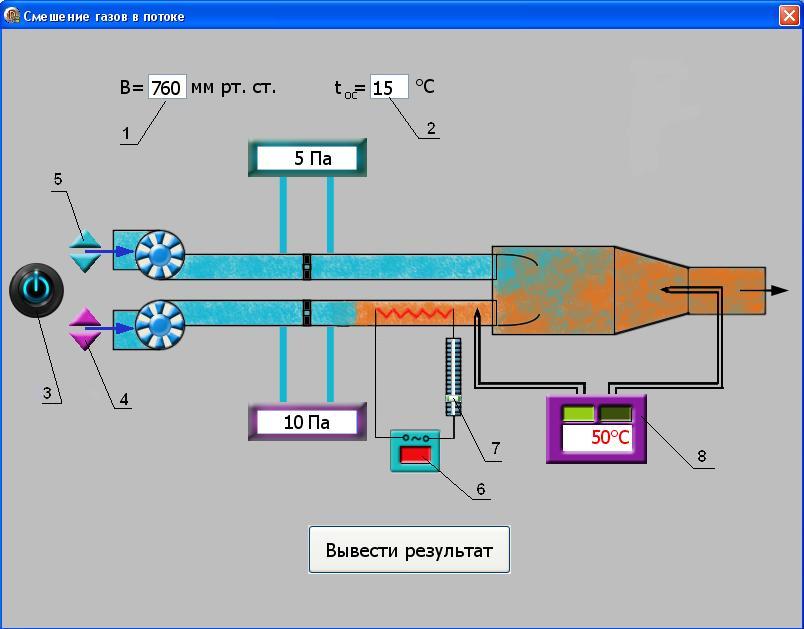 Рис.3. Схема порядка установки на стенде параметров в опыте в окнах 1 и 2 устанавливаются атмосферное давление В и температура tос, диапазон допустимых значений В=700770 мм рт.ст, tос=-2030 оС; кнопкой 3 включаются вентиляторы; кнопками 4 и 5 устанавливаются расходы газов смешиваемых потоков, ориентируясь на показания перепадов давлений на диафрагмах; кнопкой 6 включается нагреватель и реостатом 7 устанавливается температура горячего потока; кнопками переключения термометра 8 подключаются термопары горячего (левая) и в смешивающей камере (правая) потоков воздуха. После установки режима работы стенда нажимается кнопка «Вывести результаты» и появляется таблица опытных данных этого режима (рис.7). 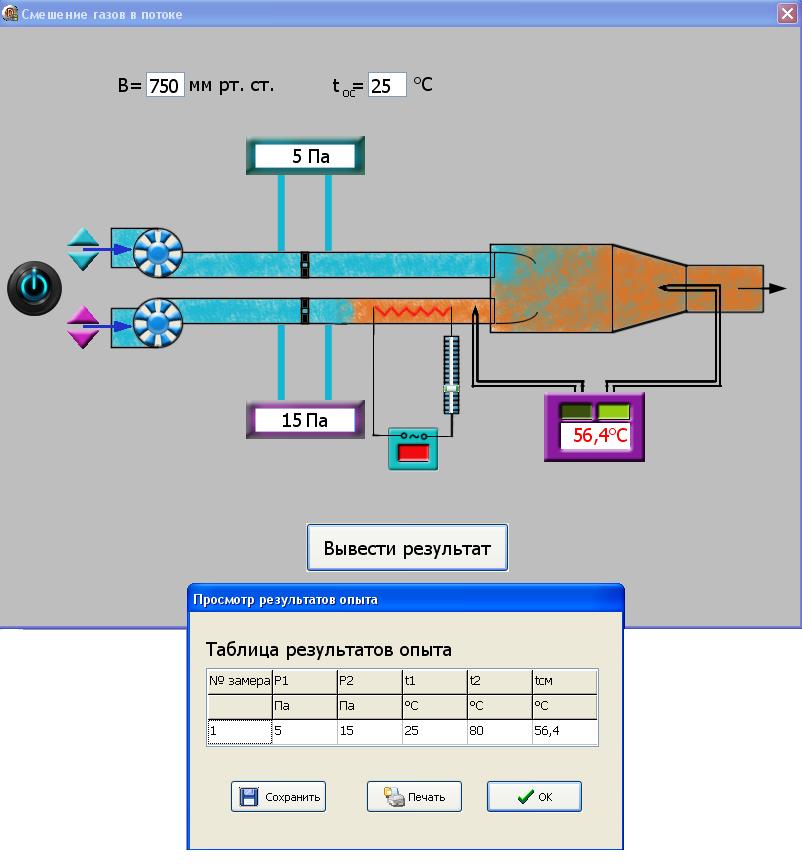 Рис.4. Результаты эксперимента В таблице результатов опыта приводятся следующие параметры: р1 и р2 – перепады давлений на расходомерных диафрагмах потоков смешиваемых газов в Па (в журнале наблюдений это р1=р1, р2=р2); t1 и t2 – температуры потоков смешиваемых газов в оС; tсм – температура газов на выходе из камеры смешения в оС. Данную таблицу можно сохранить в виде файла или распечатать, нажав соответствующие кнопки. Все величины, определенные в опыте, заносятся в журнал наблюдений, который подписывается студентом и преподавателем. 4. Журнал наблюдений Атмосферное давление В= 710 мм рт. ст.; температура внешней среды tос= -15oC;  р1 – перепад давлений на диафрагме потока холодного воздуха; р2 – перепад давлений на диафрагме потока горячего воздуха; t1=tос – температура потока холодного воздуха, равная температуре окружающей среды; t2 – температура потока горячего воздуха; tсм(опыт) – температура воздуха в камере смешения.
Примечание: обозначения, данные в журнале наблюдений и «Таблице результатов опыта», на ЭВМ находятся в следующем соответствии: перепад давлений газов на диафрагмах – р1 = р1, р2 = р2; температура смеси газов на выходе из камере смешения – tсм(опыт)=tсм. 5.ОБРАБОТКА РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТА Обработка результатов опыта ведется в соответствии с теоретическими положениями, изложенными в разделе 2, в следующем порядке: Пример(№ замера 1). 1. Массовый расход воздуха при использовании диафрагмы в качестве измерительного устройства определяется по формуле: 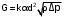 , (12) , (12)где k – постоянный коэффициент; – коэффициент расхода; d – диаметр диафрагмы; р – перепад давлений, создаваемый диафрагмой; – плотность воздуха. Так как диафрагмы, установленные для замера расхода воздуха, имеют одинаковые размеры, а воздух в местах их установки – одинаковые параметры, то отношение массовых расходов потоков воздуха будет соответствовать выражению 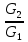 = = = = 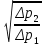 (13) (13)которое позволяет определить отношение расходов, а следовательно, и массовые доли смешивающихся потоков. Для этого необходимо решить систему двух уравнений: 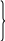 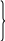 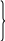 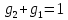 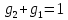 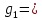 0,63412 0,63412 = = 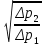 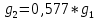 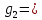 0, 36588 (14) 0, 36588 (14) 2. Теоретическая (для адиабатного процесса смешения) температура смеси определяется по формуле (7) 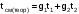 =0,63412∙(-20)+0,36588∙110=27,56 oC=300,71К =0,63412∙(-20)+0,36588∙110=27,56 oC=300,71Кгде 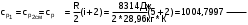 – удельная массовая изобарная теплоемкость воздуха (воздух рассматривается как идеальный двухатомный газ с =28,96 кг/кмоль). – удельная массовая изобарная теплоемкость воздуха (воздух рассматривается как идеальный двухатомный газ с =28,96 кг/кмоль).Полученное значение tсм(теор) сравнивается с опытным значением tсм(опыт). При соотношении температур tсм(теор) > tсм(опыт) делается вывод о наличии потерь теплоты в камере смешения в окружающую среду. 3. Возрастания энтропии системы на 1 кг смеси за счет необратимости смешения при отсутствии потерь теплоты в окружающую среду (для адиабатного смешения) ведется по уравнениям (4), (8), (9): 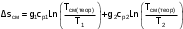 =0,63412*1004,8*Ln( =0,63412*1004,8*Ln(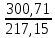 )+ 0,36588*1004,8*Ln( )+ 0,36588*1004,8*Ln(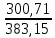 )= 188,97 Дж/(кгК) )= 188,97 Дж/(кгК)4. Потери теплоты на 1 кг смеси за счет теплообмена воздуха с окружающей средой в камере смешения рассчитываются по уравнению изобарного процесса 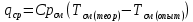 =1004,8*(300,71-299,35)=1366,53 Дж/кг . =1004,8*(300,71-299,35)=1366,53 Дж/кг .5. Возрастание энтропии системы на 1 кг смеси за счет необратимости теплообмена воздуха в камере смешения с внешней средой определяется по формуле (10) 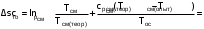 1004,8*Ln( 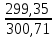 )+ 1004,8 ( )+ 1004,8 (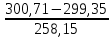 )= 2,4135 Дж/(кгК) . )= 2,4135 Дж/(кгК) .6. Полная необратимость опытного процесса смешения оценивается как сумма возрастания энтропии системы за счет адиабатного процесса смешения и процесса теплообмена газа с внешней средой: Δ 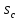 =Δ =Δ +Δ +Δ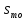 =188,97 +2,4135 =191,3835 Дж/(кгК). =188,97 +2,4135 =191,3835 Дж/(кгК).Все результаты расчета сводятся в таблицу. Таблица. Результаты расчета процесса смешения
7. Процесс смешения потоков воздуха в T,s- координатах. 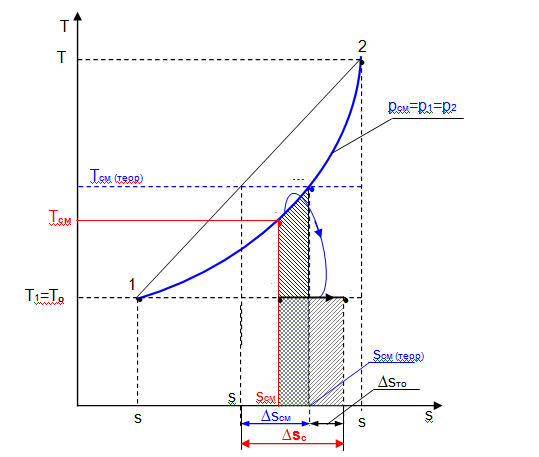 Анализ необратимости процесса Анализ необратимости процессаВ ходе анализа мы сравнили температуры смеси двух изобарных потоков горячего и холодного воздуха с температурой смеси, полученной расчетом процесса смешения без потерь теплоты в окружающую среду. 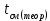 > > 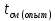 , (27,56>26,2) , (27,56>26,2)Определили потери теплоты воздуха в камере смешения в окружающую среду в расчете на 1 кг смеси и они составляют 1366,53 Дж. Определили возрастание энтропии системы на 1 кг смеси за счет необратимости процесса смешения при отсутствии потерь теплоты в камере смешения в окружающую среду, которое составило 188,97 Дж/(кг*К). Определили возрастание энтропии системы на 1 кг смеси за счет необратимости теплообмена воздуха в камере смешения с внешней средой на участке между измерительными термопарами и оно составляет 2,4135 Дж/(кг*К). Определили полное увеличение энтропии системы на 1 кг смеси в процессе смешения двух изобарных потоков воздуха с учетом теплообмена воздуха в камере смешения с окружающей средой. Оно равно 191,3835 Дж/(кг*К). Изобразили процесс изобарного смешения двух потоков воздуха в Т,s- диаграмме, и проведен анализ изменения параметров воздуха и увеличения энтропии системы за счет необратимостей данного процесса. Вывод: в ходе лабораторной работы мы 1. Из опыта на ЭВМ, моделирующего процесс смешения, определили температуру смеси двух изобарных потоков горячего и холодного воздуха, сравнили ее с температурой смеси, полученной расчетом процесса смешения без потерь теплоты в окружающую среду. 2. Определили потери теплоты воздуха в камере смешения в окружающую среду в расчете на 1 кг смеси. 3. Определили возрастание энтропии системы на 1 кг смеси за счет необратимости процесса смешения при отсутствии потерь теплоты в камере смешения в окружающую среду. 4. Определили возрастание энтропии системы на 1 кг смеси за счет необратимости теплообмена воздуха в камере смешения с внешней средой. 5. Определили полное увеличение энтропии системы на 1 кг смеси в процессе смешения двух изобарных потоков воздуха с учетом теплообмена воздуха в камере смешения с окружающей средой. 6. Изобразили процесс изобарного смешения двух потоков воздуха в Т,s- диаграмме, провели анализ изменения параметров воздуха и увеличения энтропии системы за счет необратимостей данного процесса. Какой процесс называется стационарным ? не менять свои характеристики со временем Укажите на схеме лабораторной установки узлы для замера расходов нагретого и холодного воздуха ? 6-диафрагмы, установленные для замера расхода воздуха, 3. Какие температуры измерялись в опыте и с помощью каких приборов ? t1 и t2 – температуры потоков смешиваемых газов в оС; tсм – температура газов на выходе из камеры смешения в оС 12 – термопары, установленные в потоке горячего воздуха и на выходе из камеры смешения; 13 –прибор, показывающий температуры потоков горячего возду- ха и на выходе из камеры смешения. 4. Как в лабораторной работе определить массовые доли компонентов смеси ? 5. Покажите в диаграмме Т,s- теплоту, отдаваемую 1 кг воздуха в камере смешения в окружающую среду, и напишите формулу для ее расчета ? 6. По какому уравнению рассчитывается в лабораторной работе увеличение энтропии 1 кг смеси воздуха за счет необратимости адиабатного процесса смешения двух потоков воздуха, поясните особенности этой формулы по отношению к смешению различных по физическим свойствам газов ? 7. По какому уравнению рассчитывается в лабораторной работе увеличение энтропии 1 кг смеси воздуха за счет теплообмена воздуха в камере смешения с окружающей средой ? 8. Покажите в диаграмме Т,s- возрастание энтропии системы для 1 кг смеси воздуха за счет необратимости адиабатного процесса смешения в лабораторной работе? 9. Покажите в диаграмме Т,s- возрастание энтропии системы для 1 кг смеси воздуха за счет необратимости процесса теплообмена воздуха с окружающей средой в лабораторной работе? 10. Покажите в диаграмме Т,s- возрастание энтропии системы для 1 кг смеси воздуха за счет необратимости процесса смешения и процесса теплообмена воздуха с окружающей средой в лабораторной работе? 11. Как в лабораторной работе определить теоретическую и опытную температуры смеси потоков воздуха ? 12. Почему в процессах с переменной температурой среднюю массовую изобарную теплоемкость воздуха можно рассчитывать по формулам для идеальных газов как постоянную величину ?__ |
