мат. 2.) Вычислить значение частных производных функции z(x,y) в заданной неявно, в данной точке М(x,y,z) с точностью до двух
 Скачать 0.52 Mb. Скачать 0.52 Mb.
|
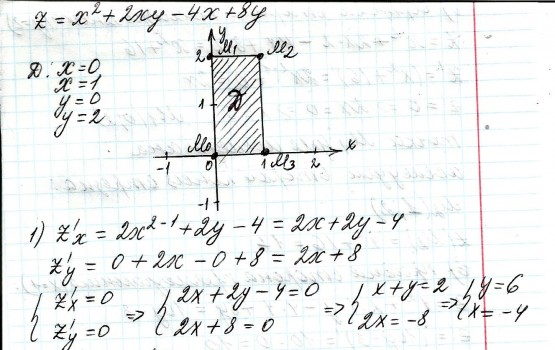  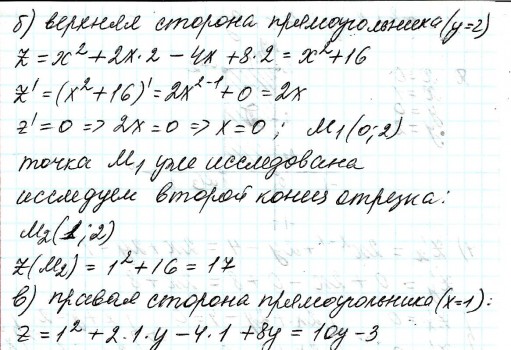 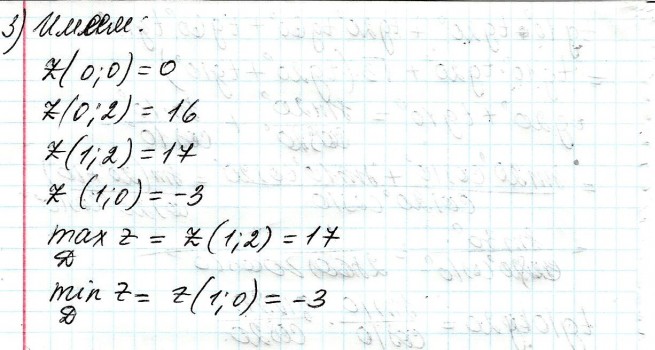 2.) Вычислить значение частных производных функции z(x,y) в заданной неявно, в данной точке М(x,y,z) с точностью до двухзнаков после запятой. 3x-2y+z=xz+5 точкаМ(2,1,-1) 1. Продифференцируем уравнение и выразим дифференциал dz через дифференциалы dx и dy: 3x - 2y + z = xz + 5; 3dx - 2dy + dz = xdz + zdx; 3dx - 2dy - zdx = xdz - dz; (3 - z)dx - 2dy = (x - 1)dz; (x - 1)dz = (3 - z)dx - 2dy; dz = (3 - z)/(x - 1) * dx - 2/(x - 1) * dy. 2. Найдем частные производные функции z(x, y) и вычислим их значения в заданной точке М(2; 1; -1): ∂z/∂x = (3 - z)/(x - 1); ∂z/∂x(2, 1) = (3 + 1)/(2 - 1) = 4/1 = 4; ∂z/∂y = -2/(x - 1); ∂z/∂y(2, 1) = -2/(2 - 1) = -2/1 = -2. Ответ: 4,00; -2,00. 3, найти наибольшее и наименьшее значение функции z=3x+y-xy в области D:y=x y=4 x=0  ХИМИЯ Входной контроль, 10 из 10 Вопрос 1 При растворении 6 моль алюминия в избытке соляной кислоты выделяется _____ молей газообразного водорода. Выберите один ответ: a. 3 b. 8 c. 9 d. 6 Вопрос 2 При взаимодействии оксида алюминия с оксидом серы (IV) образуется ... Выберите один ответ: a. сульфат алюминия b. сульфид алюминия c. тиосульфат алюминия d. сульфит алюминия Вопрос 3 Количество вещества для 56 г гидроксида натрия составляет _____ моль. Выберите один ответ: a. 0,6 b. 1,4 c. 1,6 d. 0,8 Вопрос 4 Среди приведенных веществ оксидом не является ... Выберите один ответ: a. CaO2 b. CO2 c. PbO2 d. NO2 Вопрос 5 Химический элемент, один из изотопов которого имеет массовое число атома 69 и содержит в ядре 40 нейтронов, - это ... Выберите один ответ: a. галлий b. медь c. кальций d. цирконий Вопрос 6 Аллотропными модификациями являются ... Выберите один ответ: a. оксид серы (IV) и оксид серы (VI) b. чугун и сталь c. протий и дейтерий d. алмаз и графит Вопрос 7 В каком варианте соединения указаны в порядке: оксид, кислота, соль? Выберите один ответ: a. Ca(OH)2, CaO, CaSO4 b. ZnO, ZnCl2, H2S c. SO3, H2SO4, NaHSO4 d. HNO3, N2O5, NH4OH Вопрос 8 В молекуле воды реализуются химические связи ... Выберите один ответ: a. ковалентные неполярные b. ковалентные полярные c. водородные d. ионные Вопрос 9 Дихромовая кислота, азотистая кислота и гидроксид свинца (II) образуются из оксидов, приведенных в ряду ... Выберите один ответ: a. Cr2O3, NO2, PbO b. CrO3, N2O3, PbO c. CrO3, N2O3, PbO2 d. CrO3, N2O5, PbO Вопрос 10 Степень окисления серы в соединении Na2S2O3 равна ... Выберите один ответ: a. +6 b. +2 c. +4 d. +3 Тест 1. Классификация неорганических соединений, 15 из 15 Вопрос 1 С чем может взаимодействовать Zn(OH)2? Выберите один или несколько ответов: a. CO2 b. CuCO3 c. НСl d. NaOH Вопрос 2 Гидроксид цинка, гипохлорит натрия, гидрокарбонат кальция - это соответственно ... Выберите один ответ: a. щелочь, кислая соль, основная соль b. основание, нормальная соль, основная соль c. основание, кислая соль, кислая соль d. амфотерное основание, нормальная соль, кислая соль Вопрос 3 При взаимодействии оксида кальция с оксидом углерода (IV) образуется ... Выберите один ответ: a. гидроксид кальция b. карбонат кальция c. ацетат кальция d. карбид кальция Вопрос 4 Кислые соли не может образовывать ни одна из кислот, приведенных в ряду ... Выберите один ответ: a. HNO3, HMnO4, H3PO4 b. HCl, H2S, HBr c. HClO4, НСN, CH3COOH d. HNO2, H2SO4, H2SiO3 Вопрос 5 Какая из приведенных кислот является более сильной? Выберите один ответ: a. H2CO3 b. H2SO3 c. H2SO4 d. H3PO4 Вопрос 6 Установите соответствие между формулой вещества и классом неорганических соединений. (CuOH)2CO3 • основная соль NaHSO3 • кислая соль NH4OH • основание NH4NO2 • нормальная (средняя) соль Вопрос 7 Среди перечисленных веществ: Li2O, BeO, B2O3, CO2, N2O, SiO2, Mn2O7, BaO, Cr2O3, CaO2 - число основных и кислотных оксидов соответственно равно ... Выберите один ответ: a. 2 и 4 b. 4 и 4 c. 3 и 3 d. 3 и 4 Вопрос 8 Хлорид калия может взаимодействовать с ... Выберите один или несколько ответов: a. AgNO3 b. CaSO4 c. Pb(CH3COO)2 d. Fe(OH)3 Вопрос 9 Какой из приведенных оксидов может проявлять кислотные свойства? Выберите один ответ: a. Na2O b. NiO c. Y2O3 d. Al2O3 Вопрос 10 Установите соответствие между названием вещества и классом неорганических соединений. гидроксид олова (II) • амфотерное основание оксид алюминия • амфотерный оксид гидроксид калия • щелочь гидрокарбонат кальция • кислая соль Вопрос 11 Какой из указанных гидроксидов проявляет более основные свойства? Выберите один ответ: a. Sr(OH)2 b. Ca(OH)2 c. Ba(OH)2 d. Mg(OH)2 Вопрос 12 Металл, который образует оксиды трех типов (основной, кислотный, амфотерный), - это ... Выберите один или несколько ответов: a. олово b. свинец c. медь d. хром Вопрос 13 Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать. H3PO4 • Ca, NaOH, BaCl2 Cr2O3 • KOH, HCl, Na2O Na2CO3 • H2SO4, BaCl2, HCl CO2 • NaOH, CaO, H2O Вопрос 14 Какая из приведенных пар веществ будет взаимодействовать между собой? Выберите один ответ: a. H2SO4 и H3PO4 b. BaO и CO2 c. Mg(OH)2 и KOH d. CaO и Na2O Вопрос 15 В порядке: соль, основание, оксид соединения указаны в варианте ... Выберите один ответ: a. FeO, FeCl2, H2SiO3 b. P2O5, H2CO3, NH4Cl c. Cu(HSO4)2, Cu(OH)2, CO2 d. PbCl2, H3PO4, KHCO3 Тест 2. Строение вещества, 12 из 12 Вопрос 1 На нейтрализацию 9,8 г ортофосфорной кислоты израсходовано 8 г NаОН. Формула образующейся соли имеет вид... a. NaH2PO4 b. Na3PO4 c. Na2PO4 d. Na2HPO4 Вопрос 2 При взаимодействии 10,64 г трехвалентного металла с кислотой выделяется 4,02 л водорода (н.у.). Определите металл. a. Y b. Fe c. Al d. P Вопрос 3 Молярная масса эквивалентов фосфорной кислоты в реакции: H3PO4 + 2NaOH = Na2HPO4 + H2O равна ... a. 32,7 b. 24,5 c. 49 d. 98 Вопрос 4 Установите соответствие эквивалента для гидроксида хрома в приведенных реакциях Cr(OH)3 + 2HNO3 = CrOH(NO3)2 + 2H2O 1/2 Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O 1/3 Cr(OH)3 + HNO3 = Cr(OH)2NO3 + H2O 1 Вопрос 5 При нормальных условиях эквивалентные объемы кислорода и водорода составляют ... a. 5,6 л О2 и 11,2 л Н2 b. 11,2 л О2 и 11,2 л Н2 c. 11,2 л О2 и 22,4 л Н2 d. 22,4 л О2 и 11,2 л Н2 Вопрос 6 Молярная масса эквивалента металла равна 12 г/моль. Молярная масса эквивалентов оксида этого металла составляет ... a. невозможно вычислить b. 18 г/моль c. 20 г/моль d. 24 г/моль Вопрос 7 Фосфор образует два различных по составу хлорида. В этих соединениях эквивалент сохраняется постоянным для элемента ... a. фосфора и хлора b. хлора c. ни для одного из этих элементов d. фосфора Вопрос 8 При сгорании неизвестного металла массой 5 г образуется 9,44 г оксида этого металла. Определите металл. a. Be b. F c. Mg d. Al Вопрос 9 На восстановление 1,80 г оксида неизвестного металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Определите металл. a. Al b. Ni c. N d. Sc Вопрос 10 На восстановление оксида неизвестного металла массой 7,2 г потребовалось 2,24 л водорода, измеренного при нормальных условиях. Определите металл. a. Si b. Zn c. Fe d. Cu Вопрос 11 Гидроксид натрия массой 8 г вступает в реакцию с 9,8 г ортофосфорной кислоты. Определите формулу образующейся соли. a. Na3PO4 b. Na2HPO4 c. NaH2PO4 d. Na3PO3 Вопрос 12 Определите молярную массу эквивалентов азота в молекуле аммиака NH3. a. 14 b. 5,7 c. 4,25 d. 8,5 Тест 3. Строение вещества, 20 из 20 Вопрос 1 Сколько свободных d-орбиталей у атома ванадия в свободном состоянии: a. 3 b. 1 c. 4 d. 2 Вопрос 2 Основное состояние атома меди отвечает электронной формуле 1s22s22p63s23p64s13d10. Значение какого квантового числа обозначено буквой d: a. магнитного b. орбитального c. главного d. спинового Вопрос 3 Установите соответствие между формулой молекулы и типом гибридизации валентных орбиталей центрального атома молекулы sp2-гибридизация sp-гибридизация sp3-гибридизация 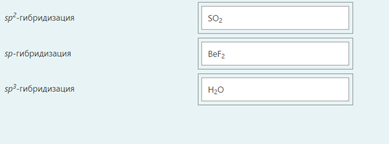 Вопрос 4 Число неспаренных электронов в основном состоянии атома элемента, образующего летучее водородное соединение состава ЭН, равно… a. 7 b. 3 c. 5 d. 1 Вопрос 5 Линейную форму имеет молекула:* a. OF2 b. H2O c. MgCl2 d. H2S Вопрос 6 На энергетической диаграмме распределения электронов в основном состоянии атома a. принцип Паули b. правило Клечковского c. правило Гунда d. принцип минимума энергии Вопрос 7 Наибольшее число неспаренных электронов имеет атом ... a. мышьяка b. хрома c. марганца d. железа Вопрос 8 Одинаковое число нейтронов содержится в ядрах атомов изотопов ... 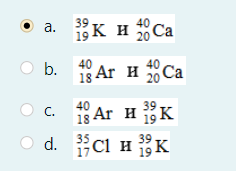 Вопрос 9 Формула вещества, в молекуле которого содержится одинаковое число σ- и π-связей, имеет вид… a. HClO4 b. HNO3 c. Н2O d. CO2 Вопрос 10 Какое строение внешнего энергетического уровня имеет возбужденный атом кремния: a. 3s23p24s2 b. 3s13p3 c. 3s23p2 d. 3s13p13d2 Вопрос 11 Какую максимальную валентность может проявлять железо в своих соединениях: a. 2 b. 4 c. 6 d. 3 Вопрос 12 Наибольшее число π-связей содержится в молекуле… a. P4 b. SiO2 c. N2 d. O2 Вопрос 13 Укажите тип химической связи в молекуле BaSO4: a. ионная b. ковалентная полярная c. водородная d. ковалентная неполярная Вопрос 14 Какая электронная формула отвечает иону Cl–: a. 1s22s22p63s23p5 b. 1s22s22p63s23p6 c. 1s22s22p63s23p64s2 d. 1s22s22p63s23p4 Вопрос 15 Установите соответствие между формулой вещества и типом кристаллической решетки, которой обладает вещество атомная SiO2 ионная CaCl2 молекулярная CO2 Вопрос 16 На энергетической диаграмме распределения электронов в основном состоянии атома 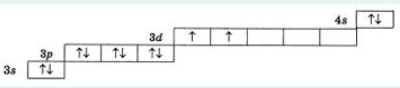 a.нарушено правило Гунда b. нарушений нет c. нарушен принцип минимума энергии d. нарушен принцип Паули Вопрос 17 Установите соответствие между формулой вещества и типом химической связи, реализуемом в молекуле вещества ковалентная неполярная ковалентная полярная ионная  Вопрос 18 Установите соответствие между формулой вещества и геометрической формой молекулы линейная молекула тетраэдрическая молекула плоская треугольная молекула 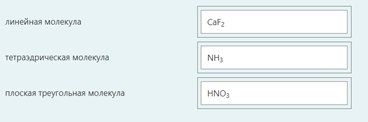 Вопрос 19 При перекрывании каких атомных орбиталей образуется молекула Сl2: a. s b. p c. f d. d Вопрос 20 Из числа предложенных электронных конфигураций укажите невозможную: a. 4p5 b. 2p1 c. 2s3 d. 3d2 Тест 4. Химическая термодинамика, 15 из 15 Вопрос 1 Для самопроизвольного протекания реакции необходимо условие: a. ΔG < 0 b. ΔH < 0 c. ΔH > 0 d. ΔG > 0 Вопрос 2 Энтальпия образования Na2SO4 соответствует тепловому эффекту реакции: a. 2Na + SO2 + O2 = Na2SO4 b. Na2O + S + 3/2O2 = Na2SO4 c. Na2O + SO3 = Na2SO4 d. 2Na + S +2O2 = Na2SO4 Вопрос 3 В какой из приведенных реакций выделится больше теплоты? a. S(т) +О2(г) → SO2(г), ΔH= -297 кДж b. NaI(т) → Na(т) + ½I2(г) , ΔH = 288 кДж c. Na(т) + ½Cl2(г) → NaCl(т), ΔH= -411 кДж d. N2(г) + O2(г) →2NO(г), ΔH= 180,0 кДж Вопрос 4 В процессе испарения вещества его энтропия a. остается неизменной b. возрастает c. уменьшается d. изменение не имеет закономерности Вопрос 5 . При образовании 2 моль газообразного оксида азота (I) из газообразных кислорода и азота поглощается 164 кДж теплоты. Каково изменение энтальпии при разложении 1 моль оксида азота (I) до газообразных азота и кислорода: a. ΔH = 82кДж b. ΔH = -164кДж c. ΔH = -82кДж d. ΔH = 164кДж Вопрос 6 Для экзотермических процессов справедливо неравенство: a. ΔS > 0 b. ΔS < 0 c. ΔH < 0 d. ΔH > 0 Вопрос 7 В процессе конденсации вещества его энтропия: a. остается неизменной b. изменение не имеет закономерности c. уменьшается d. возрастает Вопрос 8 В каком из приведенных процессов поглотится меньше теплоты? a. Na(т) + ½I2(т)→ NaI(т), ΔH = -288 кД b. ½Cl2(г) → Cl(г), ΔH = 121 кДж c. Na(т) → Na+(раст) + ē, ΔH = 502 кДж d. 2NO(г) + О2(г) → 2NO2(г), ΔH = -173 кДж Вопрос 9 В процессе превращения воды в лед ее энтропия: a. возрастает b. уменьшается c. остается неизменной d. изменение не имеет закономерности Вопрос 10 Для эндотермических процессов справедливо неравенство: a. ΔS > 0 b. ΔG > 0 c. ΔH > 0 d. ΔT > 0 Вопрос 11 При разложении 2 моль газообразного фтороводорода до газообразных водорода и фтора поглощается 536 кДж теплоты. Каково изменение энтальпии при образовании 1 моль фтороводорода из водорода и фтора? a. ΔH = 268 кДж b. ΔH = -536 кДж c. ΔH = 536 кДж d. ΔH = -268 кДж Вопрос 12 Дана реакция N2(г) + 3H2(г) = 2NH3(г), ΔН = -92,4 кДж, ΔS = -197,8 Дж/К. При температуре 500 0С ΔG равно (ответ привести с точностью до десятых) 60,5 Вопрос 13 Дана реакция MnO(т) + H2(г) = Mn(т) + H2O(г), ΔН = 143,3 кДж, ΔS = 28,7 Дж/К. При температуре 500 0С ΔG равно (ответ привести с точностью до десятых) 121,1 Вопрос 14 Для реакции PbO2(т) +CO(г) = PbO(т) + CO2(г), ΔН = -225,7 кДж, ΔS = 7,4 Дж/К при температуре 300 0С ΔG равно (ответ привести с точностью до целых) -230 Вопрос 15 Для реакции ZnO(т) +H2(г) = Zn(т) + H2O(г), ΔН = -108,8 кДж, ΔS = 56,2 Дж/К При температуре 500 К реакция идет в направлении. прямом Тест 5. Химическая кинетика, 15 из 15 Вопрос 1 При уменьшении концентрации вещества А в 3 раза в системе 3А + В → 2D скорость реакции ... a. уменьшится в 9 раз b. уменьшится в 27 раз c. увеличится в 27 раз d. увеличится в 9 раз Вопрос 2 При понижении температуры на 30°С в системе С + D → А + В (γ = 3) скорость реакции ... a. увеличится в 9 раз b. уменьшится в 27 раз c. уменьшится в 9 раз d. увеличится в 27 раз Вопрос 3 При изменении температуры от 20ºC до 70ºC скорость химической реакции увеличилась в 243 раза. Температурный коэффициент скорости данной реакции равен ... 3 Вопрос 4 При увеличении давления в 2 раза в системе 2PH3(г) + 4O2(г) = P2O5(т) + 3H2O(г) скорость реакции ... a. уменьшится в 16 раз b. увеличится в 64 раза c. увеличится в 16 раз d. уменьшится в 64 раза Вопрос 5 В системе 3H2(г) + N2(г) ↔ 2NH3(г), ∆Н = -92,4 кДж, при повышении давления равновесие смещается ... a. в сторону обратной реакции b. в сторону прямой реакции c. смещение не имеет закономерности d. не будет смещаться Вопрос 6 В системе N2(г) + О2(г) ↔ 2NО(г), ∆Н = 180 кДж, при понижении температуры равновесие смещается ... a. не будет смещаться b. в сторону обратной реакции c. смещение не имеет закономерности d. в сторону прямой реакции Вопрос 7 Уравнение реакции, в которой при увеличении давления равновесие смещается в сторону продуктов реакции, имеет вид ... a. 2SO2(г) + O2(г) ↔ 2SO3(г) b. FeO(т) + H2(г) ↔ Fe(т) + H2O(г) c. C(т) + CO2(г) ↔ 2CO(г) d. 2Cu(NO3)2(т) ↔ 2CuO(т) + 4NO2(г) + O2(г) Вопрос 8 Уравнение реакции, в которой при увеличении давления равновесие смещается в сторону исходных веществ, имеет вид ... a. Fe2O3(т) + 3H2(г) ↔ 2Fe(т) + 3H2O(г) b. FeO(т) + H2(г) ↔ Fe(т) + H2O(г) c. 2SO2(г) + O2(г) ↔ 2SO3(г) d. C(т) + CO2(г) ↔ 2CO(г) Вопрос 9 В системе Cl2(г) + H2(г) ↔ 2HCl(г), ∆Н = -184,6 кДж, при понижении давления равновесие смещается ... a. в сторону прямой реакции b. смещение не имеет закономерности c. не будет смещаться d. в сторону обратной реакции Вопрос 10 Уравнение реакции, в которой при изменении давления не происходит смещения равновесия, имеет вид ... a. N2(г) + 3H2(г) ↔ 2NH3(г) b. 2SO2(г) + O2(г) ↔ 2SO3(г) c. CO(г) + H2O(г) ↔ H2(г) + CO2(г) d. CaCO3(т) ↔ CaO(т) + CO2(г) Вопрос 11 При увеличении концентрации вещества С в 4 раза в системе 2С + А → 2В + D скорость реакции ... a. уменьшится в 16 раз b. уменьшится в 8 раз c. увеличится в 8 раз d. увеличится в 16 раз Вопрос 12 При увеличении температуры на 50°С в системе С + В → А (γ = 2) скорость реакции ... a. уменьшится в 10 раз b. уменьшится в 32 раза c. увеличится в 10 раз d. увеличится в 32 раза Вопрос 13 При уменьшении давления в 2 раза в системе 6CH4(г) = С6H6(ж) + 3Н2(г) скорость реакции ... a. уменьшится в 12 раз b. уменьшится в 64 раза c. увеличится в 64 раза d. увеличится в 12 раз Вопрос 14 Реакция разложения вещества АВ выражается уравнением 2АВ = А2 + В2. Константа скорости данной реакции равна 2. Начальная концентрация САВ = 3,2 моль/л. Определите скорость в начальный момент времени. Ответ приведите с точностью до сотых 20,48 Вопрос 15 Скорость реакции А + 2В = АВ2 при СА= 0,5 моль/л и СВ= 0,06 моль/л равна 0,18. Определите константу скорости реакции. Ответ приведите с точностью до целого числа. 100 Тест 6. Растворы, 20 из 20 Вопрос 1 В 250 мл водного раствора содержится 1 г гидроксида натрия. Молярная концентрация этого раствора ... моль/л a. 1 b. 0,1 c. 0,5 d. 0,05 Вопрос 2 Значение рН раствора, в котором концентрация гидроксид-ионов равна 10–5 моль/л, составляет ... 9 Вопрос 3 Среди приведенных соединений реакция возможна между парой веществ ... a. Mg(OH)2 и CO2 b. H2SiO3 и SO c. Ba(OH)2 и KOH d. Zn(OH)2 и NaOH Вопрос 4 Установите принадлежность приведенных веществ к сильным или слабым электролитам H2S слабый электролит Fe(OH)2 слабый электролит Ва(OH)2 сильный электролит ZnCl2 сильный электролит НNO3 сильный электролит Вопрос 5 Установите какая схема реакции соответствует сокращенному ионному уравнению Ba2+ + SO42- = BaSO4 BaCl2+Na2SO4= Cu2+ + 2OH– = Cu(OH) CuCl2+NaOH= Вопрос 6 Установите, какую реакцию среды будет иметь раствор приведенных солей NaNO2 щелочная среда MnSO4 кислая среда K2S щелочная среда Ba(NO3)2 нейтральная среда FeCl2 кислая среда NaCl нейтральная среда Вопрос 7 Установите, какой цвет будет приобретать лакмус в растворах приведенных солей AlCl3 красный Na2SiO3 синий CuCl2 красный Na2SO3 синий CrCl3 красный NH4NO3 красный Вопрос 8 Диссоциация соли NaH2PO4 по I ступени выражается уравнением: a. NaH2PO4 → Na+ + H+ + НРО42- b. NaH2PO4 → Na+ + 2H+ + РО43- c. NaH2PO4 → NaН23+ + РО43- d. NaH2PO4 → Na+ + H2РО4- Вопрос 9 В ионном виде правильно приведено уравнение: a. BaCl2 + 2K+ + CrO42- = Ba2+ + CrO42- + 2KCl b. BaCl2 + K2CrO4 = Ba2+ + CrO42- + 2K+ + 2Clˉ c. Ba2+ + 2Clˉ + 2K+ + CrO42- = BaCrO4 + 2K+ + 2Clˉ d. Ba2+ + 2Clˉ + 2K+ + CrO42-= Ba2+ + CrO42- + 2K+ + 2Clˉ Вопрос 10 При растворении в воде кислоту образует оксид ... a. NO b. Cl2O7 c. SiO2 d. N2O Вопрос 11 Установите соответствие между реагирующими веществами и результатом реакции растворы нитрата натрия и хлорида бария реакция не протекает растворы сульфида натрия и соляной кислоты образуется газообразное соединение растворы гидроксида натрия и серной кислоты образуется слабый электролит растворы нитрата серебра и йодида калия образуется нерастворимое соединение Вопрос 12 Значение рН раствора, в котором концентрация ионов водорода равна 10–9 моль/л, составляет ... 9 Вопрос 13 В 250 г водного раствора едкого натра содержится 25 г NaOH. Какова массовая доля (в процентах) NaOH в этом растворе? 10 Вопрос 14 Как называется соль КNO2? нитрит калия Вопрос 15 Как называется соль Сa(CH3COO)2? ацетат кальция Вопрос 16 Какая из приведенных концентраций [моль/л] соответствует щелочной среде? a.[H+]= 10–5 b. [H+] =10–7 c. [H+] = 10–11 d. [H+] = 10–4 Вопрос 17 Водный раствор каких из приведенных солей будет иметь нейтральную реакцию среды? a. NaCl b. NaNO2 c. CH3COONH4 d. Fe(NO3)2 e. CuCl2 Вопрос 18 Гидролиз каких из приведенных солей протекает по аниону? a. KCN b. Cu(NO3)2 c. K2SO3 d. NaNO3 e. CuSO4 Вопрос 19 Гидролиз каких из приведенных солей протекает по катиону? a. SrCl2 b. ВаCl2 c. NH4Cl d. CuCl2 e. LiCl Вопрос 20 Водный раствор каких из приведенных солей будет иметь щелочную реакцию среды? a. NaNO2 b. Pb(NO3)2 c. ВаCl2 d. K2SO3 e. NH4Cl Тест 7. Дисперсные системы, 15 из 15 Вопрос 1 Для золя сульфида свинца, полученного реакцией Pb(NO3)2(изб) + H2S → PbS + 2HNO3, наилучшим коагулирующим действием будет обладать раствор… a. AlCl3 b. NH4Cl c. K3PO4 d. ZnSO4 Вопрос 2 Метод разделения и очистки, основанный на проникновении молекул и ионов через мембрану, непроницаемую для коллоидных частиц, называется … a. электроосмосом b. диализом c. солюбилизацией d. электрофорезом Вопрос 3 При гидролизе хлорида железа (III) образуется золь его гидроксида, потенциалопределяющим ионом в котором является ион… a. H+ b. Fe3+ c. ОH- d. Cl- Вопрос 4 При добавлении поверхностно-активного вещества в раствор значение поверхностного натяжения раствора … a. увеличивается b. уменьшается c. стремится к максимуму d. не изменяется Вопрос 5 Для золя хлорида серебра, полученного реакцией AgNO3 + NaCl(изб) → AgCl + NaNO3, наилучшим коагулирующим действием будет обладать раствор … a. MgSO4 b. KCl c. K3PO4 d. AlCl3 Вопрос 6 Образование коллоидного раствора возможно в реакциях… a. AgNO3 + KI = AgI + KNO3 b. BaCl2 + H2SO4 = BaSO4 + 2HCl c. 2KOH + H2SO4 = 2K2SO4 + 2H2O d. MgO + 2HCl = MgCl2 + H2O Вопрос 7 Из приведенного перечня к дисперсным системам относятся ... a. молоко b. нефть c. соленая вода d. чай Вопрос 8 Коллоидная частица, образующаяся при взаимодействии избытка разбавленного раствора силиката калия с раствором серной кислоты, в постоянном электрическом поле будет … a. двигаться к катоду b. совершать колебательные движения c. двигаться к аноду d. оставаться неподвижной Вопрос 9 Противоионы, не входящие в состав коллоидной частицы (гранулы), образуют слой, который называется … a. противоионным b. адсорбционным c. диффузионным d. потенциалопределяющим Вопрос 10 Для очистки коллоидных растворов от ионных примесей применяют метод… a. электрофореза b. электрокоагуляции c. электродиализа d. электроосмоса Вопрос 11 Формула вещества, которое является ядром мицеллы, образующейся при взаимодействии разбавленного раствора хлорида железа (III) с избытком раствора нитрата серебра, имеет вид … a. AgCl b. AgOH c. Fe(OH)Cl2 d. Fe(NO3)3 Вопрос 12 Коллоидная частица, образующаяся при взаимодействии избытка разбавленного раствора нитрата кадмия с раствором сероводорода, в постоянном электрическом поле будет … a. оставаться неподвижной b. двигаться к катоду c. совершать колебательные движения d. двигаться к аноду Вопрос 13 При прохождении светового потока через коллоидный раствор наблюдается образование светящегося конуса, которое возникает в результате … a. адсорбции светового потока b. дифракционного рассеяния света c. интерференции светового потока d. фотоэффекта Вопрос 14 Для золя сульфата бария, полученного по реакции BaCl2 (изб.) + K2SO4 → BaSO4 + 2KCl наименьшим порогом коагуляции обладает… a. KCl b. K2SO4 c. AlCl3 d. K3PO4 Вопрос 15 Метод получения дисперсной системы, основанный на дроблении крупных частиц на более мелкие, называется … a. коагуляцией b. диспергированием c. конденсацией d. диализом Тест 8. Электрохимические системы, 22 из 22 Вопрос 1 Схема процесса, в котором происходит окисление азота, имеет вид… a. NO3– → NO b. NH4+ → N2O c. NO2 → NO2– d. N–3 → NH3 Вопрос 2 В системе, состоящей из стального корпуса корабля, защищенного магниевым протектором, в морской воде самопроизвольно протекает… a. окисление магния b. восстановление железа c. восстановление магния d. окисление железа Вопрос 3 Коэффициент перед формулой окислителя в уравнении окислительно-восстановительной реакции NaClO3 + HCl → NaCl + Cl2 + H2O равен … a. 6 b. 0 c. 3 d. 1 e. 2 Вопрос 4 При нарушении оловянного покрытия на железном изделии в кислой среде на аноде будет протекать реакция, уравнение которой имеет вид … a. Fe2+ + 2ē = Fe0 b. Sn0 – 2ē = Sn2+ c. 2H+ + 2ē = H20 d. Fe0 – 2ē = Fe2+ Вопрос 5 Масса серебра, выделившегося на катоде при пропускании тока силой 2,5 А в течение 30 мин через раствор нитрата серебра составляет ____ г (выход по току 100%) Ответ приведите с точностью до целого числа 5 Вопрос 6 Объем хлора, который образуется на инертном аноде при пропускании тока силой 10,8 А в течение 4 ч через раствор хлорида натрия, составляет ____ л (н. у.) (Выход по току 100%; F = 96500 Кл/моль). Ответ приведите с точностью до целого числа 18 Вопрос 7 Из перечисленных реакций к окислительно-восстановительным относятся реакции, схемы которых имеют вид … a. Cu2O + H2SO4 (конц.) → CuSO4 + SO2 + H2O b. CaCO3 + HCl → CaCl2 + CO2 + H2O c. CuSO4 + KI → CuI + I2 + K2SO4 d. Ca + H2O → Ca(OH)2 + H2 e. (CuOH)2CO3 CuO + CO2 + H2O f. CaS + HCl → CaCl2 + H2S Вопрос 8 При нарушении никелевого покрытия на медном изделии в кислой среде на аноде будет протекать реакция, уравнение которой имеет вид … a. Ni0 – 2ē = Ni2+ b. Ni2+ + 2ē = Ni0 c. 2H+ + 2ē = H20 d. Cu0 – 2ē = Cu2+ Вопрос 9 При пропускании сероводорода в раствор, содержащий ионы свинца, значение ЭДС гальванического элемента Mg0 | Mg2+ || Pb2+ | Pb0 … a. уменьшится b. увеличится c. станет равным нулю d. не изменится Вопрос 10 Масса никеля, выделившегося на катоде при пропускании тока силой 13,7 А в течение 120 мин через раствор сульфата никеля (II) с выходом по току 80%, составляет ____ г (Ar(Ni) = 58,7; F = 96500 Кл/моль). Ответ приведите с точностью до целого числа 24 Вопрос 11 Схема процесса, в котором происходит восстановление серы, имеет вид… a. H2S → S b. S2O32– → SO42– c. SO32– → S d. SO32– → SO42– Вопрос 12 Молярная масса вещества-окислителя в окислительно-восстановительной реакции, схема которой имеет вид KBr + KBrO3 + H2SO4 → Br2 + K2SO4 + H2O, равна ____ г/моль. a. 167 b. 98 c. 119 d. 160 Вопрос 13 При добавлении щелочи в раствор, содержащий ионы серебра Zn0|Zn2+||Ag+|Ag0, значение ЭДС гальванического элемента … a. уменьшится b. увеличится c. не изменится d. станет равным нулю Вопрос 14 Значение ЭДС гальванического элемента, состоящего из медного и марганцевого электродов при стандартных условиях, равно В (E0Mn2+/Mn = -1,18 B, E0Cu2+/Cu = 0,34 B). 1,52 Вопрос 15 При работе гальванического элемента, состоящего из кадмиевого и никелевого электродов, погруженных в 0,02 М растворы их сульфатов, на катоде протекает реакция, уравнение которой имеет вид … a. Ni2+ + 2ē = Ni0 b. Ni0 – 2ē = Ni2+ c. Cd2+ + 2ē = Cd0 d. Cd0 – 2ē = Cd2+ Вопрос 16 Формула вещества, которое способно проявлять только восстановительные свойства, имеет вид … a. NaIO3 b. I2 c. NaIO4 d. NaI Вопрос 17 Коэффициент перед формулой восстановителя в уравнении окислительно-восстановительной реакции K2Cr2O7 + H2O2 + H2SO4 → O2 + Cr2(SO4)3 + K2SO4 + H2O равен … a. 3 b. 1 c. 6 d. 5 Вопрос 18 Коэффициент перед формулой восстановителя в уравнении окислительно-восстановительной реакции KMnO4 + FeSO4 + H2SO4 → MnSO4 + Fe2(SO4)3 + K2SO4 + H2O равен … a. 5 b. 8 c. 10 d. 2 Вопрос 19 Значение ЭДС гальванического элемента, состоящего из ртутного и кадмиевого электродов, погруженных в 0,2 М растворы их нитратов, равно ___ В (E0Hg2+/Hg = 0,79 B, E0Cd2+/Cd = -0,40 B). 1,19 Вопрос 20 Сила тока, которую необходимо поддерживать для получения 16,2 г серебра путем электролиза раствора нитрата серебра за 30 мин, составляет ____ А (выход по току 100%, F = 96500 Кл/моль). Ответ приведите с точностью до целого числа 8 Вопрос 21 При электролизе водного раствора нитрата серебра с инертными электродами на катоде происходит выделение вещества, формула которого имеет вид… a. O2 b. Ag c. HNO3 d. H2O Вопрос 22 Сумма коэффициентов в общем уравнении электролиза водного раствора йодида калия с инертными электродами равна … 8 Тест 9. Неорганическая химия, 25,75 из 27 Вопрос 1 Литий при соответствующих условиях вступает в реакцию с каждым из двух веществ a. азотом и фосфором b. кислородом и алюминием c. оксидом углерода (II) и оксидом меди (I) d. серой и хромом Впрос 2 Установите соответствие между реагирующими веществами и продуктами реакций P + H2SO4(конц.) → P + H2→ P + Cl2(изб.) → 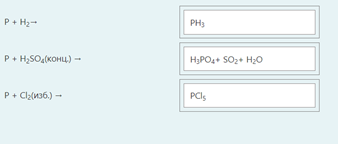 Вопрос 3 С углеродом при определённых условиях может реагировать a. оксид железа (III) b. гидроксид натрия c. соляная кислота d. медь Вопрос 4 Установите соответствие между реагирующими веществами и продуктами реакций Mg+ HNO3(разб)→ Mg + H2 → Mg + H2SO4(разб.) → 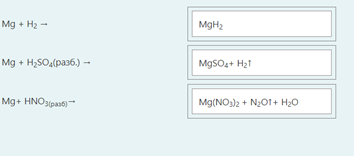 Вопрос 5 Установите соответствие между веществом(-ами) и продуктом(-ами), который(-е) образуется(-ются) в результате реакции с участием этих веществ Ca(HCO3)2 + Ca(OH)2 → Ca(HCO3)2 t→ CaCO3 + CO2 → Ca(HCO3)2 + H2SO4 → 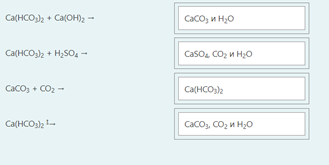 Вопрос 6 В схеме превращений Fe X→FeCl3 Y→Fe(NO3)3 веществами Х и Y являются … a. Ba(NO3)2 b. HCl c. AgNO3 d. Cl2 Вопрос 7 В порядке возрастания электроотрицательности элементы расположены в ряду… a. Si, C, N, O b. C, Si, P, S c. C, Si, O, F d. S, P, Si, Al Вопрос 8 Формулы оксидов, которые при растворении в воде образуют кислоты общей формулы Н2ЭО3, имеют вид … a. SO2 b. CO2 c. NO2 d. SiO2 Вопрос 9 Установите соответствие между реагирующими веществами и продуктами реакций S + HNO3(конц.) → S + Cl2(недост.) → S + O2→ 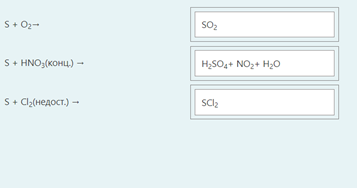 Вопрос 10 Установите соответствие между формулой иона и окраской раствора, которую придает этот ион CrO42‾ Ni2+ Fe3+ Cu2+ MnO4‾ Со2+  Вопрос 11 В схеме превращений Na X→ NaOH Y→ NaHSO3 веществами Х и Y являются … a. H2O b. SO3 c. SO2 d. KHSO3 Вопрос 12 Установите соответствие между веществом и источником его получения сернистый ангидрид водород угарный газ кислород 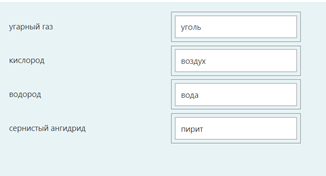 Вопрос 13 В узлах кристаллической решетки фторида кальция располагаются … a. атомы кальция и молекулы фтора b. ионы кальция и ионы фтора c. молекулы CaF2 d. атомы кальция и атомы фтора Вопрос 14 Металлом, который можно получить электролизом водного раствора его соли, является … a. Al b. K c. Cu d. Na Вопрос 15 В окислительно-восстановительной реакции S + NaOH Na2S + Na2SO3 + H2O сера … a. является окислителем b. является и окислителем, и восстановителем c. является восстановителем d. не проявляет окислительно-восстановительных свойств Вопрос 16 Из предложенного перечня выберите две кислоты, при взаимодействии с которыми при нагревании алюминий не вытесняет водород a. H2SO4(конц.) b. HNO3(р-р) c. СH3СООН(р-р) d. H2SO4(разб.) e. HI(р-р) Вопрос 17 Установите соответствие между реагирующими веществами и продуктами их взаимодействия Fe(OH)2 + HCl(конц.) → Fe(OH)2 + HCl(разб.) → Fe(OH)2 + H2SO4(разб.) → Fe(OH)2 + H2SO4(конц.) →  Вопрос 18 Формулы гидроксидов, которые нельзя получить растворением соответствующих оксидов в воде, имеют вид … a. Ca(OH)2 b. Cu(OH)2 c. Ba(OH)2 d. Zn(OH)2 Вопрос 19 Установите соответствие между реагирующими веществами и продуктами их взаимодействия Fe(OH)2 + HCl → Fe3O4 + HCl → FeO + HCl → Fe2O3 + HCl →  Вопрос 20 С растворами гидроксида натрия и соляной кислоты взаимодействуют: a. цинк b. железо c. медь d. магний e. алюминий Вопрос 21 Электронная конфигурация основного состояния валентного энергетического уровня 3d54s0 соответствует иону … a. Fe2+ b. Cr2+ c. Ni2+ d. Mn2+ Вопрос 22 Задана следующая схема превращений веществ: SO3 –X→ H2SO4 –Y→ H2S Определите, какие из указанных веществ являются веществами X и Y. a. H2O b. H2O2 c. ZnS d. Н2 e. K2SO4 Вопрос 23 Установите соответствие между формулой молекулы вещества и типом химической связи, который реализуется между атомами в данной молекуле N2 NaCl Na2O HF H3PO4 P4 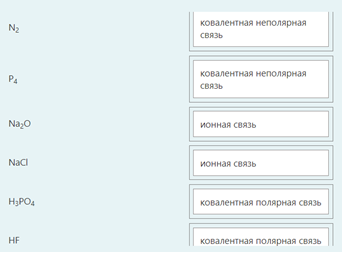 Вопрос 24 Установите соответствие между реагирующими веществами и продуктами(-ом) их взаимодействия Na+H2O→ Na+O2 t0→ NaOH эл. ток→ 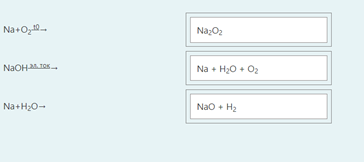 Вопрос 25 Установите соответствие между реагирующими веществами и продуктами их взаимодействия Mg(OH)2 + SO2 (избыток) → Mg(OH)2 + H2SO4 → Mg(OH)2 (избыток) + SO2 → Mg(OH)2 + SO3 →  Вопрос 26 Установите соответствие между простым веществом и основным способом его промышленного получения натрий алюминий железо 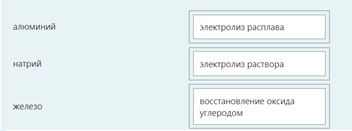 Вопрос 27 Формула вещества, которое способно проявлять только восстановительные свойства, имеет вид … a. NaI b. NaIO3 c. I2 d. I2 e. NaIO4 |
