22. к 10 мл 12,8%ного раствора хлорида бария, плотность которого 1,12 гмл, прибавлен раствор сульфата натрия, в результате чего выпал осадок сульфата бария. Вычислите массу осадка
 Скачать 30.19 Kb. Скачать 30.19 Kb.
|
|
Контрольная работа №2 ХИМИЯ 22. К 10 мл 12,8%-ного раствора хлорида бария, плотность которого 1,12 г/мл, прибавлен раствор сульфата натрия, в результате чего выпал осадок сульфата бария. Вычислите массу осадка. Решение: Взаимодействие хлорида бария с сульфатом натрия приводит к образованию нерастворимого осадка сульфата бария. Протекание этой реакции описывается следующим уравнением: BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl; Вычислим имеющееся химическое количество хлорида бария. Для этого поделим его вес на его молярную массу, равную сумме молярных весов атомов, входящих в молекулу. M(BaCl2) = 137 + 35,5*2 = 208 г/моль; n(BaCl2) = m/M = V*ω*ρ/M = 10*1,12*0,128/208 = 0,00689 моль; При этой реакции будет получено такое же количество осадка. Определим его вес: М(BaSO4) = 137 + 32 + 16*4 = 233 г/моль; m(BaSO4) = M*n = 233*0,00689 = 1,60537 г Ответ: m(BaSO4) = 1,60537г. 40. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Be(OH)2 + 2OH– = BeO22–+ 2H2O; б) СН3СОО– + Н+ = СН3СООН; в) Ba2++ SO42–= BaSO4. Решение: а) Be(OH)2 + 2NaOH → Na2BeO2 + 2H2O б) CH3COOK + HNO3 → CH3COOH + KNO3 в) BaCl2 + FeSO4 → BaSO4↓ + FeCl2 58. Какова концентрация водородных ионов [H+] в 0,1Н растворе синильной кислоты HCN, если ее константа диссоциации КД = 7 *10-10 ? Решение: Концентрация ионов водорода равна: [H+] = α×C(HCN). Степень электролитической диссоциации α можно вычислить, используя формулу:  где С — концентрация электролита, моль/л. Подставив значения, указанные в условии задачи, находим степень диссоциации слабого электролита:  α = √(4,9×10─10/0,1) = 7×10─5. Вычисляем концентрацию ионов водорода: [H+] = 0,1×1×8,37×10─5 = 0,837×10─5 моль/л. Тогда pH = ─lg[H+] = ─lg(0,837×10─5) = 5,08. Ответ: [H+] = 0,837×10─5 моль/л. 76. Определите степень гидролиза (для первой ступени) и рН в 0,001М растворе K2S (Kд(H2S)=1,1*10-7) и Na2CO3 (Кд(H2CO3)=4,45*10-7. Напишите уравнения реакций в молекулярном и ионном виде. Решение: Первая ступень (стадия) гидролиза Молекулярное уравнение K2S + HOH ⇄ KHS + KOH Полное ионное уравнение 2K+ + S2- + HOH ⇄ K+ + HS- + K+ + OH- Сокращенное (краткое) ионное уравнение S2- + HOH ⇄ HS- + OH-.  Степень гидролиза     Первая ступень (стадия) гидролиза Молекулярное уравнение Na2CO3 + HOH ⇄ NaHCO3 + NaOH Полное ионное уравнение 2Na+ + CO32- + HOH ⇄ Na+ + HCO3- + Na+ + OH- Сокращенное (краткое) ионное уравнение CO32- + HOH ⇄ HCO3- + OH-. Na2СО3 - соль, образованная сильным основанием NaOH и слабой кислотой H2СО3.  Степень гидролиза     104. При умягчении 1 л воды израсходовали 0,53 г соды. Определить жесткость воды. Решение: Ж=n(1/z солей) *1000/V(H2O) по закону эквивалентов n(1/z солей) = n(1/zNa2CO3) n(1/2Na2CO3)=m/M=0,53/(106/2)=0,01 моль Ж=0,01*1000/0,5=20 ммоль/л Ответ: Ж=20 ммоль/л. 146. Колба вместимостью 0,75 л, наполненная кислородом, при 15°C имеет массу 115,0 г. Масса пустой колбы 111,5 г. Определите давление газа вколбе. Решение: 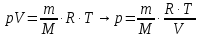 M(O2) = 32 г/моль = 32*10-3 кг/моль; m(O2) =115,0-111,5=3,5 г = 3,5*10-3 кг; R = 8,31 Дж/(моль*К) T = 273,15+15 = 288,15 К V = 0,75л = 0,75*10-3 м3  Ответ: P = 0,3492 МПа. 203. Определите величину электродных потенциалов: а) Cu |0,001М Сu2+; в) Zn |0,002H ZnSO4; б) Ag |0,01H AgNO3; г) Al |0,005M Al2(SO4)3. Решение: При температуре 25°С и давлении 1 атм. величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста: E = E° + (RT/nF)ln(Cок/Cвос), где E – окислительно-восстановительный потенциал данной пары; E°- стандартный потенциал (измеренный при Cок = Cвос); R – газовая постоянная (R = 8,314 Дж); T – абсолютная температура, К n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе; F – постоянная Фарадея (F = 96484,56 Кл/моль); Cок – концентрация (активность) окисленной формы; Cвос– концентрация (активность) восстановленной формы. Подставляя в уравнение известные данные и перейдя к десятичному логарифму, получим следующий вид уравнения: E = E° + (0,059/n)lg(Cок/Cвос) При Cок > Cвос, E > E° и наоборот, если Cок < Cвос, то E < E° а) Cu |0,001М Сu2+ Cu – 2e → Cu2+ (процесс окисления) 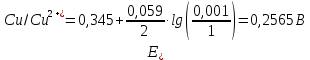 б) Ag |0,01H AgNO3  в) Zn |0,002H ZnSO4;  г) Al |0,005M Al2(SO4)3  213. Электролиз раствора NaI проводили при силе тока 6 А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вычислите массу вещества, выделившегося на катоде и аноде? Решение: NaI → Na+ + I- А: 2I- - 2e → I2 К: 2H2O + 2e → H2 + 2OH- Суммарный процесс: 2NaI + 2H2O → H2↑ + I2 + 2NaOH   Ответ: m(H2) = 0,56г, m(I2) = 71,07г. 225. Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции. Медь не вытесняет водород потому, что в электрохимическом ряду напряжений металлов медь стоит после водорода (т.е. стандартный электродный потенциал у меди больше, чем у водорода). Если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода, потому что образуется гальванопара. Цинк является анодом. Электронные уравнения данного явления: К: 2H+ + 2e → H2 А: Zn0 - 2e → Zn2+ Суммарный процесс: Zn + 2H+ → Zn2+ + H2↑ 263. Определите, чему равен заряд следующих комплексных ионов: [Cr(H2O)4Cl2], [HgBr4], [Fe(CN)6], если комплексообразователями являются Cr3+, Hg2+, Fe3+. Напишите формулы соединений, содержащих эти комплексные ионы. Назовите их. Решение: [Cr3+(H2O)4Cl2-]+ координационный номер 6 [Hg2+Br4-]2- координационный номер 4 [Fe3+(CN)6-]3- координационный номер 6 [Cr(H2O)4Cl2]Cl – хлорид дихлоротетрааквахрома K2[HgBr4] – тетрабромомеркурат (II) калия или тетрабромогидраргират (II) калия; K3[Fe(CN)6] – гексацианоферрат (III) калия (красная кровяная соль). |
