|
выделение миелина. Выделение миелина,модификация. 3. 1 Биохимическая очистка миелина центральной нервной системы
3. Методы
3.1 Биохимическая очистка миелина центральной нервной системы
3.1.1 Подготовка (как минимум за один день до эксперимента)
1. Охладите 500 мл ddH2O до 4 ° C.
2. Приготовьте растворы сахарозы, стерилизуйте их фильтрованием и охладите до 4 ° C.
3. Охладите ротор и адаптеры до 4 С.
3.1.2 Подготовка (в день эксперимента)
1. Охладите центрифугу до 4 ° C.
2. Добавьте ингибиторы протеаз к 50 мл 0,32 М сахарозы (растворите при 4 ° C, затем держите на льду).
3.1.3 Подготовка ткани 1. Охладите 6 центрифужных пробирок Beckman на льду.
2. Недавно препарируйте головной или спинной мозг мышей (см. Примечания 1 и 2).
3. Перенесите половину головного или спинного мозга в 5 мл 0,32 М сахарозы в одной из предварительно охлажденных центрифужных пробирок Beckman.
4. Гомогенизируйте ткань, используя IKA T10 basic Ultra-Turrax (скорость 3).
5. Тщательно очищайте Ultra-Turrax после каждой пробы с помощью 70% EtOH и ddH2O (см. Примечание 3).
3.1.4 Градиент плотности первой сахарозы
1. Поместите еще 6 центрифужных пробирок Бекмана на лед.
2. Перенесите по 6 мл холодной 0,85 М сахарозы в каждую из новых пробирок.
3. Осторожно и медленно нанесите гомогенат (в 0,32 M сахарозы) поверх 0,85 M сахарозы (рис. 1) (см. Примечание 4).
4. Заполните одну пробирку холодной 0,32 M сахарозой на 0,5 см ниже края пробирки и тарируйте другие пробирки 0,32 M сахарозой точно до такого же веса (макс. Разница 0,01 г) (см. Примечание 5).
5. Центрифуга при 75 000 g в течение 30 мин при 4 ° C (ротор TH641 при 24 400 об / мин, ускорение 7, замедление 7); всегда жди вакуума.
6. Неочищенный миелин накапливается на границе 0,32 / 0,85 М сахарозы в виде пушистого облака (рис. 1). Фракция сырого миелина выглядит беловатой, если мышей транскардиально перфузировали физиологическим солевым раствором, или от оранжевого до красноватого, если нет.
3.1.5 Промывка
1. После каждого шага центрифугирования ставьте адаптеры на лед как можно более вертикально.
2. Поместите 6 новых центрифужных пробирок Beckman на лед.
3. Осторожно извлеките центрифужные пробирки из адаптера (могут помочь щипцы).
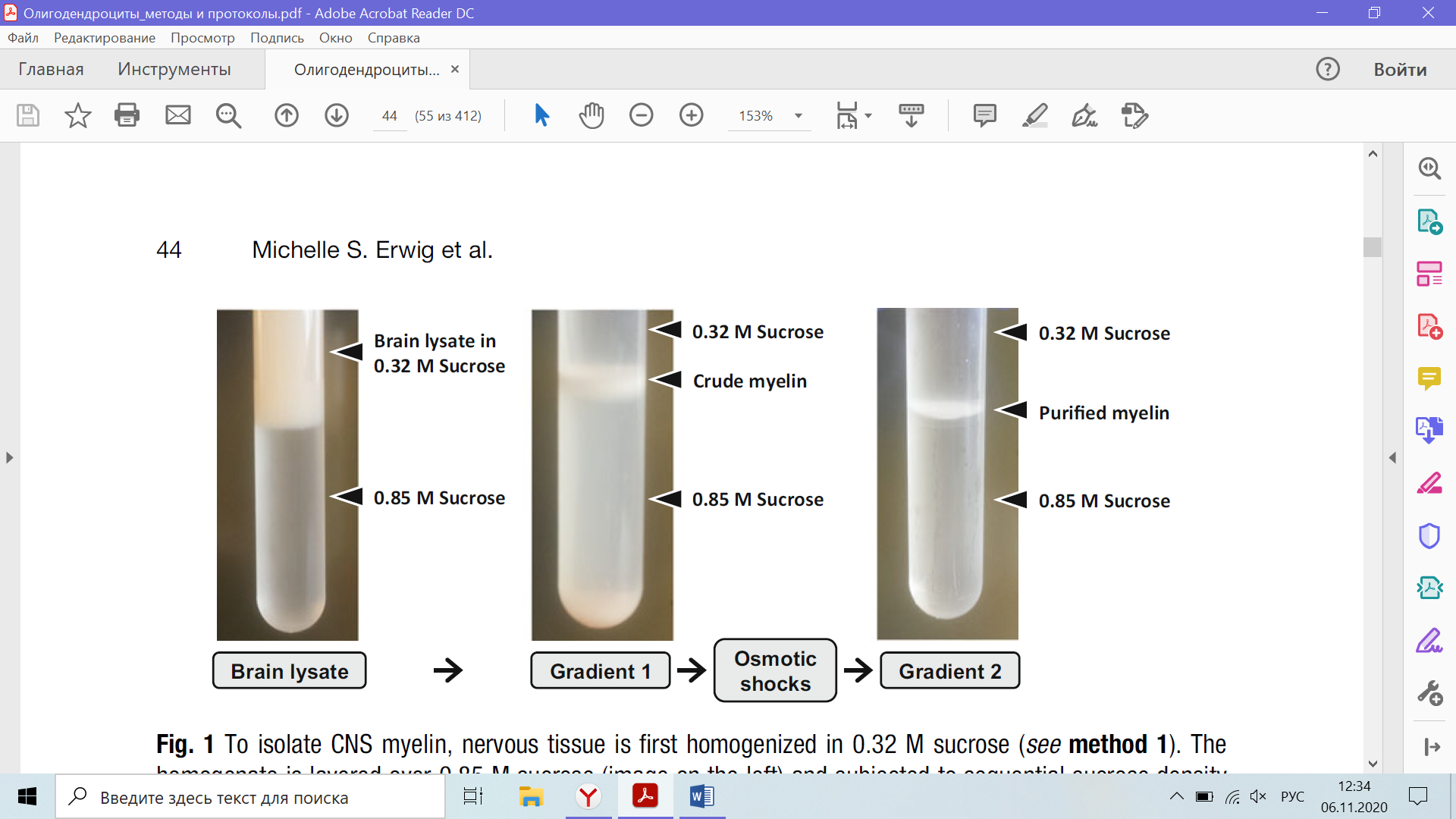
Рис. 1 Для выделения миелина ЦНС нервную ткань сначала гомогенизируют в 0,32 М сахарозе (см. Метод 1). Гомогенат наслаивают на 0,85 М сахарозу (изображение слева) и подвергают последовательному центрифугированию в градиенте плотности сахарозы, прерываемому осмотическими ударами. Во время ультрацентрифугирования обогащенная миелином легкая мембранная фракция накапливается на границе раздела фаз.
4. Соберите интерфейс с помощью пипетки Пастера (будьте осторожны и постарайтесь собрать как можно меньше 0,85M сахарозы) и перенесите его в новые пробирки.
5. Добавьте 1 мл 4 ° C холодного ddH2O и встряхните.
6. Заполните одну пробирку 4-градусным холодным ddH2O на 0,5 см ниже края пробирки и тарируйте другие пробирки ddH2O.
7. Центрифуга при 75 000 g в течение 15 мин при 4 ° C (ротор: TH641 при 24 400 об / мин; ускорение 9, замедление 9); всегда жди вакуума.
3.1.6 Первый осмотический шок
1. Удалите супернатант и удалите оставшуюся жидкость бумажной салфеткой.
2. Добавьте 1 мл холодного ddH2O в каждую пробирку и ресуспендируйте осадок (встряхните).
3. Заполните пробирки холодным ddH2O на 0,5 см ниже края пробирки и инкубируйте 10 мин на льду.
4. Тем временем тарируйте пробирки с ddH2O.
5. Центрифуга при 12000 g в течение 15 минут при 4 ° C (ротор TH641 при 9800 об / мин; ускорение 9, замедление 9); всегда жди вакуума.
3.1.7 Второй осмотический шок
1. Та же процедура, что и при первом осмотическом шоке (см. Выше).
2. Во время центрифугирования добавьте ингибиторы протеаз к 50 мл 0,32 М сахарозы (растворите при 4 ° C, затем держите на льду).
3.1.8 Второй градиент плотности сахарозы
1. Поместите 6 новых центрифужных пробирок Beckman на лед.
2. Удалите супернатант и удалите оставшуюся жидкость бумажной салфеткой.
3. Добавьте 1 мл холодной 0,32 М сахарозы в каждую пробирку и ресуспендируйте осадок (перемешайте на вортексе).
4. Добавьте еще 4 мл холодной 0,32 М сахарозы.
5. Перенесите по 6 мл холодной 0,85 М сахарозы в каждую из новых пробирок.
6. Осторожно и медленно нанесите неочищенный миелин (в 0,32 М сахарозы) поверх 0,85 М сахарозы.
7. Заполните одну пробирку холодной 0,32 М сахарозой на 0,5 см ниже края пробирки и тарируйте другие пробирки 0,32 М сахарозой до того же веса (макс. Разница 0,01 г).
8. Центрифуга при 75 000 g в течение 30 мин при 4 ° C (ротор TH641 при 24400 об / мин, ускорение 7, замедление 7); всегда жди вакуума.
9. Во время центрифугирования разбавьте 10 TBS до 1 TBS и добавьте ингибиторы протеаз (растворить при 4 ° C, затем оставить на льду).
10. Очищенный миелин накапливается на границе раздела в виде пушистого белого облака (рис. 1).
3.1.9 Промывка 1. Поместите 6 новых пробирок для центрифуги Beckman на лед.
2. Соберите интерфейс с помощью пипетки Пастера и перенесите его в новые пробирки (на льду).
3. Заполните одну пробирку холодным ddH2O на 0,5 см ниже края пробирки и тарируйте другие пробирки ddH2O.
4. Центрифуга при 75 000 g в течение 15 мин при 4 ° C (ротор TH641 при 24400 об / мин; ускорение 9, замедление 9); всегда жди вакуума.
5. Удалите супернатант и удалите оставшуюся жидкость бумажной салфеткой.
6. Растворите осадок в 200 мкл холодного 1 TBS (с добавлением ингибитора протеазы).
7. Перенесите миелин (в 1 TBS) в новую пробирку Эппендорфа объемом 1,5 мл и храните при 80 ° C (см. Примечания 6–9).
3.2 1D-гель
Разделение миелина для анализа протеома
Одномерное разделение миелина и иммуноблот-анализ (рис. 2) может служить для проверки обогащения миелиновых белков и уменьшения загрязнения во время биохимической очистки миелина. При стремлении установить белок миелина инвентаризации, использование различных дополнительных протеомных подходов (например, с предварительным фракционированием непереваренных белков или без него) обеспечит наиболее полную, но неколичественную компиляцию компонентов белка. Одномерное (1D) разделение с помощью SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) с последующим триптическим расщеплением в геле, возможно, является самым простым методом подготовки миелина для масс-спектрометрической идентификации его белков, включая очень гидрофобные трансмембранные белки ( например, PLP, OSP / CLDN11) и белки с крайними изоэлектрическими точками (например, MBP, MOBP). Сравнительно низкое разрешение, обеспечиваемое этими гелями, компенсируется хроматографическим разделением протеолитических пептидов перед масс-спектрометрией (МС), подход, часто называемый «GeLC-MS».
3.2.1 1D-SDS-PAGE
Для отделения очищенного миелина мы в основном использовали готовые градиентные гели Бис-Трис 4–12% (8-8 см, толщина геля 1 мм, NuPAGE, Thermo Fisher Scientific) в соответствии с протоколами производителя. Рабочий буфер, содержащий 2- (N-морфолино) этансульфоновая кислота (MES) рекомендуется для хорошего разделения основного белка миелина (MBP) и других небольших белков, тогда как буферная система 3- (N-морфолино) пропансульфоновая кислота (MOPS) [45] улучшает разрешение в диапазоне молекулярных масс. более 25 кДа (рис. 3а). Совсем недавно мы также использовали трис-глициновые 8–16% градиентные гели (7-8 см, толщина геля 1 мм, TG PRiME, Serva), недавно доступные готовые гели, относящиеся к обычно используемой системе Лэммли. Эти гели обеспечивают охват широкого диапазона молекулярной массы и исключительно высокое разрешение для больших белков (рис. 3b). Для последующей масс-спектрометрической идентификации белка обычно 5–10 мкг очищенного миелина на дорожку разделяют с помощью 1D-SDS-PAGE. Если желательна более высокая белковая нагрузка, может потребоваться выполнить делипидирование (см. Подзаголовки 2.3.1 и 3.3.1) перед загрузкой, тем самым предотвращая липидное искажение разделения, особенно в низкомолекулярном диапазоне (т. Е. <20 кДа ). Чтобы истощить растворимые и связанные с мембраной белки и тем самым обогатить трансмембранные белки, фракция миелина может быть подвергнута последовательным циклам промывки / центрифугирования с высоким содержанием соли и высоким pH перед нанесением на гель, как описано ранее [20].
3.3.1 Делипидация / осаждение / солюбилизация
Перед 2D-IEF / SDS-PAGE очищенный миелин сначала делипидируют и осаждают метанолом / хлороформом согласно [48], поскольку липиды и соли ухудшают разрешение во время IEF. Растворимость гидрофобных и гликозилфосфатидилинозитол (GPI) - заякоренных миелиновых белков значительно улучшается цвиттерионным детергентом амидосульфобетаином ASB-14 по сравнению с обычно используемым 3 - [(3-холамидопропил) -диметиламмонио] -1-пропансульфонатом [49] , тем самым повышая их разрешение с помощью 2D-IEF / SDS-PAGE.
1. Оттаять образец миелина на льду (сама процедура осаждения выполняется при комнатной температуре (RT)).
2. Перенесите 150 мкл очищенного миелина (типичная концентрация белка 4 мкг / мкл) в пробирку на 1,5 мл (предпочтительно Eppendorf Safe-Lock) (см. Примечание 14).
3. Добавьте 600 мкл метанола; вихрь.
4. Добавьте 300 мкл хлороформа; вихрь.
5. Добавьте 450 мкл ddH2O.
6. Центрифуга при 9000 g в течение 1 мин (белки накапливаются на границе раздела).
7. Удалите верхнюю фазу пипетированием.
8. Добавьте 450 мкл метанола и встряхните.
9. Центрифуга при 16 100 g в течение 5 мин для осажденных белков.
10. Удалите супернатант пипеткой.
11. Высушите гранулы (используйте поток азота; не сушить полностью).
12. Добавьте 50 мкл буфера для гомогенизации и тщательно солюбилизируйте (ультразвуковая ванна или циклы замораживания / оттаивания помогают растворить осадок; без перемешивания для предотвращения пенообразования); предотвращать нагревание выше 37 ° C, чтобы избежать карбамилирования белка (см. Примечание 15).
13. Центрифуга при 10 000 g в течение 2 мин.
14. Перенесите супернатант в новую пробирку на 1,5 мл.
15. Определите концентрацию белка с помощью набора 2D-Quant (GE Healthcare) (см. Примечание 16). |
|
|
 Скачать 367.89 Kb.
Скачать 367.89 Kb.