задачи кинетика. 350. Константа скорости взаимодействия глюкозы с гексокиназой равна 310
 Скачать 23.6 Kb. Скачать 23.6 Kb.
|
|
3-49. Реакция первого порядка проходит на 20 % за 50 мин. Вычислите скорость реакции при концентрации реагента 0,001 моль/л. 3-50. Константа скорости взаимодействия глюкозы с гексокиназой равна 3×109 л/(моль×с). Чему равна скорость реакции при концентрации глюкозы 3×10-3 моль/л, гексокиназы - 1×10-5 моль/л? 3-51. Константа скорости взаимодействия пиррола с хлорметаном равна 9×10-8 л/(моль×с). Вычислите скорость реакции обоих растворов с концентрацией 0,1 моль/л после смешения равных объемов реагентов. 3-52. Константа скорости разложения оксида азота(V)при 55 °С по реакции 2N2O5 → 4NO2 + O2 равна 1,7·10-3. В сосуд объемом 5 л ввели 2 моль оксида азота(V). Чему будет равна скорость реакции в тот момент, когда в реакционной смеси а) образуется 0,1 моль кислорода; б) образуется 0,1 моль оксида азота(IV); в) останется 0,1 моль оксида азота(V)? 3-53. Константа скорости реакции (CH3CO)2O + Н2О Û 2СН3СООН при 15 °С 0,04554 мин-1. Исходная концентрация уксусного ангидрида была равна 0,5 моль/л. Чему будет равна скорость реакции в тот момент, когда концентрация уксусной кислоты станет равной 0,1 моль/л? 3-54. Для реакции 2NO + О2 Û 2NO2 скорость реакции рассчитывается как изменение концентрации кислорода в системе в единицу времени. При увеличении концентрации NO в 2 раза реакция ускоряется в 4 раза, а при таком же увеличении концентрации кислорода в 2 раза. Константа скорости реакции равна при 37 °С 2500 л/(моль×с). Вычислите скорость реакции при с (NO) = с(О2) = 0,005 моль/л. 3-55. Вычислите константу скорости реакции А + В 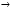 АВ, если при концентрациях веществ А и В, равных соответственно 0,5 моль/л и 0,1 моль/л, ее скорость равна 0,005 моль/(л×мин). АВ, если при концентрациях веществ А и В, равных соответственно 0,5 моль/л и 0,1 моль/л, ее скорость равна 0,005 моль/(л×мин). 3-56. Константа скорости гидролиза этилового эфира фенилаланина при рН 7,3 и t = 20 °С в присутствии ионов меди равна 2,67×10-3 с-1. Начальная концентрация эфира равна 0,2 моль/л. Чему будет равна скорость реакции по истечении двух периодов полупревращения? 3-57. Константа скорости разложения хлорида фенилдиазония в воде при 50 °С равна 0,071 мин-1. Сколько времени нужно нагревать раствор с начальной концентрацией, равной 0,03 моль/л, чтобы концентрация стала равна 0,0001 моль/л? 3-58. Для определения объема эритроцитарной массы используют препарат человеческих эритроцитов, меченый радионуклидом хром-51. Сколько времени должно пройти с момента ввода препарата в кровяное русло, чтобы в организме осталось 1/10 часть введенного изотопа хрома? 3-59. В 1952 году в организм человека попал радионуклид стронций-90. В каком году его останется 40 %? 3-60. Период полупревращения реакции замещения лигандов, протекающей по уравнению [Co(NH3)5Cl]2+ + H2O Û [Co(NH3)5(H2O)]3+ + Cl- равен 82 час. Вычислите, сколько времени необходимо для того, чтобы в реакцию вступило: а) 10 %, б) 90 % исходного соединения. 3-61. Период полупреврашения гидролиза хлорофоса при pH = 8,0 и t = 22 °С равен 3,1 сут. Вычислите время за которое: а) в реакцию вступает 10 % исходного пестицида; б) не вступившим в реакцию остается 10 % исходного количества пестицида. 3-62. При лечении онкологических заболеваний в опухоль вводят препарат, содержащий радионуклид иридий-192. Какая часть введенного радионуклида останется в опухоли через 10 суток? 3-63. Для проведения исследований были взяты равные массы двух радионуклидов: цезий-137 и цирконий-95. Какая часть 95Zr останется к тому моменту, когда 2 % 137Cs подвергнется распаду? 3-64. Минеральные воды Железноводска содержат повышенное количество радионуклида радона-222. Оцените, какая часть радионуклида 222Rn останется в организме через месяц после его поступления. 3-65. Во время аварии на Чернобыльской АЭС (апрель 1986) среди других радионуклидов произошел выброс цезия-137. Какая часть попавшего в организм пострадавших радионуклида осталась в настоящее время? 3-66. Период полупревращения некоторой реакции первого порядка равен 30 мин. Какая часть от первоначального количества вещества останется через час? 3-67. Константа скорости гидролиза пестицида фенурона при 18 °С и pH 8,8 равна 4,3 10-6 мин-1. Исходная концентрация пестицида в пробе воды равна 0,05 моль/л. За какое время концентрация снизится до 0,01 моль/л? 3-68. Константа скорости гидролиза атропин-основания при 40 °С равна 0,316 с-1. Массовая доля атропин-основания в растворе была равна 2,5 %. Спустя какое время значение массовой доли станет равным 0,1 %? 3-69. Гидролиз инсектицида в воде при 20 °С протекает с константой скорости 2,5 год-1. Некоторое количество инсектицида было смыто в озеро, где средняя его концентрация составила 0,72 мкг/мл. Вычислите время, необходимое для уменьшения концентрации инсектицида в озере до 0,30 мкг/мл. 3-70. Константа скорости гидратации оксида углерода (IV) равна 0,03 с-1, а константа скорости переноса протона от имидазольной группы 10 с-1 (при t = 25 °С). У какой реакции период полупревращения будет больше и во сколько раз? 3-71. Константа скорости гидролиза аспирина при 25 °С составляет: при рН 2,5 k = 0,001 час-1, при рН 11 k = 10 cyт-1. Рассчитайте период полупревращения реакции гидролиза аспирина при разных pН. 3-72. Константа скорости разложения оксида азота(V) равна при 25 °С 3,46×10-5 с-1. Вычислите период полупревращения этой реакции. 3-73. Константа скорости инактивации пенициллина при 310 К равна 0,02 час-1. Рассчитайте период полупревращения этой реакции. 3-74. В реакции первого порядка уменьшение исходного вещества на 20 % произошло за 15 мин. Рассчитайте период полупревращения этой реакции. 3-75. Период полупревращения реакции первого порядка равен 10 минутам. За какое время произойдет уменьшение исходного количества вещества в 8 раз? 3-76. Некоторая реакция протекает по первому порядку. 60 % вещества претерпевает изменение за 30 минут. Какая часть вещества (в процентах от исходного) останется через час? 3-77. Пестицид азинфос-метил гидролизуется при различных значениях рН с разной скоростью. Период полупревращения равен при 20 °С при рН 1,5 t0,5 = 24,0 час, а при рН 9,0 τ0,5 = 0,6 час. Какая масса пестицида (в % от исходной) останется через 1 час в каждом случае? 3-78. Реакции I, II, III протекают по кинетическим уравнениям: (I) v = kc; (II) v = k; (III) v = kc2. При начальной концентрации реагента, равной 0,9 моль/л в каждой реакции, период полупревращения каждой реакции составил 90 минут. Вычислите период полупревращения через 90 минут для каждой из трех реакций. 3-79. Для реакции синтеза иодоводорода из простых веществ энергия активации равна 166 кДж/моль, а предэкспоненциальный множитель в уравнении Аррениуса 1,6× 1014 мл/(моль×час) при 350 К. Вычислите константу скорости реакции. 3-80. Некоторая реакция характеризуется следующими параметрами уравнения Аррениуса: А = 1,5·1011 л/(моль×с), Еа = 86,2 кДж/моль. Рассчитайте константу скороcти при 15 °С. 3-81. Для прямой реакции Ea= 70 кДж/моль; DН° = 35 кДж/моль. Чему равны энергия активации и стандартная энтальпия обратной реакции? 3-82. Во сколько раз возрастет скорость реакции при повышении температуры от 20 °С до 100 °С если энергия активации реакции равна 125,5 кДж/моль? 3-83. Разложение некоторого лекарственного вещества в растворе является реакцией первого порядка с энергией активации 80 кДж/моль. Период полупревращения при 20 °С равен 50 часам. Рассчитайте время, за которое разложится 15 % этого вещества при 37 °С. 3-84. Энергия активации некоторой реакции первого порядка равна 80 кДж/моль. При 25 °С за 10 мин вступает в реакцию 30 % вещества. Какая масса (в % от исходной) вещества вступает в реакцию за то же время при 45 °С? 3-85. Денатурация вируса - процесс первого порядка с энергией активации 630 кДж/моль. Период полупревращения при 30 °С равен 5 часам. Рассчитайте период полупревращения при 37 °С. 3-86. Константа скорости разложения амизила в растворе при 20 °С равна 2,89×10-5 час-1. Энергия активации составляет 96 кДж/моль. Рассчитайте период полупревращения при 40 °С. 3-87. При повышении температуры на 20 °С период полупревращения некоторой реакции первого порядка уменьшается в 6,25 раза. Чему равна энергия активации этой реакции в диапазоне температур 310 – 330 К? 3-88. Рассчитайте период полупревращения реакции при температуре 313 К, если энергия активации реакции равна 50 кДж/моль, а константа скорости при температуре 293 К равна 0,05 мин-1. 3-89. Рассчитайте период полупревращения реакции при температуре 350 К, если энергия активации реакции равна 75 кДж/моль, а константа скорости при температуре 298 К равна 4×10-3 с-1. 3-90. Рассчитайте период полупревращения реакции при температуре 77 °С, если энергия активации реакции равна 65 кДж/моль, а константа скорости при температуре 37 °С равна 0,25 час-1. 3-91. Рассчитайте период полупревращения реакции при температуре 67 °С, если энергия активации реакции равна 70 кДж/моль, а константа скорости при температуре 320 К равна 3,45 с-1. 3-92. Вычислите константу скорости при температуре 350 К, если энергия активации реакции первого порядка равна 65 кДж/моль, а период полупревращения при 310 К составляет 15 с. 3-93. Константа скорости разложения оксида азота(V) равна при 35 °С 8,76×10-3 мин-1, а при 45 °С 2,99×10-2 мин-1. Вычислите энергию активации в указанном интервале температур. 3-94. Периоды полупревращения денатурации некоторого вируса равны: при 30 °С 5 час, при 37 °С 1,76×10-2 часа. Вычислите энергию активации процесса. 3-95. Период полупревращения некоторой реакции первого порядка равен при 40 °С 1 мин 34 секундам. Константа скорости этой реакции при 20 °С равна 8,6×10-2 мин-1. Вычислите энергию активации реакции. 3-96. Реакция проходит на 20 % за 15 минут при 40 °С и на 30 % за 3 минуты при 60 °С; n = 1. Вычислите энергию активации в интервале температур. 3-97. Вычислите энергию активации гидролиза этилацетата в щелочном растворе в интервале от 10 °С до 45 °С, температурный коэффициент константы скорости равен 1,9. 3-98. Вычислите энергию активации взаимодействия иода с водородом в газовой фазе в интервале от 283 °С до 293 °С, температурный коэффициент константы скорости равен 2,5. 3-99. Вычислите энергию активации спиртового брожения глюкозы в растворе в интервале от 30 °С до 70 °С, температурный коэффициент константы скорости равен 2,0. 3-100. Вычислите энергию активации окисления сульфата железа(II) хлоратом калия в среде серной кислоты в интервале от 10 °С до 32 °С, температурный коэффициент константы скорости равен 2,4. 3-101. При повышении температуры с 15 °С до 25 °С период полупревращения некоторой реакции первого порядка уменьшается в 3,5 раза. Вычислите энергию активации этой реакции. 3-102. Рассчитайте энергию активации реакции, протекающей при обычных температурах (приблизительно 300 К) и имеющую а) минимальное; б) максимальное значение температурного коэффициента, отвечающего правилу Вант- Гоффа. 3-103. Константа скорости некоторой реакции равна при 10 °С 0,5 мин-1. Вычислите период полупревращения этой реакции при 35 °С (температурный коэффициент реакции равен 2). 3-104. Температурный коэффициент скорости реакции первого порядка равен 3. Период полупревращения при 30 °С составляет 1,5 час. Рассчитайте период полупревращения при 50 °C. 3-105. Вычислите температурный коэффициент константы скорости реакции разложения трихлоруксусной кислоты в воде (20 °С - 40 °С), Еa= 155 кДж/моль. 3-106. Вычислите температурный коэффициент константы скорости реакции гидролиза сахарозы в кислом водном растворе ( 10 °С -50 °С), Еа = 107 кДж/моль. 3-107. Вычислите температурный коэффициент константы скорости реакции разложения ацетондикарбоновой кислоты в водном растворе (20 °С - 40 °С), Еа = 97 кДж/моль. 3-108. При повышении температуры от 25 °С до 45 °С скорость реакции увеличилась в 7 раз. Вычислите температурный коэффициент скорости реакции. 3-109. При повышении температуры от 20 °С до 40 °С скорость реакции увеличилась в 6 раз. Вычислите температурный коэффициент и энергию активации реакции. 3-110. При повышении температуры на 8,5 °С время прохождения реакции на 25 % уменьшилось с 16,5 мин до 7,3 мин. Вычислите температурный коэффициент скорости реакции и энергию активации при 300 К. 3-111. Энергия активации реакции разложения некоторого вещества равна 75 кДж/моль, а обратной реакции - 265 кДж/моль. Рассчитайте температурный коэффициент скорости прямой реакции в интервале 60 - 80 °С и стандартную энтальпию реакции. 3-112. Константы скорости разложения иодоводорода равны: при 356 °С k = 3,02×10-5 л/(моль×с), при 427 °С k = 1,16×10-3 л/(моль×с). Вычислите константу скорости при 400 °С. 3-113. Константы скорости синтеза иодоводорода из простых веществ равны: при 302 °С k = 0,475 л/(моль×час), при 374 °С k = 18,8 л/(моль×час). При какой температуре константа скорости равна 1 л/(моль×час)? 3-114. Оцените, во сколько раз возрастает скорость реакции разложения ацетондикарбоновой кислоты в водном растворе при 298 К, если энергия активации реакции в отсутствие катализатора равна 97 кДж/моль, а в присутствии анилина снижается на 40 %. Условно считать, что величина предэкспоненциального множителя не меняется. 3-115. Энергия активации разложения диэтилового эфира в газовой фазе при 80 °С равна 224 кДж/моль. Оцените, во сколько раз возрастает скорость реакции при введении иода в качестве катализатора, если известно, что энергия активации при этом снижается в 1,56 раза. Условно считать, что величина предэкспоненциального множителя не меняется. 3-116. Во сколько раз уменьшится период полупревращения реакции первого порядка при введении в реакционную смесь катализатора, если он снижает энергию активации на 45 кДж/моль (Т = 298 К)? Условно считать, что величина предэкспоненциального множителя не меняется. 3-117. Энергия активации разложения пероксида водорода составляет 75 кДж/моль. В присутствии коллоидной платины она уменьшается до 49 кДж/моль, а в присутствии каталазы до 23 кДж/моль. Во сколько раз изменяют скорость реакции обычный катализатор и фермент при 300 К. Условно считать, что величина предэкспоненциального множителя не меняется. 3-118. Разложение ацетальдегида в газовой фазе до метана и оксида углерода(II) ускоряется в 100 раз в присутствии паров иода. При 800 К энергия активации реакции без катализатора равна 190 кДж/моль. Вычислите энергию активации реакции в присутствии катализатора. Условно считать, что величина предэкспоненциального множителя не меняется. 3-119. Константа скорости некоторой реакции при 310 К равна 0,543 с-1, а константа скорости той же реакции в присутствии катализатора - 9,4 л/(моль×с). На сколько уменьшится энергия активации при применении катализатора? Условно считать, что величина предэкспоненциального множителя не меняется. 3-120. Константа скорости реакции первого порядка при 310 К равна 0,543 мин-1. Константа скорости той же реакции в присутствии катализатора 9,4 мин-1. Вычислите, во сколько уменьшится энергия активации при введении катализатора. Условно считать, что величина предэкспоненциального множителя не меняется. 3-121. Константа скорости реакции первого порядка при 330 К равна 0,2 час-1. Период полупревращения той же реакций в присутствии катализатора составляет 55 с. Вычислите, на сколько уменьшится энергия активации при введении катализатора. Условно считать, что величина предэкспоненциального множителя не меняется. 3-122. Гидролиз сахарозы в кислом растворе характеризуется энергией активации 107 кДж/моль. В присутствии фермента фруктофуранозидазы энергия активации снижается до 40 кДж/моль. Во сколько раз уменьшится период полупревращения при 310 К для каталитической реакции? Условно считать, что величина предэкспоненциального множителя не меняется. |
