лабораторные работы. Лабораторная работа 1а. Определение энтальпии диссоциации слабого электролита Оборудование и реактивы
 Скачать 1.91 Mb. Скачать 1.91 Mb.
|
Лабораторная работа № 1а. Определение энтальпии диссоциации слабого электролитаОборудование и реактивыСтеклянный стакан объемом 500 мл – 1 шт.; фарфоровый или стеклянный внешний стакан объемом 750 мл – 1 шт.; стеклянный стакан объёмом 50 мл – 1 шт.; стеклянная палочка для перемешивания – 1 шт.; кристаллизатор – 1 шт.; штатив с лапками – 1 шт.; термометр Бекмана – 1 шт.; мерный цилиндр объемом 25 мл – 1 шт.; мерный цилиндр объемом 500 мл – 1 шт.; секундомер, весы, раствор слабой кислоты (уксусной или муравьиной) концентрацией 0,1 или 0,2 моль/л; гидроксид натрия или калия – раствор концентрацией 1 моль/л. Выполнение работы1. Получить у преподавателя наименование слабой кислоты, с которой будет выполняться эксперимент. 2. Взвесить на технических весах внутренний стакан калориметрической установки и стеклянную палочку-мешалку (т.е. все стеклянные части установки вместе!). 3. Определить объем ртутного баллона термометра. Для этого опустить «нос» термометра в мерный цилиндр объемом 25 мл, куда предварительно налито около 15 мл воды и, по разности уровней жидкости в цилиндре, определить объем ртути, VHg. 4. Во внутренний стакан калориметрической установки поместить 300 мл раствора кислоты Vк (отбирать цилиндром на 500 мл). Массу раствора считать равной 300 г, т.к. раствор разбавленный и его плотность можно считать равной единице. 5. В химический стакан объёмом 50 мл налить около 20 мл раствора щелочи и взвесить. По разности определить массу щелочи mщ = mстакана с раствором mстакана. 6. Собрать калориметрическую установку: в фарфоровый стакан поместить стеклянный стакан с раствором кислоты, положить палочку для перемешивания и аккуратно опустить в раствор термометр Бекмана. 7. Для установления температурного равновесия перед началом опыта выждать 2-3 мин, помешивая раствор кислоты в стакане. 8. Пустить секундомер и через каждые 30 секунд записывать показания температуры (см. табл.) по термометру Бекмана в течение 5 минут (10 показаний) при постоянном перемешивании (начальный период). 9. Не прекращая отсчета времени и измерения температуры!!! вылить щелочь в кислоту. По-прежнему через каждые 30 секунд записывать показания термометра Бекмана до установления до установления равномерного изменения температуры в калориметрической установке (главный период). 10. Получить еще 10 показаний при равномерном изменении температуры в калориметрической установке (конечный период). Содержание протокола лабораторной работы1. Название слабой кислоты и ее химическая формула. 2. Концентрация раствора слабой кислоты Ск. 3. Масса стеклянных частей mcт. = __________, г. 4. Масса внутреннего стакана калориметрической установки mстакана, г. 5. Масса раствора mр-ра, г. 6. Масса щелочи mщ, г и ее химическая формула. 7. Объем раствора щелочи Vщ, мл. 8. Концентрация раствора щелочи Сщ, моль/л. 9. Объем ртутного баллона термометра VHg, мл. 10. Измерения температуры:
Обработка результатов эксперимента1. Результаты эксперимента оформить в виде таблицы:
2. Построить графики зависимости Т = f(τ), отражая показания температуры по начальному и конечному периодам 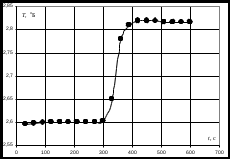 Пример построения зависимости изменения температуры от времени. 3. Обработать полученные графические зависимости по следующей схеме. = Провести линии тренда для начального и конечного периодов. = Соединить последнюю точку начального периода с начальной точкой конечного периода. = Полученную линию разделить пополам. = Через точку середины провести перпендикуляр к оси абсцисс. = Продлить линии тренда начального и конечного периодов до пересечения с перпендикуляром – получим значение изменения температуры Т 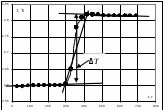 Пример графической обработки результатов эксперимента. 4. Рассчитать теплоемкость калориметрической установки по уравнению: Сcal = Cр-р(mp-p + mщ) + СHgVHg + Cстm, Дж/К, где Cр-р – удельная теплоемкость раствора, 4,18 Дж/гК; mp-p – масса раствора во внутреннем стакане, г; mщ – масса раствора щелочи в пипетке, г; СHg – объемная теплоемкость ртути и стекла, 1,92 Дж/см3К, VHg – объем баллона термометра, содержащего ртуть, мл; Cст – удельная теплоемкость стекла, 0,79 дж/гК; m – общая масса стеклянных частей калориметрической установки, г. 5. Вычислить тепловой эффект процессов нейтрализации и диссоциации по уравнению: где nщ – количество вещества щелочи в пипетке, моль, где Сm – моляльная концентрация раствора щелочи (KOH или NaOH), моль/кг; 6. Пользуясь справочными данными рассчитать 7. Вычислить изменение энтальпии диссоциации по уравнению: dissH = rH neutrH. 8. Оценить относительную инструментальную ошибку: 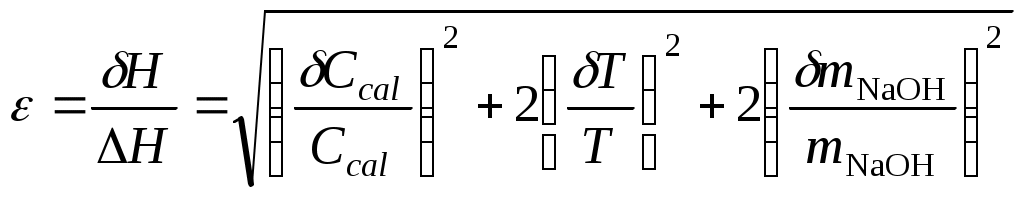 . .Относительную погрешность расчетного определения теплоемкости системы 9. Рассчитать абсолютную погрешность измерения теплового эффекта. Ответ записать по форме: Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
